
- •Ферменты как биологические катализаторы. Энергетический барьер химических реакций и способы его преодоления. Отличия ферментов от минеральных катализаторов.
- •Строение энзимов. Понятие об апоферменте, коферменте, холоферменте. Их роль. Химическая природа коферментов.
- •Функциональные центры ферментов, их строение и роль. Комплементарность субстрата и эффекторов структуре функциональных центров. Понятие о косубстрате.
- •Теории ферментативного катализа (теории Фишера и Кошланда; современные представления о механизме действия энзимов).
- •Специфичность энзимов. Виды специфичности (абсолютная субстратная и относительная субстратная, стереоспецифичность).
- •Изоэнзимы как множественные формы одного фермента. Особенности строения мультиэнзимных комплексов. Примеры мультиэнзимов и изоферментов.
- •Классификация и номенклатура ферментов. Характеристика отдельных классов. Примеры катализируемых реакций.
- •Применение ферментов в медицине. Использование ферментов в пищевой промышленности. Ферменты как компоненты моющих средств
Теории ферментативного катализа (теории Фишера и Кошланда; современные представления о механизме действия энзимов).
Теория Фишера (модель "жесткой матрицы", "ключ-замок") – активный центр фермента строго соответствует конфигурации субстрата и не изменяется при его присоединении. Эта модель хорошо объясняет абсолютную специфичность, но не групповую.
В 1958 г. Дениел Кошланд предложил модификацию модели «ключ-замок». Ферменты, в основном, — не жесткие, а гибкие молекулы. Активный центр фермента может изменить конформацию после связывания субстрата. Боковые группы аминокислот активного центра принимают такое положение, которое позволяет ферменту выполнить свою каталитическую функцию. В некоторых случаях молекула субстрата также меняет конформацию после связывания в активном центре. В отличие от модели «ключ-замок», модель индуцированного соответствия объясняет не только специфичность ферментов, но и стабилизацию переходного состояния. Эта модель получила название «рука-перчатка». (Она ещё называется «теория индуцированного соответствия» и она является так же современным представлением об механизме действия ферментов)
Теория действия ферментов была предложена БЕЙЛИСОМ и ВАНБУРГОМ. Согласно ей, фермент представляет собой "губку", которая адсорбирует на своей поверхности молекулы реагирующих веществ. Она как бы стабилизирует их, способствует взаимодействию. Было введено понятие о F-S комплексе. Фермент взаимодействует с субстратом, образуя нестойкий промежуточный F-S комплекс, который затем распадается с образованием продуктов реакции (Р) и освобождением фермента. В этом процессе выделяют несколько стадий:
1. Диффузия S к F и их СТЕРИЧЕСКОЕ взаимодействие с образованием F-S комплекса. Эта стадия не продолжительна. На этой стадии практически не происходит понижения энергии активации.
2.Преобразование F-S комплекса в один или несколько активированных комплексов. Эта стадия является наиболее продолжительна. При этом происходит разрыв связей в молекуле субстрата, образование новых связей. Е активации
3.Освобождение продуктов реакции от фермента и поступление их в окружающую среду.
Кинетика ферментативных реакций. Неспецифические и специфические факторы, влияющие на скорость ферментативных реакций (температура, рН среды, концентрация субстрата, фермента, кофермента, присутствие эффекторов).
Зависимость от температуры
Ферменты – вещества белковой природы, проявляют максимальную активность в ограниченном температурном режиме. При температурах не выше 40-50С скорость реакции увеличивается согласно теории химической кинетики. При более высоких температурах тепловая денатурация фермента приводит к полному прекращению ферментативной реакции. Термолабильность ферментов отличает ферменты от неорганических катализаторов.
|
|
Зависимость от рН среды
Оптимум рН действия большинства ферментов лежит в пределах физиологических значений 6,0-8,0. Пепсин активен при рН 1,5-2,0, что соответствует кислотности желудочного сока. Аргиназа, специфичный фермент печени, активен при 10,0. Влияние рН среды на скорость ферментативной реакции связывают с состоянием и степенью ионизации ионогенных групп в молекуле фермента и субстрата. Этот фактор определяет конформацию белка, состояние активного центра и субстрата, формирование фермент-субстратного комплекса, собственно процесс катализа.
|
|
Зависимость от концентрации фермента
При постоянной концентрации субстрата существует прямо пропорциональная зависимость между скоростью реакции и концентрацией фермента [E] в реакционной смеси. Другими словами, для данной концентрации субстрата скорость реакции возрастает в 2 раза при двукратном увеличении концентрации фермента. |
|
Зависимость от концентрации субстрата
При низких концентрациях субстрата скорость прямо пропорциональна его концентрации, далее с ростом концентрации скорость реакции увеличивается медленнее, а при очень высоких концентрациях субстрата скорость практически не зависит от его концентрации и достигает своего максимального значения (Vmax). При таких концентрациях субстрата все молекулы фермента находятся в составе фермент-субстратного комплекса, и достигается полное насыщение активных центров фермента, именно поэтому скорость реакции в этом случае практически не зависит от концентрации субстрата. |
|
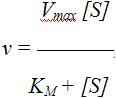 График
зависимости активности фермента от
концентрации субстрата описывается
уравнением Михаэлиса – Ментен, которое
получило свое название в честь выдающихся
ученых Л.Михаэлиса и М.Ментен, внесших
большой вклад в исследование кинетики
ферментативных реакций, где v
– скорость ферментативной реакции; [S]
– концентрация субстрата; KM –
константа Михаэлиса.
График
зависимости активности фермента от
концентрации субстрата описывается
уравнением Михаэлиса – Ментен, которое
получило свое название в честь выдающихся
ученых Л.Михаэлиса и М.Ментен, внесших
большой вклад в исследование кинетики
ферментативных реакций, где v
– скорость ферментативной реакции; [S]
– концентрация субстрата; KM –
константа Михаэлиса.
Зависимость от концентрации коферментов
Например, если в организме не хватает витаминов, то не синтезируется достаточное количество коферментов, тогда будет наблюдаться заниженная ферментативная активность. Такая же ситуация может иметь место при недостаточности ферментов синтеза коферментов из витаминов. Важно помнить также, что для проявления активности многих ферментов необходимо присутствие ионов металлов, которые выступают в роли кофакторов.
Присутствие эффекторов
???




