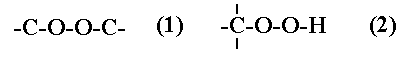- •Глава 2. Молекулярные Механизмы взаимодействия озона c компонентами живых клеток
- •2.1.Озонолиз
- •2.2. Реакции озона с индивидуальными компонентами
- •2.2.1. Реакции озона с липидами.Перекисное окисление липидов
- •2.2.2. Реакции озона с аминокислотами и белками
- •2.2.3. Реакции озона с аминами
- •2.2.4. Взаимодействие озона с нуклеиновыми кислотами
- •2.2.5. Реакции озона с надн и надфн
- •2.2.6. Реакции озона с регуляторами роста и развития
- •2.3.1.Cвободные радикалы
- •2.3.2.Перекиси
- •2.3.3. Механизмы действия активных форм кислорода, образуемых озоном
2.3.2.Перекиси
Перекиси имеют группировку (1), тогда как у гидроперекиси водород присоединен к перекисной группе (2). При озонолизе образуются перекись водород и органические перекиси.
. Перекиси и гидроперекиси образуются в реакциях озона с непредельными углеводородами, которые могут происходить как в атмосферном воздухе, так и апопласте растительных клеток. Другим источником перекисных соединений может быть перекисное окисление липидов.
Помимо перекисей образующихся при озонолизе в живых системах, озон способен продуцировать перекиси в атмосфере и воде, что также влияет и на клетки организмов. С помощью жидкостной хроматографии высокого разрешения показано, что в дождевой воде и атмосферном воздухе содержатся перекись водорода, гидроксиметилпероксид, гидроксиэтилпероксид и метилпероксид. Органические пероксиды часто образуются при реакции озона с углеводородами и органическими радикалами. Они также образуются, когда озон реагирует с алкилненасыщенными соединениями. Органические пероксиды как продукты реакции озона с углеводородами обнаружены в листьях растений. Пероксиды образуются у растений, выделяющих, главным образом этилен, изопрен, монотерпены.
Самая
распространенная перекись в клетках,
перекись водорода образуется в любой
биологической системе, где образуется
супероксидрадикал. В результате
дисмутации
![]() появляются
перекись водорода и синглетный кислород:
появляются
перекись водорода и синглетный кислород:
![]()
Н2О2 может образовываться в реакции озона с ненасыщенными углеводородами по схеме :
ненасыщенные углеводороды + О3 + Н2О окисленный продукт + Н2О2
В молекуле перекиси водорода связь между О-О непрочна, поэтому молекула легко превращается в гидроксильный радикал. Токсичность Н2О2 связана именно с ее способностью образовывать гидроксил радикал Н , который обладает высокой химической активностью.
Подобно супероксидрадикалу Н2О2 может действовать и как окислитель и как восстановитель. Она способна окислять такие соединения, например, как тиолы, например восстановленный глутатион (GSH) превращается при этом в окисленный (GSSG):
2GSH + H2O2 GSSG + 2H2O
В реакции с супероксидионом перекись водорода образует наиболее активный гидроксилрадикал.
![]()
Перекиси не только побочные и нежелательные продукты окисления, токсичные для организма. Они являются универсальным сырьем, которое используется организмом для самых разнообразных целей. Перекисное окисление липидов следует считать нормальным физиологическим процессом, а перекиси - продуктами обмена нормальных метаболизирующих клеток. Перекиси липидов являются интермедиатами, которые используются организмом для синтеза биологически активных веществ: простагландинов, стероидных гормонов и т.д.
2.3.3. Механизмы действия активных форм кислорода, образуемых озоном
Активные формы кислорода обладают широким спектром действия на живые клетки. Их образованием могут объясняться многие биологические эффекты озона. В таблице 2 суммированы механизмы действия свободных
Таблица 2. Механизмы действия активных форм кислорода на клетки
Форма АК |
Биологическое действие |
|
Индукция
ПОЛ; образование Н |
Н 2 |
Индукция ПОЛ; переход в Н2О2 при взаимодействии с органическими молекулами и в . Обладает цитотоксическим действием |
Н2О2 |
Цитотоксичность; образование - Н в реакции Фентона (H2O2 + Fe2+ Fe3+ + HO- + Н) |
Н |
Сильный окислитель, разрывает любую СН-связь, повреждение нуклеиновых кислот и белков, индуцирует процессы ПОЛ, обладает сильным цитотоксическим, мутагенным и канцерогенным действием |
R 2 |
Взаимодействует с ненасыщенными липидами с образованием и ROOH, реакция рекомбинации сопровождаются биохемилюминесценцией |
R |
Индуцирует ПОЛ, обладает цитотоксическим и канцерогенным действием |
АК - активные формы кислорода; ПОЛ - перекисное окисление липидов, СОД - супероксиддисмутаза |
|
радикалов и перекисей, образующихся в результате реакций озона в клетке. Цитотоксичность активных форм кислорода обусловлена либо индукцией перекисного окисления липидов, либо образованием сильного окислителя гидроксилрадикала. Оба механизма характерны для озоновых повреждений мембран, канцерогенеза и мутагенеза. Но в небольших концентрациях супероксид анионрадикал проявляет и регуляторное действие на многие клеточные процессы. Следует отметить, что функции активных форм кислорода многообразны, и не только определяют негативное действие озона. У животных и растений они участвуют в
защите от инфекционных заболеваний и фитопатогенных микроорганизмов.
Свободные радикалы. Свободные радикалы кислорода способны вызвать окислительную модификацию белков, нуклеиновых кислот, гликозаминов, липидов и пигментов. Акцепторами, способными перехватывать электроны при взаимодействии с активными формами кислорода, могут быть дисульфидные, сульфгидрильные, карбонильные, карбоксильные и аминные группы аминокислот и аминокислотных остатков в белках. Реакции протекают с большой скоростью - констаты К10-9-10-10 М-1сек-1. Действие любой активной формы кислорода на белки приводит к изменению структуры белковой молекулы, ее физико-химических и биологических свойств.
Супероксид анионрадикал и гидроксил радикал атакуют нуклеиновые кислоты, особенно ДНК. Это предполагает, что под действием озона идет разрушение хромосом. К главным агентам инактивации нуклеиновых кислот относятся также пероксиды, гидропероксиды, малоновый диальдегид, полициклические углеводороды - эпоксиды.
Важнейший эффект радикалов - инициирование цепного окисления липидов. Этот процесс представляет собой реакции, в результате которых ненасыщенные липиды окисляются до короткоцепочечных углеводородных фрагментов. К числу инициаторов перекисного окисления липидов относятся активные формы кислорода ; Н 2; Н , а также перекись водорода, гидроперекиси типа RООН, органические перекиси и эпоксиды. Многие продукты перекисного окисления липидов весьма токсичны (Табл.2).
Супероксил анионрадикал. В последние годы накапливаются свидетельства в пользу сигнальной роли свободных радикалов, например, супероксид анионрадикала, который вызывает гиперполяризацию плазматической мембраны. In vitro он ингибирует активность каталазы, ацетилхолинэстеразы, глутатионпероксидазы и других ферментов. Изменение активности объясняется, в основном локальными нарушениями в области активного центра - окислением аминокислотных остатков гистидина и других аминокислот, изменением валентности входящих в состав ферментов металлов и других нарушений. Супероксидион радикал также может атаковать нуклеиновые кислоты, особенно ДНК. Это предполагает, что под действием озона идет разрушение хромосом.
Гидроксилрадикал. Гидроксилрадикал H наиболее активен в разрушении нуклеиновых кислот по сравнению с другими свободными радикалами. Он взаимодействует с пиримидиновыми и пуриновыми фрагментами, а также с дезоксирибозой. Взаимодействие гидроксилрадикала с пиримидиновыми основаниями приводит к нарушению двойной связи С5-С6 в кольце. При этом радикал отнимает водород из связи С-Н или сам включается в двойные связи, а также происходит отщепление протона от метильных групп. Сходные реакции H радикала происходят с пуриновыми основаниями. H радикал также взаимодействует с дезоксирибозой по С-Н связи, образуя 5 типов радикалов, которые в реакции с кислородом продуцируют разнообразные пероксирадикалы. Дальнейшая атака пероксирадикалов ведет к разрывам в молекуле ДНК.
Помимо
выше указанных механизмов действия
гидроксил радикала в клетке, Н
-
главный инициатор перекисного окисления
липидов. Взаимодействуя с молекулой
ненасыщенной жирной кислоты (LН), он
образует радикал ненасыщенной кислоты
(![]() )
)
![]()
Радикал при взаимодействии с кислородом дает многие разветвленные цепные реакции с образованием новых радикалов, тоже весьма токсичных для клетки.
Пероксиды. Озон обладает токсичным действием также благодаря образованию перекиси водорода и органических пероксидов, которые могут окислять нуклеиновые кислоты, липиды и белки. Но при небольших дозах О3 образование низких концентраций пероксидов при реакциях с озоном может иметь положительное значение. Сигнальная роль малых доз этих соединений связана с непрямым эффектом, опосредованным рецепцией на поверхности клетки или органелл внутри клетки. При низких (10-9 - 10-5 М) концентрациях перекиси водорода часто наблюдаются стимулирующие эффекты. В небольших дозах она может быть сигнальным веществом, мессенджером в активации транскрипции, вторичным внутриклеточным мессенджером,а также триггером в свободнорадикальных реакциях. Перекись водорода в микромолярных концентрациях активируют калиевые каналы и изменяют мембранный потенциал и внутреннее содержание кальция, подобно другим активным формам кислорода. Она стимулирует развитие пыльцы и семян. Известно, что ингибирование каталазы, разрушающей перекись водорода, вызывает прерывание покоя у семян.
Активация клеток низкими концентрациями перекисей рассматривается как сигнальная реакция, связанная с окислительно-восстановительными свойствами этих веществ. Предполагается, что в этом случае молекула перекиси соединяется с сенсором (рецептором) как на поверхности клетки (если перекись секретируется из одной клетки и воспринимается другой клеткой), так и на поверхностях внутриклеточных органелл (если перекись образуется внутри клетки и здесь же вступает во взаимодействие с ее компартментами). Как связываются перекиси с таким сенсором - точно неизвестно, возможно идет окисление его сульфгидрильных групп. Передача полученной от сигнальных молекул пероксидов информации сенсором внутрь клетки, по всей видимости, идет за счет вторичных посредников, прежде всего ионов кальция. Однако допускается и нерецепторный механизм сигнального эффекта перекисей, например, внутриклеточное проведение сигнала через активацию редокс-молекул цитоплазмы и органелл. Перекись водорода, в данном случае, рассматривается как вторичный мессенджер.
Механизм действия высоких концентраций перекисей связывают с редокс-характеристиками этих соединений. Возможно, прежде всего, они вступают в окислительно-восстановительные реакции. Например пероксиды сильно влияют на автофлуоресценцию клеток, что особенно заметно у пигментированной пыльцы. Пигменты (антоцианы, азулены, каротиноиды) резко меняют свои спектры эмиссии при окислении озоном или пероксидами.
Другими мишенями действия высоких концентраций перекисей могут быть белки и нуклеиновые кислоты. Считается, что эффект миллимолярных концентраций органических перекисей связан прежде всего с инактивацией ферментов, таких как пероксидазы, поскольку разрушается гемовое кольцо фермента, или повреждаются ферменты с сульфгидрильными группами SH.