
- •Ответы на экзаменационные вопросы 2014 года.
- •Глава 3. Основы химической термодинамики и биоэнергетики (1-4)
- •Глава 4. Основы кинетики биохимических реакций и химического равновесия. (5-8)
- •Глава 5. Растворы и их коллигативные свойства. (9-11)
- •Глава 6. Растворы электролитов и ионные равновесия. (12-13)
- •Глава 7. Теория кислот и оснований Бренстеда. Протолитические равновесия. (14-15)
- •Глава 8. Окислительно – восстановительные реакции. (16-18)
- •Глава 9. Комплексные соединения и их свойства (19-20)
- •Глава 10. Химия Биогенных элементов. (21-26)
- •Глава 11. Химия ионов – металлов жизни. (27-28)
- •Глава 12. Межфазные электрические потенциалы. Гальванические цепи. (29 –32)
- •Глава 13. Физико - химические основы поверхностных явлений. (33-38)
- •Глава 14. Физико – химия дисперсных систем. (39-44)
Глава 11. Химия ионов – металлов жизни. (27-28)
Понятие о металлах жизни. Натрий и калий. Строение атомов и особенности гидратации катионов, определяющие их содержание во внеклеточной и внутриклеточной среде.
Металлы жизни– десять элементов:K,Na,Ca,Mg,Mn,Fe,Co,Cu,Zn,Mo. На их долю в организме приходится 2,4 %. Все металлы жизни в организме или находятся в виде свободных катионов, или являются ионами – комплексообразователями, связанными с биолигандами. Принимают активное участие в обмене веществ.
Натрий и калий – элементы группыIA. Атомы элементов этой группы имеют во внешнем слое один электрон наs- подуровне, который они стремятся отдать в соединениях партнеру, образуя устойчивые симметричные монокатионы с электронной конфигурацией ближайшего благородного газа.
Благодаря устойчивости электронной структуры и низкой плотности положительного заряда на поверхности катионов Na+ иK+ их свободные атомные обитали внешнего уровня не могут эффективно взаимодействовать с неподеленными парами электронов ближайших молекул воды, из-за чего они удерживаются в гидратной оболочке катиона только электростатически. Поэтому катионы натрия и калия не подвергаются гидролизу в водной среде и практически не проявляют склонность к комплексообразованию.
Основное различие в свойствах катионов натрия и калия связано с различием в плотности положительного заряда на их поверхности: у катиона Na+она выше, поэтому его электростатическое поле сильнее удерживает молекулы воды. Вследствие этого для катиона натрия характерна положительная гидратации, а для катиона калия – отрицательная гидратация. Именно этим, по мнению Слесарева Валерий Ивановича, можно объяснить, почему катионыNa+иK+в живых системах являются антагонистами и почему катионы калия являются преимущественно компонентом внутриклеточных, а катионы натрия – межклеточных жидкостей.
Концентрация ионов K+внутри клетки примерно в 35 раз выше. Чем вне ее, а концентрация ионовNa+во внеклеточной жидкости в 15 раз больше, чем внутри клетки. Для осуществления многих важных биологических процессов необходимо постоянно поддерживать такое неравномерное распределение этих ионов, на что требуется затрата энергии, так как перенос ионов через мембрану должен происходить против градиента их концентраций. Это реализуется с помощью калий – натриевого насоса, который за счёт энергии гидролиза одной молекулы АТФ выводит три катионаNa+из клетки, а два катионаK+посылает внутрь клетки. Вследствие дисбаланса переносимых электрических зарядов внутренняя поверхность мембрану заряжается отрицательно, а внешняя положительно.
Высокая внутриклеточная концентрация ионов Kпрежде всего обеспечивает осмотическое давление внутри клетки, активацию ферментативных систем для синтеза белка на рибосомах и окисление углеводов. В эритроцитах ионыKучаствуют в работе гемоглобиновой и оксигемоглобиновой буферных систем, а так активируют фермент карбоангидразу оксида углерода.
Ионы K+иNa+активируютаденозинтрифосфатазу (АТФ – аза) клеточных мембран, обеспечивающую энергией калий- натриевый насос. Эти ионы оказывают существенное влияние на деятельность центральной нервной системы (ЦНС). Избыток ионовNa+в клетках коры головного мозга вызывают депрессию, т.е. угнетение деятельности ЦНС. Избыток катионовKв этих клетках, наоборот, возбуждает ЦНС, вызывая маниакальное состояние.
Учебник: 338–341.
Магний и кальция, строение атомов и особенности гидратации их ионов. Формы существования, местонахождение и роль катионов магния и кальция в организме. Реакция образования и разрушения костной ткани и ее функции.
В организме взрослого человека содержится катионов магния около 20 г, а кальция – 1000г. Половина катионов магния и почти 99 % кальция находится в костной ткани, остальное – в мягких тканях. Суточная потребность в катионах магния составляет около 0,3 г, кальция – 1 г, причем у женщин в период беременности потребность в катионах кальция возрастает в 3-4 раза.
Магний и кальция – элементы IIAгруппы периодической системы. Атомы элементов этой группы имеют во внешнем слое два электрона наs– подуровне (12Mg: 3s2;20Ca: 4s2), которые стремятся отдать в соединениях партнеру.
Различие с свойствах катионов магния и кальция в водной среде связано с различием в плотности положительного заряда на их поверхности. Поскольку катион Mg2+имеет меньший радиус, чемCa2+(66 и 99 соответственно), то он гидратируется лучше, а кроме того, его свободные атомные орбитали внешнего уровня, включая 3d– орибтали, способны взаимодействовать с неподеленными парами электронов молекул воды, образуя достаточно устойчивые аквакомполексы [Mg(H2O)6]2+.
Катион магния способен образовывать ковалентные связи по сравнению с катионом кальция. В связи с этим катионы магния, в отличие от катионов кальция, способны к гидролизу:
Mg2+ +H2O⇌ Mg(OH)+ + H+
Основная масса катионов магния, находящегося вне костей, сосредоточена внутри клеток. Ионы магния играют важную роль в поддержании осмотического давления внутри клеток. Основная масс магния в крови содержится в ионизованной форме, т.е. в виде акваиона (55-60 %), приблизительно 30 % связано с белками, а 10-15 % входит в состав комплексных соединений с фосфолипидами и нуклеотидами.
Катионы магния за счет комплексообразования являются одним из основных активаторов ферментативных процессов. Так, они активируют ферменты окислительного фосфолилирования, репликации ДНК и минерализации костной ткани.
В отличие от ионов магния, катионы кальция преимущественно сосредоточены в межклеточных жидкостях. Обмен кальция контролируется гормонами паращитовидных и щитовидной желез, а также витаминов D.
Основным минеральным компонентом костной ткани является гидрофосфат кальция
Ca5(PO4)3OH (гидроксиапатит). костная ткань обеспечивает поддержание концентрации ионов Ca2+ в биологических жидкостях на определенном уровне, поэтому ее можно рассматривать как кальциевый буфер организма.
Компактная костная ткань (компактное вещество) — один из двух типов костной ткани, формирующих кость. Обеспечивает поддерживающую, защитную функции кости, служит хранилищем химических элементов.
Компактное вещество формирует корковый слой большинства костей. Оно значительно плотнее, тяжелее и прочнее губчатого вещества. Компактная костная ткань составляет около 80 % общего веса человеческого скелета. Первичной структурно-функциональной единицей компактного вещества является остеон.
Учебник: 341 – 344.
Железо и кобальт, строение атомов и характерные степени окисления. Кислотно – основные, окислительно – восстановительные и комплексообразующие свойства соединений этих металлов. Роль соединений этих металлов живом организме.
В организме человека содержатся около 5г железа и 1,2 мг кобальта. Большая часть железа (70 %) сосредоточена в гемоглобине крови; 14 % кобальта находится в костях, 43 % - в мышцах и остальная часть – в мягких тканях. Ежедневное потребление железа – 10-20 мг, а кобальта – 0,3 мг.
Железо и кобальт – элементы 4 периодаVIIIБ группы периодической системы с электронными конфигурациями26Fe: 1s22s22p63s23p64s2;27Co: 1s22s22p63s23p63d74s2
Наиболее характерные степени окисления для железа и кобальта +2 и +3.
В водных растворах катионы Fe2+,Fe3+,Co2+иCo3+гидратируются с образование шестикоориданционных аквакомплексов.
Fe2+ - сильный восстановитель, способный окисляться даже кислородов воздуха.
Co3+- настолько сильный окислитель, что окисляет даже воду:
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
2Co2(SO4)3 + 2H2O = 4CoSO4 + 2H2SO4 + O2
Оксиды и гидроксиды железа и кобальта
независимо от степени окисления проявляют
слабые амфотерные свойства с преобладанием
основных свойств, особенно в случае
двухвалентного состояния, когда
взаимодействие протекает только с
концентрированными растворами щелочей
и при нагревании.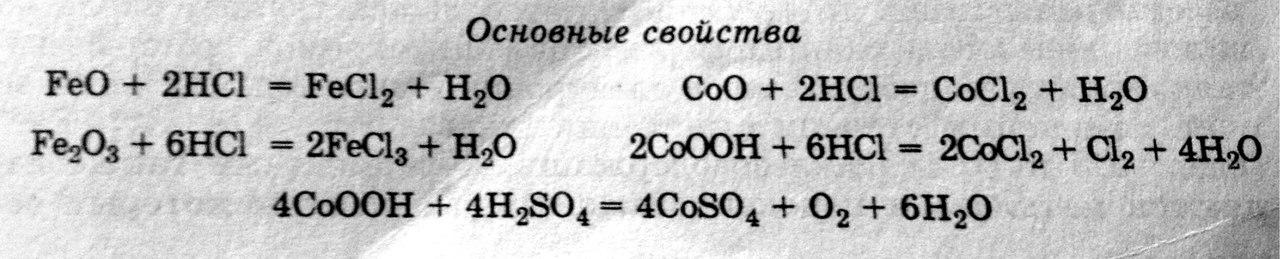
Катионы железа и кобальта очень склонны
к комплексообразованию. Для них наиболее
вероятно координационное числошесть: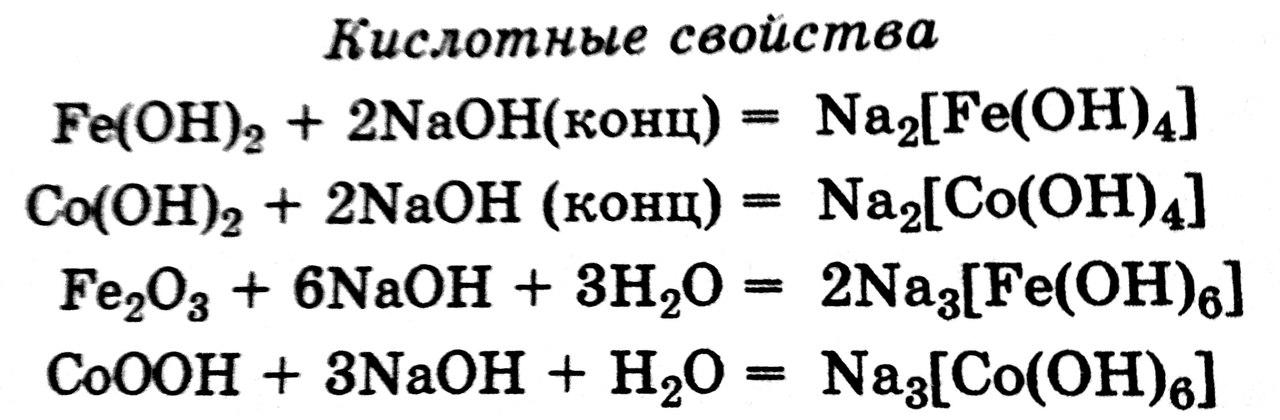
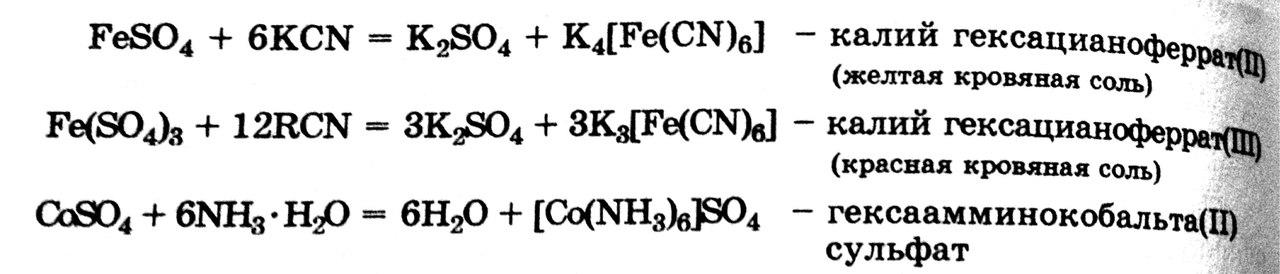
Комплексообразованиюкатионов железа и кобальта сильно, но по-разному влияет на их окислительно – восстановительные свойства в зависимости от соотношения устойчивости комплексов окисленной и восстановленной форм с одними и теми же лигандами.
КомплексообразованиеCo3+с лигандами более активными, чем молекулы воды, делает его устойчивым в водных растворах.
Кобальт, один из микроэлементов, жизненно важных организму. Он входит в состав витамина В12 (кобаламин). Кобальт задействован при кроветворении, функциях нервной системы и печени, ферментативных реакциях. В теле человека содержится 0,2 мг кобальта на каждый килограмм массы человека. При отсутствии кобальта развивается акобальтоз.
В живых организмах железо является важным микроэлементом, катализирующим процессы обмена кислородом (дыхания). Обычно железо входит в ферменты в виде комплекса, называемого гемом. В частности, этот комплекс присутствует в гемоглобине — важнейшем белке, обеспечивающем транспорт кислорода с кровью ко всем органам человека и животных. И именно он окрашивает кровь в характерный красный цвет.
Существует большая группа, около 50 видов, железосодержащих ферментов – цитохромов, которые катализируют процесс переноса электронов в дыхательной цепи за счет изменения степени окисления железа Fe3+ + e- Fe2+
Учебник: 349 – 352.
