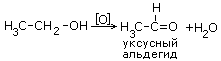Поликонденсация фенола с формальдегидом при кислотном катализе (новолаки)
Кислотному катализу подвержены все основные реакции, идущие при поликонденсации фенола с формальдегидом. Это – гидроксиметилирование и конденсация, протекающая с участием метилольных производных.
Сущность кислотного катализа гидроксиметилирования – повышение электрофильности формальдегида за счет его протонирования:
![]()

(2)
В кислой среде о - и п-метилольные производные нестабильны и образуют сравнительно устойчивые и долгоживущие ионы карбония, которые, в свою очередь, реагируют как электрофильные агенты с фенолом или с метилольными производными.
Возможная схема реакции о-метилольных производных показана ниже:
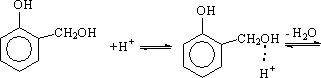

Аналогичным образом может быть представлено образование о-, п-дигидроксибензилового эфира и о-, п-дигидроксидифенилметана. Образовавшиеся по реакциям (2) и (3) двухатомные фенолы вступают в аналогичные превращения, в результате которых получаются олигомерные продукты.
Кислотный катализ эффективен в области рН 1-4. В более кислых средах проводить процесс нецелесообразно, поскольку в этих условиях снижается активность фенольного компонента в результате его протонирования по гидроксильной группе.
Все рассмотренные реакции протекают легко при довольно низких температурах и сопровождаются значительным выделением тепла (88 кДж/моль фенола, вступившего в реакцию).
При конденсации фенола с формальдегидом в кислой среде по достижении определенной степени конверсии (50-70% по формальдегиду) происходит расслоение реакционной массы. И далее процесс протекает в гетерогенной системе. После расслоения системы мономеры и продукты реакции не распределяются между фазами. Концентрация фенола больше в органической фазе, а формальдегида – в водной.
Структура продуктов конденсации фенола с формальдегидом определяется соотношением исходных веществ. При избытке формальдегида (мольное соотношение СН2О/фенол > 1) нельзя получить плавкие растворимые продукты. Высокая функциональность фенола (f = 3) и нестабильность метилольных производных в кислой среде приводит к образованию полимера с неограниченно развитой пространственной структурой. Поэтому процесс синтеза фенолоформальдегидных олигомеров в кислой среде можно проводить лишь при недостатке формальдегида (т. е. при мольном соотношении СН2О/фенол < 1). В этом случае получают термопластичные фенолформальдегидные олигомеры, не содержащие в своей структуре метилольных групп. Их обычно называютноволачными. Структура новолачного олигомера представляется следующим образом:
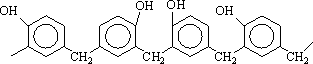
Изомерный состав новолачных олигомеров (соотношение о,о-, о,п - и п-,п-структурных фрагментов) определяется соотношением скоростей реакций, протекающих по орто - и пара-положениям фенольных ядер. Следует иметь в виду, что реакционная способность пара-положения несколько выше, чем орто-положения. Это различие особенно значительно в случае реакции конденсации с участием метилольных производных, но с повышением температуры и рН среды оно уменьшается.
Молекулярная
масса новолачных олигомеров определяется
соотношением мономеров в исходной
смеси, составляя 600-700 (среднечисловая
ММ). Отношение
![]() для
этих олигомеров 2,0-2,4, что близко к
наиболее вероятному распределению по
Флори.
для
этих олигомеров 2,0-2,4, что близко к
наиболее вероятному распределению по
Флори.
Отсутствие в структуре новолачного олигомера диметиленэфирных мостиков обусловлено низкой долей реакции из-за избытка фенола и склонностью дигидроксибензилового эфира к гидролизу и деструкции с выделением формальдегида в кислых средах.
26) Гомологические ряды альдегидов и кетонов. Строение карбонильной группы. Получение окислением и дегидрированием спиртов.
Альдегиды
и кетоны
Эти два класса органических веществ —
альдегиды и кетоны — характеризуются
присутствием в молекуле карбонильной
группы, или радикала карбонила, >С=О.
В альдегидах атом углерода этого радикала
связан не менее чем с одним атомом
водорода, так что получается одновалентный
радикал
![]() называемый также альдегидной группой.
В кетонах карбонильная группа связана
с двумя углеводородными радикалами и
называется также кетогруппой или
оксо-группой. Гомологический ряд
альдегидов и их номенклатура Простейший
альдегид, называемый муравьиным
альдегидом или формальдегидом, содержит
альдегидную группу, связанную с атомом
водорода, и имеет строение
называемый также альдегидной группой.
В кетонах карбонильная группа связана
с двумя углеводородными радикалами и
называется также кетогруппой или
оксо-группой. Гомологический ряд
альдегидов и их номенклатура Простейший
альдегид, называемый муравьиным
альдегидом или формальдегидом, содержит
альдегидную группу, связанную с атомом
водорода, и имеет строение
![]() или
сокращенно Н—СНО. В остальных альдегидах
предельного ряда место одного атома
водорода занимает алкил: СnС2n+1—СНО.
Альдегиды можно также рассматривать
как вещества, происшедшие от замещения
в парафиновых углеводородах атома
водорода на альдегидную группу, т. е.
как однозамещенные производные
углеводородов гомологического ряда
метана. Следовательно, здесь гомология
и изомерия те же, что и для других
однозамещенных производных предельных
углеводородов. Названия альдегидов
производятся от тривиальных названий
кислот с тем же числом атомов углерода
в молекуле. Так, альдегид СН3—СНО
называется уксусным альдегидом или
ацетальдегидом, СН3СН2—СНО — пропионовым
альдегидом, СН3СН2СН2—СНО — нормальным
масляным альдегидом или бутиральдегидом,
(СН3)2СН—СНО — изомасляным альдегидом,
альдегиды С4Н9—СНО — валериановыми
альдегидами и т. д. По женевской
номенклатуре, названия альдегидов
производятся от названий углеводородов,
имеющих то же число углеродных атомов,
с присоединением к окончанию ан слога
аль, например метаналь Н—СНО, этаналь
СН3—СНО, 2-метилпропаналь СН3СН(СН3)—СНО
и т. д. Гомологический
ряд кетонов и их номенклатура
Простейший из кетонов имеет строение
СН3—СО—СН3 и называется диметилкетоном
или ацетоном. От ацетона можно произвести
гомологический ряд последовательным
замещением атомов водорода на метил.
Таким образом, следующий гомолог ацетона
— метилэтилкетон имеет строение
СН3—СО—СН2—СН3. Третий гомолог может
существовать в трех изомерных формах:
или
сокращенно Н—СНО. В остальных альдегидах
предельного ряда место одного атома
водорода занимает алкил: СnС2n+1—СНО.
Альдегиды можно также рассматривать
как вещества, происшедшие от замещения
в парафиновых углеводородах атома
водорода на альдегидную группу, т. е.
как однозамещенные производные
углеводородов гомологического ряда
метана. Следовательно, здесь гомология
и изомерия те же, что и для других
однозамещенных производных предельных
углеводородов. Названия альдегидов
производятся от тривиальных названий
кислот с тем же числом атомов углерода
в молекуле. Так, альдегид СН3—СНО
называется уксусным альдегидом или
ацетальдегидом, СН3СН2—СНО — пропионовым
альдегидом, СН3СН2СН2—СНО — нормальным
масляным альдегидом или бутиральдегидом,
(СН3)2СН—СНО — изомасляным альдегидом,
альдегиды С4Н9—СНО — валериановыми
альдегидами и т. д. По женевской
номенклатуре, названия альдегидов
производятся от названий углеводородов,
имеющих то же число углеродных атомов,
с присоединением к окончанию ан слога
аль, например метаналь Н—СНО, этаналь
СН3—СНО, 2-метилпропаналь СН3СН(СН3)—СНО
и т. д. Гомологический
ряд кетонов и их номенклатура
Простейший из кетонов имеет строение
СН3—СО—СН3 и называется диметилкетоном
или ацетоном. От ацетона можно произвести
гомологический ряд последовательным
замещением атомов водорода на метил.
Таким образом, следующий гомолог ацетона
— метилэтилкетон имеет строение
СН3—СО—СН2—СН3. Третий гомолог может
существовать в трех изомерных формах:
![]() Названия
кетонов, так же как и названия альдегидов,
по женевской номенклатуре, производятся
от названий углеводородов с тем же
числом атомов углерода, с присоединением
к окончанию ан слога он и прибавлением
цифры, обозначающей место атома углерода
карбонильной группы, считая от начала
нормальной углеродной цепи; ацетон,
таким образом, носит название пропанон,
диэтилкетон — пентанон-3, метилизопропилкетон
— 2-метилбутанон и т. д Альдегиды и кетоны
с одинаковым числом атомов углерода в
молекуле изомерны друг другу. Общая
формула для гомологических рядов
предельных альдегидов и кетонов: СnН2nО.
Альдегиды и кетоны содержат в молекуле
одну и ту же карбонильную группу,
обусловливающую много общих типических
свойств. Поэтому имеется очень много
общего и в способах получения и в
химических реакциях обоих этих родственных
классов веществ. Присутствие в альдегидах
атома водорода, связанного с карбонильной
группой, обусловливает ряд отличий
этого класса веществ от кетонов.
Названия
кетонов, так же как и названия альдегидов,
по женевской номенклатуре, производятся
от названий углеводородов с тем же
числом атомов углерода, с присоединением
к окончанию ан слога он и прибавлением
цифры, обозначающей место атома углерода
карбонильной группы, считая от начала
нормальной углеродной цепи; ацетон,
таким образом, носит название пропанон,
диэтилкетон — пентанон-3, метилизопропилкетон
— 2-метилбутанон и т. д Альдегиды и кетоны
с одинаковым числом атомов углерода в
молекуле изомерны друг другу. Общая
формула для гомологических рядов
предельных альдегидов и кетонов: СnН2nО.
Альдегиды и кетоны содержат в молекуле
одну и ту же карбонильную группу,
обусловливающую много общих типических
свойств. Поэтому имеется очень много
общего и в способах получения и в
химических реакциях обоих этих родственных
классов веществ. Присутствие в альдегидах
атома водорода, связанного с карбонильной
группой, обусловливает ряд отличий
этого класса веществ от кетонов.
Строение карбонильной группы C=O.
Свойства альдегидов и кетонов определяются строением карбонильной группы >C=O.
|
Атомы углерода и кислорода в карбонильной группе находятся в состоянии sp2-гибридизации. Углерод своими sp2-гибридными орбиталями образует 3 s-связи (одна из них - связь С–О), которые располагаются в одной плоскости под углом около 120° друг к другу. Одна из трех sp2-орбиталей кислорода участвует в s-связи С–О, две другие содержат неподеленнные электронные пары. p-Связь образована р-электронами атомов углерода и кислорода. |
Связь С=О сильно полярна. Ее дипольный момент (2,6-2,8D) значительно выше, чем у связи С–О в спиртах (0,70D). Электроны кратной связи С=О, в особенности более подвижные p-электроны, смещены к электроотрицательному атому кислорода, что приводит к появлению на нем частичного отрицательного заряда. Карбонильный углерод приобретает частичный положительный заряд. Поэтому углерод подвергается атаке нуклеофильными реагентами, а кислород - электрофильными, в том числе Н+. В молекулах альдегидов и кетонов отсутствуют атомы водорода, способные к образованию водородных связей. Поэтому их температуры кипения ниже, чем у соответствующих спиртов. Метаналь (формальдегид) - газ, альдегиды С2–C5 и кетоны С3–С4 - жидкости, высшие - твердые вещества. Низшие гомологи растворимы в воде, благодаря образованию водородных связей между атомами водорода молекул воды и карбонильными атомами кислорода. С увеличением углеводородного радикала растворимость в воде падает.
|
Модели простейших карбонильных соединений | ||
|
Название |
Формула |
|
|
Формальдегид (метаналь) |
H2C=O |
|
|
Ацетальдегид (этаналь) |
СH3-CH=O |
|
|
Ацетон (пропанон) |
(СH3)2C=O |
|
Формальдегид. Первым членом гомологического ряда предельных альдегидов является формальдегид НСОН. Его называю также метаналь и муравьиный альдегид. Он представляет собой бесцветный газ с характерным резким запахом. Хорошо растворяется в воде, образу гидрат СН2О . Н2О. Водный раствор с массовой долей формальдегида 30-40% называется формалином. Формалин является хорошим дезинфицирующим и консервирующим средством. Ацетальдегид. Ацетальдегид (этаналь, уксусный альдегид) СН3 - СОН представляет собой бесцветную жидкость с резким запахом. Хорошо растворяется в воде. В больших количествах вырабатывается химической промышленностью. Основное количество вырабатываемого ацетальдегида окисляют до уксусной кислоты. Ацетальдегид используется и для получения других органических продуктов, в том числе полимеров. Ацетон. Ацетон (пропанон, диметилкетон) представляет собой бесцветную жидкость с характерным запахом. Температура кипения ацетона 56,2 С. Хорошо растворим в воде, и сам является растворителем органических соединений. Ацетон - важный продукт химической промышленности. Его получают совместно с фенолом кумольным методом. Ацетон применяется как растворитель. Он также является исходным веществом для синтеза многих органических соединений. .
|
Получение альдегидов. |
|
1.Дегидрирование спиртов |
|
|
|
2.Окисление спиртов |
|
Кетоны получают окислением вторичных спиртов |
. ПОЛУЧЕНИЕ.
Окисление первичных и вторичных спиртов – классический способ получения соответственно альдегидов и кетонов. Число предложенных в литературе окислителей огромно. Выбраны лишь некоторые:
Бихромат натрия или оксид хрома (IV) в водной серной кислоте ( реактив Джонса). Система бихромат – серная кислота может применяться и в органических средах (ДМСО). Окисление хромовой кислотой, как правило, нежелательно для спиртов, содержащих неустойчивые к действию кислот или легкоокисляющиеся фрагменты (например, С=С, аллильные или бензильные С–Н-связи), а в случае первичных спиртов зачастую вызывает переокисление до карбоновых кислот.
Пиридиния хлорохромат (ПХХ) в дихлорметане (реактив Кори). Благодаря простоте получения и применения ПХХ является важной альтернативой широко используемому комплексу оксида хрома (VI) с пиридином (реактив Коллинза), поскольку в первом случае достигаются лучшие выходы, а неустойчивые к действию кислот спирты можно "гладко" окислить системами ПХХ-ацетат натрия или ПХХ-оксид алюминия.
Пиридиния бихромат (ПБХ) применяется как селективный окислитель для первичных, вторичных, а также аллильных и бензилыных ОН-групп. Последние окисляются также активированные диоксидом марганца.
Еще одним простым и эффективным методом получения альдегидов и кетонов из первичных и соответственно вторичных спиртов является окисление по Кори-Киму (комплекс хлорсукцинимид – диметилсульфид). Кроме того, вторичные спирты окисляются по реакции Оппенауэра алкоксидами алюминия и ацетоном в качестве акцептора гидрид-иона.
Наиболее мягким, а зачастую и самым лучшим методом, особенно синтеза альдегидов, является окисление по Сверну (ДМСО-оксалилхлорид). Правда, этот метод можно применять лишь для небольших загрузок (<0,3 моль). Окисление тетрапропиламмонийперрутенатом и N-метилморфолин-N-оксидом также достаточно мягкие методы.
Первичные алкил- и аллилгалогениды, а также тозилаты первичных спиртов превращаются в альдегиды под действием ДМСО, т. е. окислением по Корнблюму. Первичные спирты могут также окисляться диметилсульфоксидом в присутствии дициклогексилкарбодиимида, что особенно распространено в химии углеводов.
Для восстановления карбоновых кислот и производных карбоновых кислот до альдегидов применяют ряд методов:
а) Хлорангидриды кислот можно наряду с восстановлением по Розенмунду (Pd-BaSO4, улучшенный вариант) легко и препаративно просто превратить в альдегиды посредством Li[Hal(OEt)3].
б) Точно так же используют амиды карбоновых кислот, которые восстанавливаются в виде N,N-диметиламидов посредством Li[Hal(OEt)3] или в виде N-метиланилидов посредством LiAlH4.
в) Прямое восстановление карбоновых кислот, ангидридов карбоновыхх кислот и нитрилов до альдегидов осуществляется с помощью изобутилалюминийгидрида (ДБАГ).
Для получения ароматических альдегидов наряду с окислением метиларенов (по реакции Эгара или аммонийцерий (IV) нитратом) и бензиловых спиртов применяют прямое формилирование (активированных) ароматических соединений диметилформамидом или М-метилформанилидом и оксихлоридом фосфора по Вильсмейеру. Старые методы (синтез альдегидов по Гаттерману или по Гаттерману-Коху), несмотря на усовершенствования (например, синтез Гаттеррмана-Коха без синильной кислоты с применением симм-триазина, теряют свое значение. Система Cl2CH–O–R (R = Ме, Вu) в сочетании с SnCl4 позволяет проводить формилирование таких неустойчивых ароматических соединений, как аннулены. Реакция Вильсмейера может служить методом введения альдегидной группы в гетероароматические соединения.
Кетоны с ароматическими и гетероциклическими заместителями получают ацилированием ароматических и гетероциклических соединений хлорангидридами и ангидридами кислот в присутствии кислот Льюиса. Среди других многочисленных синтетических методов определенное значение имеет реакция Хеша (индуцируемое кислотами присоединение нитрилов к активированным ароматическим и гетероароматическим соединениям). Кроме того, широко используется внутримолекулярное ацилирование по Фриделю-Крафтсу арилалкановых кислот с образованием бензоцикланонов.
Для синтеза альдегидов по Мейеру используют 2-оксазолины (2-оксазины). После N-кватернизации по положению 2 присоединяется реактив Гриньяра и полученное ацетальаминалыюе производное затем гидролизуется до альдегида. Таким образом можно осуществить превращение R–X –> R–CH=O.
Привлечение металлоорганических соединений открывает путь к многосторонним препаративным методам получения кетонов и альдегидов. Принцип ацилирующего расщепления связей С–М (М -металл) хлорангидридами кислот имеет разнообразное применение, как, например, в случае кадмийорганических соединений, оловоорганических соединений SnR4, при катализе палладием и силанами (CH3)3Si–R. Реактивы Гриньяра при особых условиях можно проацилировать с образованием кетонов не только хлорангидридами кислот, но и легкодоступными ацилимидазолидами по Штаабу. Достаточно широкое применение в синтезе кетонов находит реакция присоединения реактивов Гриньяра к нитрилам, прежде всего ароматическим.
Для синтеза альдегидов и кетонов можно использовать и реакции окислительного расщепления. К ним относятся озонолиз, проводимы в особых условиях, а также расщепление гликолей под действием Pb(ОАс)4 в апротонной среде или под действием NaIO4 в водной среде.
Синтетическое значение для получения альдегидов и кетонов имее оксиперегруппировка по Коупу.
Для синтеза высокоактивных диальдегидов (например, малонового и янтарного диальдегидов) и их ацеталей применяют специальные методы.
27) Строение карбонильной группы. Отличие связей С=О от связи С=С. Реакции нуклеофильного присоединения по карбонильной группе спиртов, синильной кислоты, реактивов Гриньяра.
Атомы углерода и кислорода в карбонильной группе находятся в состоянии sp2-гибридизации. Углерод своими sp2-гибридными орбиталями образует 3 s-связи (одна из них - связь С–О), которые располагаются в одной плоскости под углом около 120° друг к другу. Одна из трех sp2-орбиталей кислорода участвует в s-связи С–О, две другие содержат неподеленнные электронные пары. p-Связь образована р-электронами атомов углерода и кислорода.
Связь С=О сильно полярна. Ее дипольный момент (2,6-2,8D) значительно выше, чем у связи С–О в спиртах (0,70D). Электроны кратной связи С=О, в особенности более подвижные p-электроны, смещены к электроотрицательному атому кислорода, что приводит к появлению на нем частичного отрицательного заряда. Карбонильный углерод приобретает частичный положительный заряд. Поэтому углерод подвергается атаке нуклеофильными реагентами, а кислород - электрофильными, в том числе Н+. В молекулах альдегидов и кетонов отсутствуют атомы водорода, способные к образованию водородных связей. Поэтому их температуры кипения ниже, чем у соответствующих спиртов. Метаналь (формальдегид) - газ, альдегиды С2–C5 и кетоны С3–С4 - жидкости, высшие - твердые вещества. Низшие гомологи растворимы в воде, благодаря образованию водородных связей между атомами водорода молекул воды и карбонильными атомами кислорода. С увеличением углеводородного радикала растворимость в воде падает.
Модели простейших карбонильных соединений
Название
Формула
Формальдегид (метаналь)
H2C=O
Ацетальдегид (этаналь)
СH3-CH=O
Ацетон (пропанон)
(СH3)2C=O
Формальдегид. Первым членом гомологического ряда предельных альдегидов является формальдегид НСОН. Его называю также метаналь и муравьиный альдегид. Он представляет собой бесцветный газ с характерным резким запахом. Хорошо растворяется в воде, образу гидрат СН2О . Н2О. Водный раствор с массовой долей формальдегида 30-40% называется формалином. Формалин является хорошим дезинфицирующим и консервирующим средством. Ацетальдегид. Ацетальдегид (этаналь, уксусный альдегид) СН3 - СОН представляет собой бесцветную жидкость с резким запахом. Хорошо растворяется в воде. В больших количествах вырабатывается химической промышленностью. Основное количество вырабатываемого ацетальдегида окисляют до уксусной кислоты. Ацетальдегид используется и для получения других органических продуктов, в том числе полимеров. Ацетон. Ацетон (пропанон, диметилкетон) представляет собой бесцветную жидкость с характерным запахом. Температура кипения ацетона 56,2 С. Хорошо растворим в воде, и сам является растворителем органических соединений. Ацетон - важный продукт химической промышленности. Его получают совместно с фенолом кумольным методом. Ацетон применяется как растворитель. Он также является исходным веществом для синтеза многих органических соединений. .
Различия С=С и С=О
Двойная связь С=О, подобно связи С=С, представляет собой комбинацию - и -связей (они изоэлектронны). Однако, между этими двумя двойными связями имеются существенные различия:
- C=O значительно прочнее С=С;
- энергия связи С=О (179 ккал/моль) больше, чем энергия двух связей С-О (85.5 ккал/моль), в то время как энергия связи С=С (146 ккал/моль) меньше суммы энергий двух связей С-С (82.6 ккал/моль);
- связь С=О в отличие от С=С полярна.
При этом -связь поляризована сильнее, чем -связь. Итак, атом углерода карбонильной группы является электронодефицитным центром, а кислорода -электроноизбыточным.
Кроме тогo, карбонильная группа увеличивает кислотность атомов Н у соседнего атома С, приводя к увеличению кинетической кислотности (увеличению полярности связи С-Н из-за -I-эффекта карбонильной группы) и термодинамичес-кой кислотности (стабилизация образующегося карбаниона за счет мезомерного эффекта).
В молекулах карбонильных соединений имеется несколько реакционных центоров.
Электрофильный центр карбонильный атом углерода, возникновение частичного положительного заряда на котором обусловлено полярностью связи С=О. Электрофильный центр участвует в реакциях нуклеофильного присоединения.
Основный центр атом кислорода с неподеленными парами электронов. С участием основного центра осуществляется кислотный катализ в реакциях присоединения, а также в процессе енолизации. Важно отметить, что альдегиды и кетоны являются жесткими основаниями Льюиса и координируются с жесткими кислотами: H+, BF3, ZnCl2, FeCl3 и т. д.
-СН-Кислотный центр, возникновение которого обусловлено индуктивным эффектом карбонильной группы. При участии СН-кислотного центра протекают многие реакции карбонильных соединений, в частности реакции конденсации.
Связь СН в альдегидной групᴨȇ разрывается в реакциях окисления.
Ненасыщенные и ароматические углеводородные радикалы, подвергающиеся атаке электрофильными или нуклеофильными реагентами.
. Реакции нуклеофильного присоединения по карбонильной группе спиртов, синильной кислоты, реактивов Гриньяра.
Присоединение спиртов и тиолов.
Альдегиды присоединяют спирты с образованием полуацеталей. При избытке спирта и в присутствии кислотного катализатора реакция идет дальше – до образования ацеталей

Реакция образования полуацеталя протекает как нуклеофильное присоединение и ускоряется в присутствии кислот или оснований.
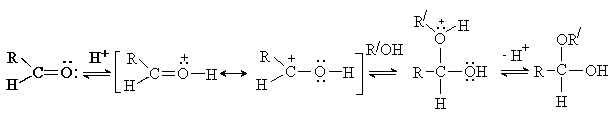
Процесс образования ацеталя идет как нуклеофильное замещение ОН группы в полуацетале и возможен только в условиях кислотного катализа, когда группа ОН превращается в хорошую уходящую группу (H2O).

Образование ацеталей – обратимый процесс. В кислой среде полуацетали и ацетали легко гидролизуются. В щелочной среде гидролиз не идет. Реакции образования и гидролиза ацеталей играют важную роль в химии углеводов.
Кетоны в аналогичных условиях кеталей не дают.
Тиолы как более сильные нуклеофилы, чем спирты, образуют продукты присоединения и с альдегидами, и с кетонами.

Присоединение синильной кислоты
Синильная кислота присоединяется к карбонильным соединением в условиях основного катализа с образованием циангидринов.
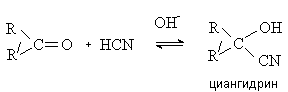
Реакция имеет препаративное значение и используется в синтезе a -гидрокси- и a -аминокислот (см. лек. № 14). Плоды некоторых растений (например, горький миндаль) содержат циангидрины. Выделяющаяся при их расщеплении синильная кислота оказывает отравляющее действие.
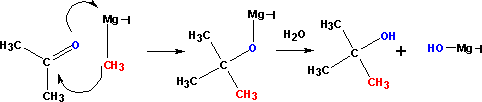
Присоединение реактивов Гриньяра
Особая ценность реактивов Гриньяра заключается в их способности создавать новые связи СС. Разница в электроотрицательности между углеродом и магнием (2,5 1,2 = 1,3), обусловливает полярность связи между этими атомами и наличие частичного отрицательного заряда на атоме углерода и частичного положительно-го заряда на атоме магния. В реакциях реактивы Гриньяра ведут себя как карбанионы. Карбанионы являются хорошими нуклеофилами и легко присоединяются к карбонильной групᴨȇ. Магнийорганические соединения вступают в реакции нуклеофильного присоединения к альдегидам и кетонам с образованием алкоксидов, гидролизующихся в спирты:
Присоединение к формальдегиду приводит к образованию ᴨȇрвичных спиртов.
Другие альдегиды дают вторичные спирты:
1-Циклогексилэтанол
Из кетонов получают третичные спирты:
2-Фенил-2-пропанол
присоединение реактивов Гриньяра
Взаимодействие металлорганических соединений типа R-Mg-X (реактивы Гриньяра), где Х= галоген, с карбонильными группами (нуклеофильное присоединение по кратной связи С=О):
Взаимодействие с формальдегидом, альдегидами, кетонами- приводит к первичным, вторичным и третичным спиртам, соответственно.
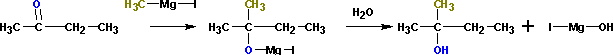 Из
кетонов получаются третичные спирты.
Так, из метилэтилкетона (бутанон-2)
получается 2-метилбутанол-2. Альдегиды
в подобной реакции дают вторичные
спирты. Из пропионовогоальдегида
(про
Из
кетонов получаются третичные спирты.
Так, из метилэтилкетона (бутанон-2)
получается 2-метилбутанол-2. Альдегиды
в подобной реакции дают вторичные
спирты. Из пропионовогоальдегида
(про паналь)
получается бутанол-2:
паналь)
получается бутанол-2:
Из формальдегида образуются первичные спирты. При взаимодействии реактивов Гриньяра с галогенангидридами карбоновых кислот и сложными эфирами образуются третичные спирты, у которых имеется два одинаковых алкильных заместителя. При этом расходуется два моля реактива Гриньяра:

29)Получение формальдегида, ацетальдегида, ацетона (из бензола и пропилена - кумольный метод).
Формальдегид
Формальдеги́д (от лат. formīca «муравей») — бесцветный газ с резким запахом, хорошо растворимый в воде, спиртах и полярных растворителях. Ирритант, токсичен.
Основной промышленный метод получения формальдегида — окисление метанола:
![]()
Окисление метанола в формальдегид проводится с использованием серебряного катализатора при температуре 650 °C и атмосферном давлении. Это хорошо освоенный технологический процесс, и 80 % формальдегида получается именно по этому методу. Недавно разработан более перспективный способ, основанный на использовании железо-молибденовых катализаторов. При этом реакция проводится при 300 °C. В обоих процессах степень превращения составляет 99 %[2].
Процесс дегидрирования метанола, осуществлённый на цинк-медных катализаторах при 600 °C, пока не получил широкого развития, однако он является очень перспективным, поскольку позволяет получать формальдегид, не содержащий воды.
Существует также промышленный способ получения формальдегида окислением метана:
![]()
Процесс проводят при температуре 450 °C и давлении 1—2 МПа, в качестве катализатора применяется фосфат алюминия AlPO4.
Ацетальдегид
Ацетальдеги́д (у́ксусный альдегид, этана́ль, метилформальдегид) — органическое соединение класса альдегидов схимической формулой CH3-CHO. Это один из наиболее важных альдегидов, широко встречающийся в природе и производящийся в больших количествах индустриально. Ацетальдегид встречается в кофе, в спелых фруктах, хлебе, и синтезируется растениями как результат их метаболизма. Также производится окислением этанола.
Основной способ получения — окисление этилена (процесс Вакера[1]):
![]()
В качестве окислителя В процессе Вакера используется хлорид палладия, регенерирующийся окислением хлоридом меди в присутствии кислорода воздуха:
![]()
![]()
![]()
Также получают уксусный альдегид гидратацией ацетилена в присутствии солей ртути (реакция Кучерова), с образованиеменола, который изомеризуется в альдегид:
![]()
Этот метод раньше доминировал до появления процесса Вакера[1] окислением или дегидрированием этилового спирта, на медном или серебряном катализаторе.
![]()
![]()
Ацетон
Ацето́н (диметилкето́н, 2-пропано́н)[1] — органическое вещество, имеющее формулу CH3—C(O)—CH3, простейший представитель насыщенных кетонов.
В промышленности получается напрямую или косвенно из пропена.
Кумольный способ
Основную часть ацетона получают как сопродукт при получении фенола из бензола по кумольному способу. Процесс протекает в 3 стадии:[6]
На первой стадии бензол алкилируется пропеном с получением кумола, на второй и третьей (реакция Удриса-Сергеева) полученный кумол окисляется кислородом воздуха до гидропероксида, который при действии серной кислоты разлагается на фенол и ацетон:
![]()
![]()
![]()
Из изопропанола
По данному методу изопропанол окисляют паровой фазе при температурах 450—650 °C на катализаторе (металлические медь, серебро, никель, платина). Ацетон с высоким выходом (до 90 %) получают на катализаторе «серебро на пемзе» или на серебряной сетке:
![]()
Метод окисления пропена
Ацетон получают также прямым окислением пропена в жидкой фазе в присутствии PdCl2 в среде растворов солей Pd, Cu, Fe при температуре 50-120 °C и давлении 50-100 атм:
![]()
![]()
Некоторое значение имеет метод брожения крахмала под действием бактерий Clostridium acetobutylicum с образованием ацетона и бутанола[7]. Метод характеризуется малыми выходами. Используются также методы получения из изопропилового спирта и ацетилена.
30)Химические свойства альдегидов и кетонов. Реакции с гидроксиламином, гидразином, фенилгидразином. Замещение карбонильного кислорода под действием РС15.
Химические свойства альдегидов и кетонов
Определяются особенностями карбонильной группы >C=O, обладающей полярностью – электронная плотность между атомами С и О распределена неравномерно, сдвинута к более электроотрицательному атому О. В результате карбонильная группа приобретает повышенную реакционную способность, что проявляется в разнообразных реакциях присоединения по двойной связи. Во всех случаях кетоны менее реакционноспособны, чем альдегиды, в частности, из-за пространственных затруднений, создаваемых двумя органическими группами R, наиболее легко участвует в реакциях формальдегид Н2С=О.
При действии на альдегиды и кетоны самого гидразина H2N—NH2 получаются или гидразоны, если с гидразином реагирует одна молекула альдегида или кетона или так называемые азины (альдазины и кетазины), если в реакцию вступают две молекулы: При действии производных гидразина образуются замешенные гидразоны, например при действии фенилгидразина получаются фенилгидразоны: Гидразоны альдегидов и кетонов под влиянием твердых едких щелочей или алкоголятов подвергаются каталитическому разложению с выделением азота и замещением кислорода карбонильной группы исходного альдегида или кетона на водород: Эта замечательная реакция, открытая Н. М. Кижнером в 1910 г. (иногда неправильно называемая реакцией Кижнера— Вольфа), оказывается чрезвычайно полезной при выяснении строения многих веществ. Она позволяет переходить от альдегидов и кетонов к соответствующим углеводородам: Реакция с гидроксиламином - NH 2 OH – образование оксимов.
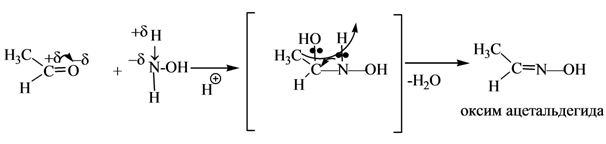
Реакция относится к качественным. Оксимы – кристаллические вещества, легко кристаллизуются.
Реакции с гидразином – NH 2 - NH 2, фенилгидразином - NH 2 - NH - C 6 H 5 и с 2,4-динитрофенилгидразином - NH 2 - NH - C 6 H 3 -2,4-(NO 2 )2 – образование гидразонов, фенилгидразонов и 2,4-динитрофенилгидразонов.
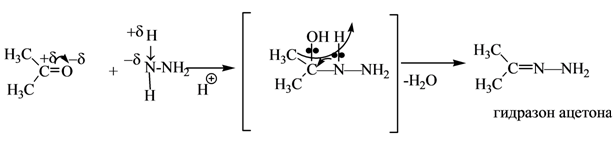
По аналогичной схеме образуются фенилгидразоны и 2,4-динитрофенилгидразоны:

2,4-Динитрофенилгидразоны особенно широко используются для идентификации альдегидов и кетонов. Они обладают высокими температурами плавления, легко кристаллизуются, имеют четкие спектральные данные.
Заменой карбонильного кислорода в альдегидах или кетонах на галоген (например, с помощью РС15, PBr5, SF4, MoF6) получают геминальные галогензамещенные.
31)Реакции альдегидов и кетонов, обусловленные активностью атомов водорода при α-углеродном атоме. Альдольная конденсация. Сравнение реакционной способности альдегидной и кетонной групп. Влияние электронных и стерических факторов.

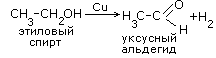 Кетоны
получают окислением вторичных
спиртов.
Кетоны
получают окислением вторичных
спиртов.