
- •-Лекция 9 галогенопроизводные углеводородов
- •1.1 Галогенопроизводные со связью с(sp3)-Наl
- •1.2. Способы получения
- •1.4. Химические свойства
- •1.4.1. Нуклеофильное замещение
- •1.4.2. Механизм sn1. Мономолекулярное замещение
- •1.4.3 Механизм sn2. Бимолекулярное замещение
- •1.4.4. Элиминирование
- •1.5. Восстановление
- •2. Галогенопроизводные со связью с(sp2)-Наl
- •2.4. Химические свойства
- •2.4.2. Нуклеофильное замещение по типу «присоединение-отщепление»
- •2.4.3. Нуклеофильное замещение по типу «отщепление-присоединение»
- •3. Металлоорганические соединения
1.4. Химические свойства
1.4.1. Нуклеофильное замещение
При нуклеофильном замещении нуклеофил атакует молекулу субстрата, предоставляя ей для образования новой связи свои электроны. Электроны разрывающейся связи уходят вместе с освобождающимся ионом. Такие ионные реакции идут преимущественно в жидкой фазе, поскольку растворитель стабилизирует образующиеся ионы за счет сольватации, что невозможно в газовой фазе.
Нуклеофильное замещение позволяет вводить в молекулу органического соединения большое количество функциональных групп, способных выступать в роли нуклеофилов. Например:
![]()
В роли нуклеофилов могут выступать и нейтральные молекулы, например:
![]()
Примеры реакций с участием бромистого этила, в качестве субстрата, приведены ниже:
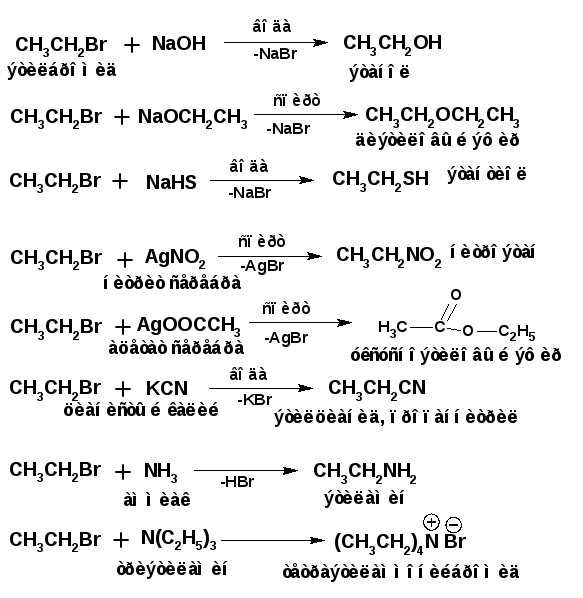
Особенностью реакций нуклеофильного замещения является то, что они одни из самых распространенных в органической химии, а соответственно одни из самых изученных. В частности изучение кинетики реакции нуклеофильного замещения. Химическая кинетика - это изучение изменения концентрации реагентов или продуктов во времени. Изменение характеризуется производной концентрации по времени dc/dt. Устанавливают взаимосвязь производной с концентрациями реагентов или, при необходимости, с концентрациями продуктов.
Изучение изменения концентрации реагентов во времени в условиях реакции нуклеофильного замещения показало, что возможны два случая:
В первом случае изменение концентрации пропорционально только концентрации субстрата dc/dt = К[галоидный алкил]
Во втором случае изменение концентрации пропорционально концентрации субстрата и концентрации нуклеофильной частицы - dc/dt = К[галоидный алкил]×[нуклеофил]
Механизм, соответствующий первому случаю назван мономолекулярным нуклеофильным замещением и обозначается SN1.
Механизм, соответствующий второму случаю назван бимолекулярным нуклеофильным замещением и обозначается SN2
1.4.2. Механизм sn1. Мономолекулярное замещение
По механизму SN1, например протекает гидролизтрет-бутилбромида:
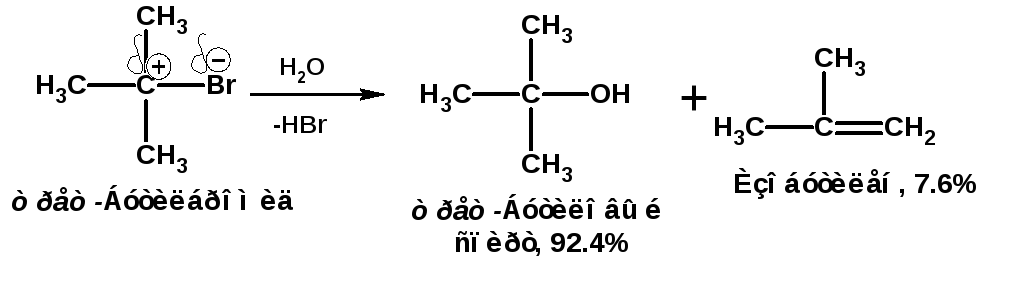
В механизме SN1 различают следующие стадии:
На первой стадии происходит ионизация галогенопроизводного с образованием карбкатиона и бромид-иона. Эта стадия является скоростьлимитирующей и характеризуется наиболее высокой энергией активации:
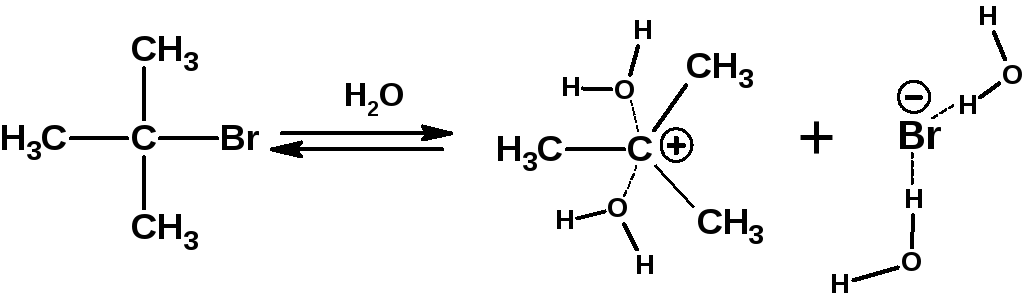
Бромид-ион образует с молекулами воды водородные связи и тем самым стабилизируется. Образующийся карбкатион также стабилизируется сольватацией растворителем. Но большее значение имеет стабильность самого карбкатиона. Он должен быть стабилизирован внутримолекулярными электронными эффектами, т.н. быть третичным или находиться в сопряжении с π-электронной системой (быть резонансно-стабилизированным).
На второй стадии происходит быстрое взаимодействие карбкатиона с нуклеофилом, в частности с водой:
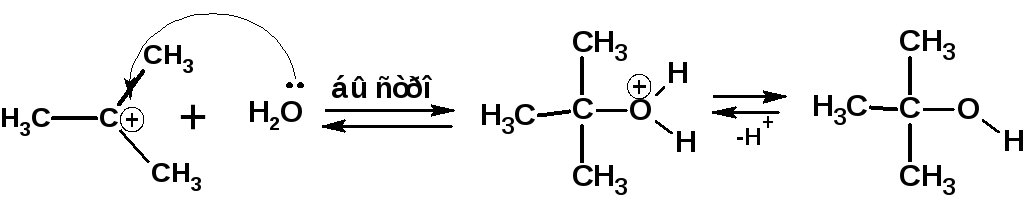
Быстрое присоединение молекулы воды к карбкатиону приводит к катиону трет-бутилгидроксония, кторый затем отщепляет протон с образованиемтрет-бутилового спирта. Этой схеме механизма соответствует следующая энергетическая диаграмма:

Особенности мономолекулярного нуклеофильногозамещения
1. Стереохимия реакции
Реакции SN1с участием оптически активных галогенпроизводных как правило сопровождаются исчезновением оптической активности. Причиной служит равновероятная возможность атаки нуклеофилом с обоих сторон плоскости карбокатиона, (имеет плоское строение):
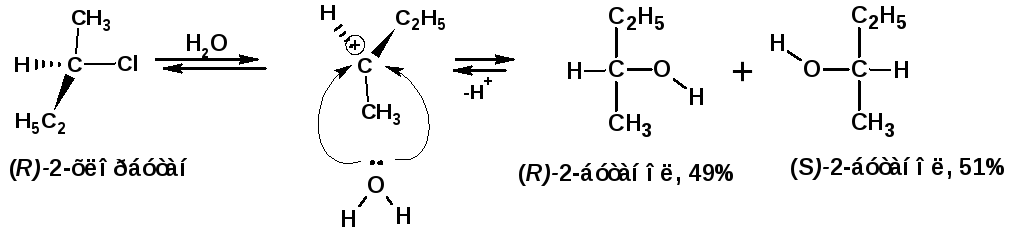
В результате возможности атаки карбкатиона с обоих сторон образуется смесь двух оптически активных изомеров, которая называется рацемической смесью. Сами компоненты рацемической смеси называются энантиомерами, а явление носит название рацемизацция.
2. Влияние строения субстрата в реакциях SN1.
В реакциях
скоростьлимитирующей стадией является образование карбкатиона. Поэтому активность галогенопроизводных возрастает в том же порядке, что и устойчивость образующихся карбкатионов. Метилгалогениды и первичные галогеналканы по механизму SN1 практически не реагируют из-за неустойчивости первичных карбкатионов. Вторичные галогеналканы реагируют очень медленно. Только третичные галогеналканы вступают в реакцииSN1 с достаточно высокой скоростью, что позволяет использовать реакцию практически.
Замена атомов водорода в метилгалогенидах на винильные и фенильные группы еще более резко повышает скорость реакции SN1 , поскольку на медленной стадии образуются карбкатионы, стабилизированные резонансом.
3. Влияние природы растворителя на реакции SN1.
Реакции SN1протекают, преимущественно в полярных протонных растворителях с высокой ионизирующей способностью. Вода обладает наибольшей ионизирующей способностью и обеспечивает максимальную скорость гидролиза и сольволиза. Однако многие галогенопроизводные не растворяются в воде. Поэтому в реакцияхSN1чаще всего в качестве растворителя применяют муравьиную и уксусную кислоты, метиловый и этиловый спирт или их водные растворы.
