
5. Химические свойства.
Химические превращения предельных углеводородов могут протекать либо после гомолитического разрыва углерод-углеродных связей, либо за счет отрыва атомов водорода, также обычно гомолитического, и последующим замещением их другими атомами или группами. Поэтому для предельных углеводородов характерны реакции расщепления и замещения.
Расщепление молекулы алкана по σ-связи С-С требует 350 кДж/моль. Расщепление -связи С-Н требует 340 - 420 кДж/моль. Т.е. связь углерод-углерод является менее прочной и, казалось бы, реакции должны предпочтительно идти по связи С-С. Однако реакции чаще идут с расщеплением связей С-Н, поскольку эти связи находятся на периферии молекулы и более доступны атаке реагентами.
Наряду с доступностью связей действуют и другие факторы, определяющие реакционную способность алканов. Например, по энергии связи С-Н различаются в зависимости от того с каким атом углерода соединен атом водорода. По энергии связи С-Н формируют следующий ряд:
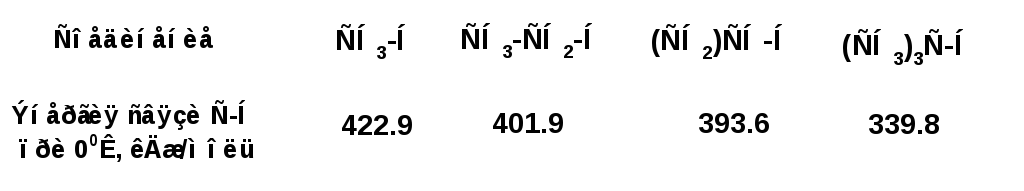
Энергия химической связи относится к разряду так называемых статических факторов, определяющих реакционную способность. На ряду со статическими - действуют динамические факторы. В частности в приложении к алканам действует фактор стабильности свободных радикалов.
Определение: Свободными радикалами называются частицы, имеющие один или несколько неспаренных электронов. Наибольшее значение в органической химии имеют свободные радикалы с неспаренным электроном на атоме углерода. Атом углерода, несущий неспаренный электрон, находится в состоянии sp2-гибридизации, а, следовательно, имеет плоскостное строение:
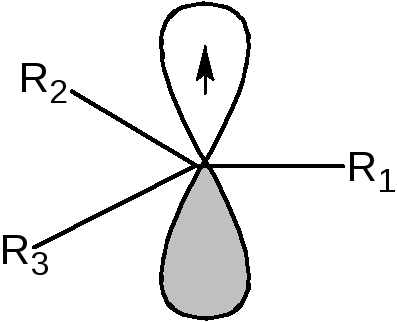
Если радикалы R1, R2и R3являются алкильными радикалами, то возможно взаимодействие (перекрывание) орбитали, на которой находится неспаренный электрон, со связями С-Н:
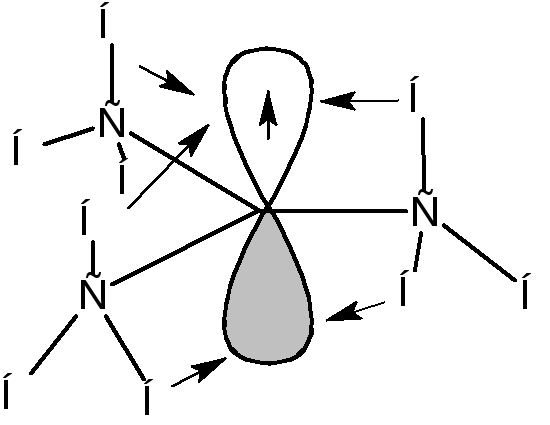
Такое взаимодействие называется сверхсопряжением или гиперконьюгацией. За счет сверхсопряжения неспаренный электрон получает приток электронной плотности с противоположным спином, что способствует его стабилизации. Из этой схемы следует, что чем больше алкильных заместителей у атома, несущего неспаренный электрон, тем более устойчивым является радикал. Соответственно радикалы формируют следующий ряд стабильности:

Ряд стабильности радикалов может иметь другое объяснение. Атом углерода, несущий неспаренный электрон, находится в состоянии sp2-гибридизации, а алкильные радикалы построены из атомов углерода в состоянии sp3-гибридизации. Поэтому атом углерода, несущий неспаренный электрон является более электроотрицательным, чем атомы углерода заместителей. Соответственно происходит смещение электронной плотности по системе σ-связей к атому, несущему неспаренный электрон. Чем больше будет заместителей, тем больше электронной плотности будет смещено к радикалу, тем выше его стабильность:

Совокупность статических и динамических факторов определяет характер и направление протекания реакций. В том числе реакций радикального замещения у насыщенного атома углерода. Реакции радикального замещения обозначаются символом SR.
Примеры реакций.
Галогенирование.
Замещение водородных атомов на атомы галогенов является одной из наиболее характерных реакций предельных углеводородов. Предельные углеводороды вступают в реакцию со всеми галогенами. Причем реакционная способность (скорость галогенирования) снижается в ряду фтор > хлор > бром > йод.
1.1. Фторирование.
Предельные углеводороды со свободным фтором реагируют со взрывом. Реакции идут очень быстро с большим выделением тепла (горят). Разбавление фтора азотом или применение растворителей, в качестве которых используют полностью фторированные углеводороды, позволяет получать полифтрорированные углеводороды:
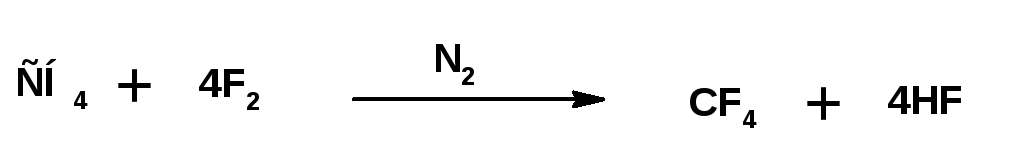
Фторированные углеводороды можно получить с использованием трифторида кобальта.
1.2. Хлорирование.
Хлор реагирует с насыщенными углеводородами только под влиянием света, нагревании (3000С) или в присутствии катализаторов. Причем последовательно замещаются хлором все атомы водорода. При хлорировании наиболее легко замещаются атомы водорода у третичного атома углерода, что связано с наменьшей энергией связи С-Н и наибольшей стабильностью, радикала, который образуется в ходе реакции. В ходе реакции образуются продукты замещения у всех атомов углерода. Соотношение между скоростями реакции замещения водородных атомов при первичном, вторичном и третичном равно 1 : 3.25 : 4.3.
При термическом хлорировании также образуется смесь различных продуктов хлорирования.
Катализаторами реакции, как правило, являются вещества, образующие при температуре реакции свободные радикалы.
Для выяснения роли радикалов в ходе реакции галогенирования, в частности хлорирования, рассмотрим ее механизм.
Определение: Механизм реакции – совокупность последовательных стадий, приводящая к образованию продуктов из заданных реагентов.
Исследования реакции хлорирования метана или реакции металепсии показали, что эта реакция имеет цепной, радикальный механизм и включает основные три стадии.
1. Зарождение цепи.
На этой стадии под действием кванта света молекула хлора распадается на два радикала:
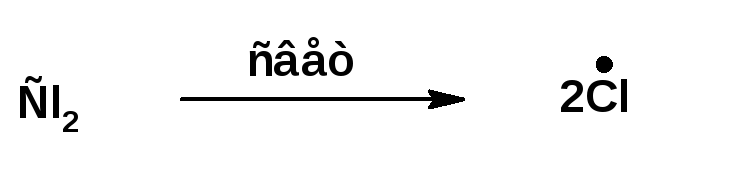
2. Рост цепи:
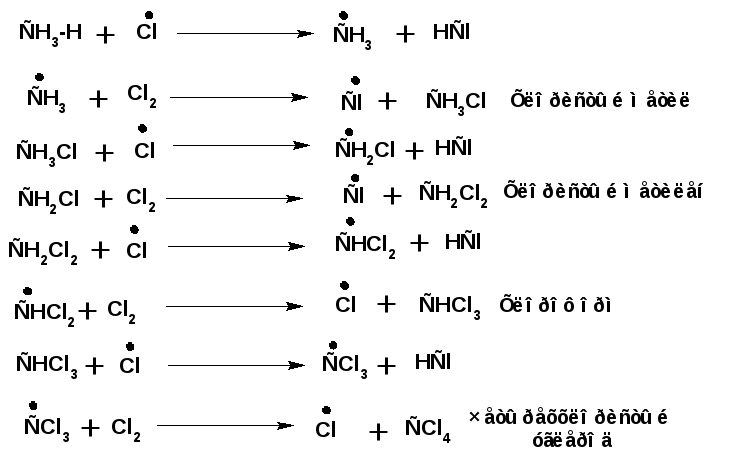
3.. Обрыв цепи:
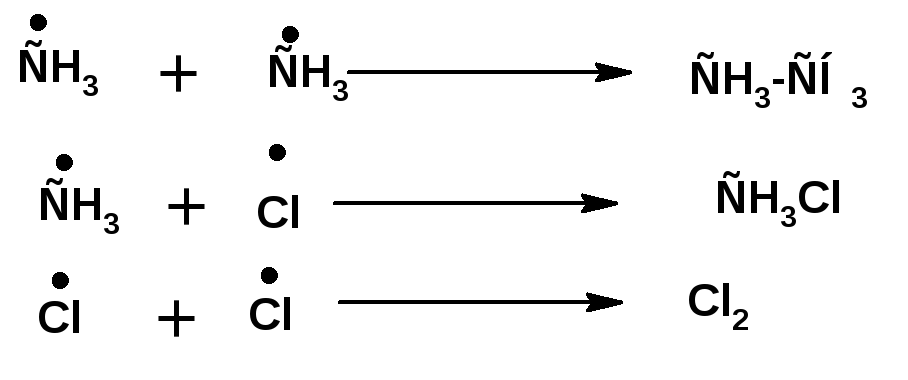
По ходу реакции можно определить тепловой эффект реакции:
Разрыв молекулы хлора на атомы под действием
фиолетового света, или температуры 3000С 242.8 кДж/моль
Разрыв связи С-Н 427.1 кДж/моль
Образование связи С-Сl -347.5 кДж/моль
Знак «-» означает выделение энергии
Образование связи Н-Сl -431.2 кДэж/моль
Энергетический баланс реакции - 108.8 кДж/моль.
1.3. Бромирование.
Реакция бромирования значительно менее экзотермична, чем хлорирование. Причем образование бромистого водорода при росте цепи является эндотермической реакцией. Поэтому скорость роста цепи гораздо ниже, чем при хлорировании. Более медленное течение реакции бромирования способствует более высокой избирательности (селективности) по сравнению с хлорированием. Соответственно в продуктах фотохимического бромирования алканов значительно преобладают продукты, образующиеся при разрыве наименее прочной связи С-Н и протекании реакции через наиболее стабильный радикал:
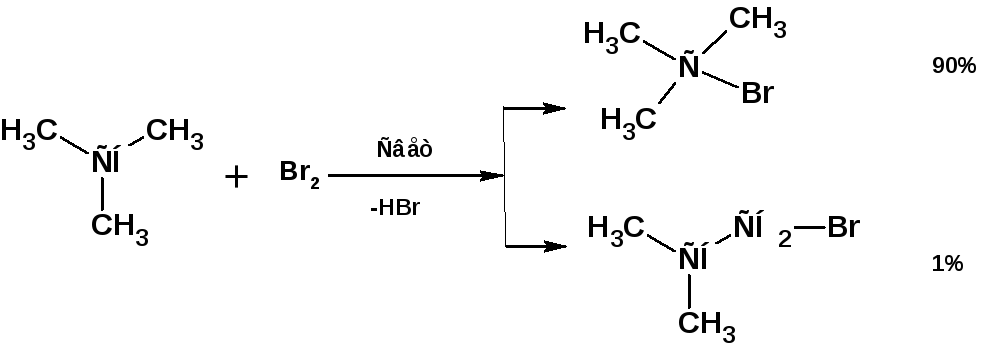
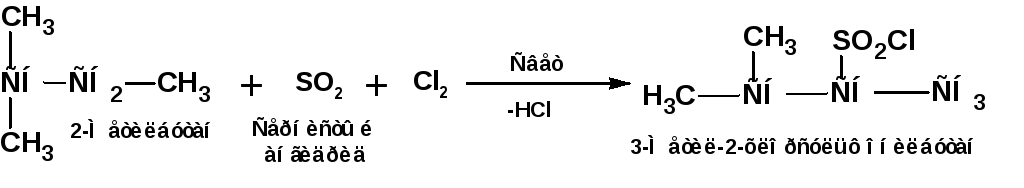
1.4. Сульфохлорирование.
Сульфохлорирование алканов при УФ-облучении, при комнатной температуре, протекает как цепной радикальный процесс (реакция Руффа). В качестве продуктов образуются хлорангидриды алкансульфокислот. Особенностью реакции является следующее: при наличии в молекуле углеводорода первичных, вторичных и третичных атомов углерода замещению не подвергаются атомы водорода при третичном атоме углерода:
1.5. Нитрование.
Атомы водорода в углеводородах могут быть замещены нитрогруппой -NO2. Соответствующая реакция называется реакцией нитрования. Протекает реакция также по цепному радикальному механизму. Нитрование алканов впервые провел М.И.Коновалов действием 10-20% азотной кислоты при 120-1500С. (реакция Коновалова, 1888г.):
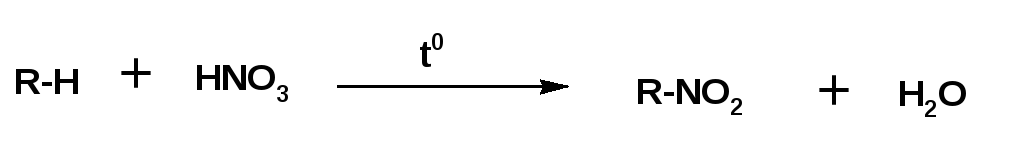
Данная реакция протекает в жидкой (по Коновалову) при 100-1500С, и в газовой фазе при 250-5000С.
В реакцию жидкофазного нитрования вступают все углеводороды, однако продукты образуются с низкими выходами. Наиболее высокие выхода получаются для алканов, имеющих третичные углеродные атомы.
В газовой фазе реакция нитрования сопровождается окислением углеводородов и расщеплением углерод-углеродных связей. Поэтому в продуктах наряду с основными содержатся низкомолекулярные нитроалканы. Так, в случае нитрования пропана образуется 34% 1-нитропропана СН3-СН2-СН2-NO2, 32% 2-нитропропана СН3-СНNO2-СН3, 26% нитроэтана СН3-СН2-NO2, и 8% нитрометана СН3-NO2.
1.4. Окисление алканов.
Наиболее распространенным процессом в химии алканов является их окисление. Как известно алканы составляют основные виды энергоносителей: бензин, дизельное топливо, авиационный керосин, топочный мазут. Сгорание алканов происходит до углекисло газа и воды. Но двуокись углерода и вода это конечные продукты реакции со сложным механизмом, протекающим через стадии образования радикалов и их распада.
В процессе окисления предельных углеводородов в качестве промежуточных продуктов образуются органические гидроперекиси:
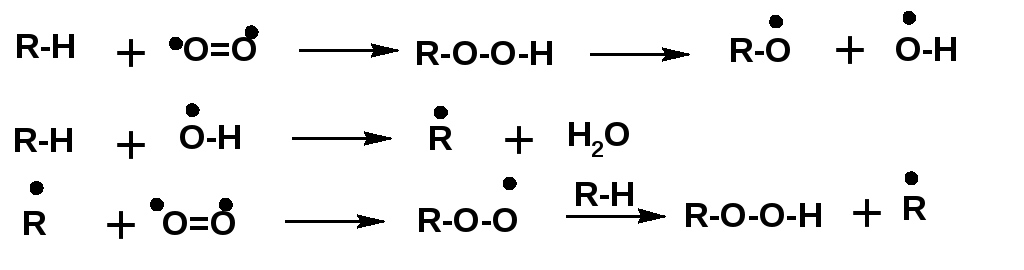
Образующиеся в результате распада гидроперекиси радикалы вступают в две реакции.
1. Отрывают атомы водорода от других молекул алканов и дают спирты.
2. Распадаются по β-связи (β по отношению к атому, несущему радикал) с образованием альдегидов и кетонов.
Радикалы третичных гидроперекисей распадаются с образованием третичного спирта или кетона, по схеме:
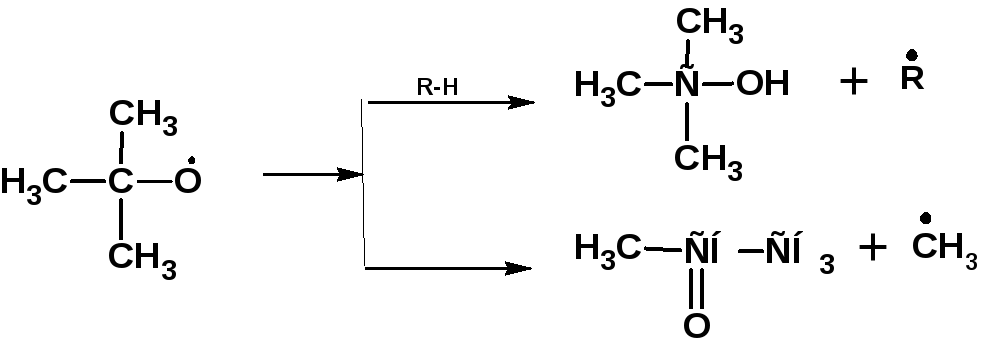
Радикалы вторичных гидроперекисей, в зависимости от температуры распадаются по двум схемам. При низких температурах образуются, преимущественно, спирты и кетоны:
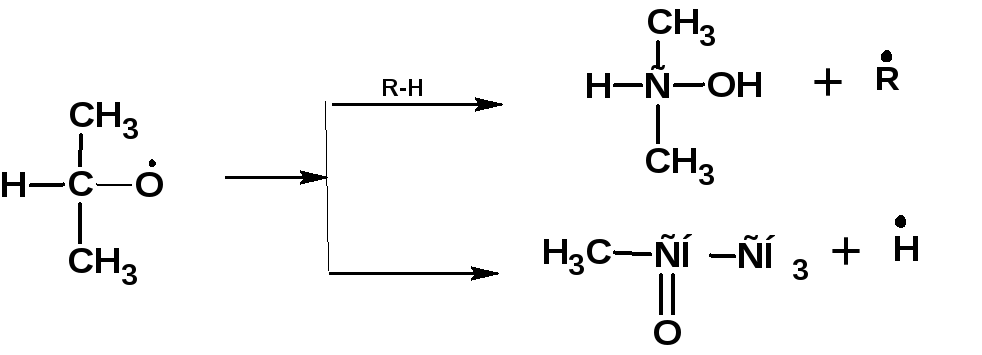
При высоких температурах преимущественно образуются спирты и альдегиды:
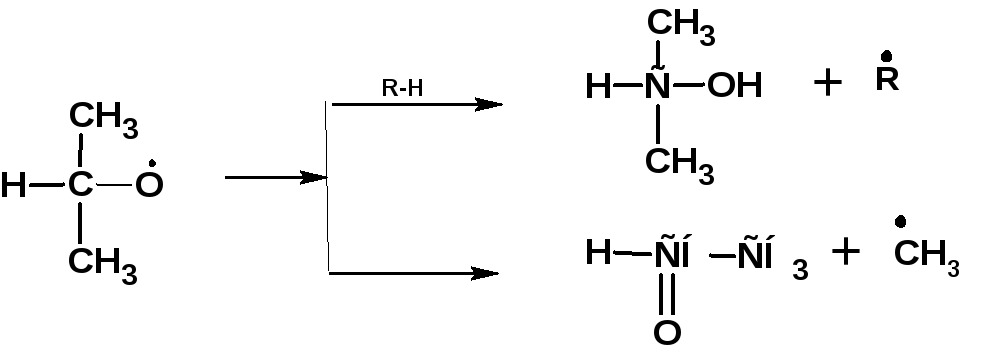
Радикалы первичных гидроперекисей распадаются с образованием первичного спирта альдегида и формальдегида:
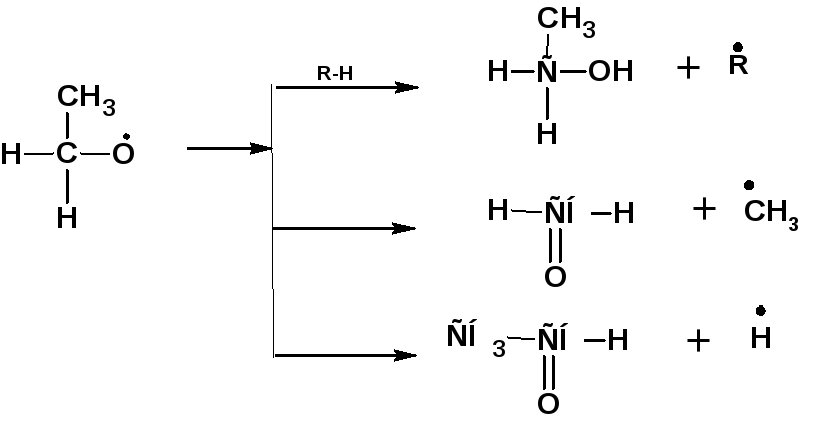
1.6. Крекинг углеводородов при высокой температуре.
При температурах 300-7000С предельные углеводороды образуют сложную смесь предельных, непредельных и ароматических углеводородов. Основными процессами при крекинге являются дегидрогенизация и разрыв углеродной цепи. Эти процессы протекают через стадию свободных радикалов.
Свободные радикалы, образующиеся в процессе крекинга, способны к следующим превращениям:
1. Распад по β-связи (β по отношению к атому, несущему радикал). В результате распада образуются алкан и алкен:
R-СН-СН2R + СН2= СН2
