
- •Введение
- •Понятие модели
- •Лекция 2 Математическое моделирование однофазных потоков
- •Лекция 3 Математическое моделирование теплообменных процессов
- •Температурное поле
- •Основы теплового расчета
- •Проектный расчет теплообменного аппарата
- •Проверочный расчет теплообменного аппарата
- •Математические модели теплообменников
- •Теплообменник типа «перемешивание-перемешивание»
- •Теплообменник типа «перемешивание-вытеснение»
- •Теплообменник типа «вытеснение-вытеснение»
- •Постановка задачи
- •Для прямотока
- •Для противотока
- •Тепловой баланс теплообменника: для прямотока
- •Для противотока
- •Варианты заданий для расчета теплообменника
- •Лекция 4 Моделирование кинетики химических и ферментативных реакций
- •Постановка задачи
- •Обратная задача кинетики
- •5.2. Методические указания по практической части.
- •3.4.1. Ингибирование ферментативных реакций
- •Математическое моделирование биОлогической очистки сточных вод в аэротенке
- •Аэротенк
- •Лекция 6 Автоматизированная оценка степени загрязнения окружающей среды от газовых выбросов
Постановка задачи
Р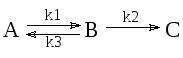 ассмотрим
методику решения прямой задачи кинетики
на примере системы реакций первого
порядка
ассмотрим
методику решения прямой задачи кинетики
на примере системы реакций первого
порядка
Заданы следующие исходные данные: k1= 1,5 [1/c];k2 = 0,5 [1/c];k3= 0,1 [1/c];Ca0= 100 [моль/л];Cb0=Cc0= 0. Для решения этой задачи потребуется математическая модель, в качестве которой могут служить дифференциальные уравнения, описывающие динамику процесса, т.е. изменения концентраций реагирующих веществ во времени.
В указанной реакции во взаимодействие вступают три вещества с текущими концентрациями Ca,Cb,Cc. Изменение концентраций этих веществ во времени записываем в виде дифференциаловdCa/dt,dCa/dt,dCc/dt, которые используем в качестве левых частей дифференциальных уравнений. Правыми частями уравнений кинетики будут соотношения, записанные на основании закона действующих масс.
Рассмотрим вещество
A, участвующее в двух
реакциях. В первой![]() концентрация
веществаAубывает
вследствие процесса превращения его в
В. Скорость этого элементарного процесса
согласно закону действующих масс
представим зависимостью
концентрация
веществаAубывает
вследствие процесса превращения его в
В. Скорость этого элементарного процесса
согласно закону действующих масс
представим зависимостью![]() ,
т.е. скорость пропорциональна концентрации
реагирующих веществ. Знак минус
показывает, что веществоAубывает.
,
т.е. скорость пропорциональна концентрации
реагирующих веществ. Знак минус
показывает, что веществоAубывает.
Во второй реакции
![]() веществоAпребывает в
результате обратного процесса превращения
веществаBв веществоAс константойk3.
Скорость этой стадии
веществоAпребывает в
результате обратного процесса превращения
веществаBв веществоAс константойk3.
Скорость этой стадии![]() ,
т.е. реагирующим веществом является
веществоB. Знак плюс
свидетельствует о том, что веществоAв реакции пребывает. Суммарная скорость
по веществуA:
,
т.е. реагирующим веществом является
веществоB. Знак плюс
свидетельствует о том, что веществоAв реакции пребывает. Суммарная скорость
по веществуA:
![]()
Учитывая, что dCa/dt=Wa, получим новое дифференциальное уравнение кинетики по веществу А:
![]() .
.
По аналогии выводим следующее дифференциальное уравнение, физический смысл которого есть изменение концентрации вещества Bпо времени. ВеществоBучаствует в трех реакциях:
![]() (получается
изA);
(получается
изA);
![]() (тратится
на получениеA);
(тратится
на получениеA);
![]() (тратится
на 1получениеC).
(тратится
на 1получениеC).
Суммарная скорость
реакции по веществу B:![]() ,
где
,
где![]() ,
,![]() ,
,![]() .
Дифференциальное уравнение кинетики
по веществу.
.
Дифференциальное уравнение кинетики
по веществу.
![]()
Наконец, рассмотрим
скорость реакции по веществу С, которое
принимает участие в одной реакции:
![]() .
Скорость этой стадии:
.
Скорость этой стадии:![]() ,
т.е. вещество С получается из В.
Дифференциальное уравнение кинетики
по веществу С:
,
т.е. вещество С получается из В.
Дифференциальное уравнение кинетики
по веществу С:
![]() .
.
В итоге, математической моделью кинетики данной системы реакций будет являться система дифференциальных уравнений

с начальными условиями при t= 0,Ca0= 100 [моль/л],Cb0=Cc0= 0.
Таким образом, прямая задача кинетики (получения кривых изменения концентрации компонентов реакции во времени: Ca(t),Cb(t),Cc(t) – кинетических кривых) сводится к задаче решения системы дифференциальных уравнений с начальными условиями. Для решения этой системы на ЭВМ используя различные численные методы, например, метод Эйлера, метод Рунге – Кутта.
Воспользуемся в
данном случае наиболее простым методом
численного решения дифференциальных
уравнений – методом Эйлера. Если имеется
дифференциальное уравнение вида
![]() с
начальным условием
с
начальным условием![]() ,
то его решение – первообразнуюy=y(x) – можно
получить в виде дискретных точекXk,Yk,
где
,
то его решение – первообразнуюy=y(x) – можно
получить в виде дискретных точекXk,Yk,
где![]() - число узлов интегрирования из
рекуррентных формул.
- число узлов интегрирования из
рекуррентных формул.
![]()
Параметр hназывается шагом интегрирования, чем меньше шаг интегрирования, тем выше точность расчетов.
Предположим, что нам нужно получить кинетические кривые Ca(t),Cb(t),Cc(t) на временном отрезке от 0 доtконца.. Возьмем шаг интегрированияh= 0,1 с, а время выдачи значений концентрацийCa,Cb,Ccна экран дисплея равным 1с (это значение принято называтьшагом печати), аtкон.Равным 20 с.
Составим блок – схему программы получения кинетических кривых (см. рис.4.1). Присвоим переменным Ca,Cb,Ccдля удобства имена А, В, С. Обозначим правые части дифференциальных уравнений: первое черезF1, второго черезF2, третийF3.
Р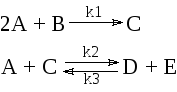 ассмотрим
более сложную реакцию, протекающую по
схеме
ассмотрим
более сложную реакцию, протекающую по
схеме
Здесь необходимо связать концентрации веществ A,B,C,D,Eсо степенями полноты, используя формулу (4.14).
Для данной системы реакций составляем матрицу, в который число столбов равно числу компонентов, а число строк – количеству реакций в системе. Элементами этой матрицы являются стехиометрические коэффициенты ij компонентов в реакции
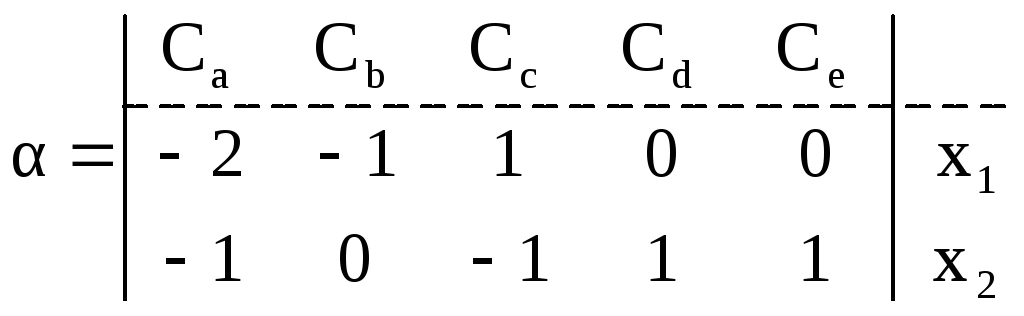
Рассмотрим первую строку матрицы , 1=(-2,-1,1,0,0), которая показывает, что в первой реакции тратятся 2 моля веществаA? 1 моль веществаB, а веществаDиEне принимают участия в реакции (т.е. для продуктов реакцииj> 0, для реагентовj < 0).
Вторая строка матрицы 2 =(-1 0 –1 1 1) свидетельствует о том, что во второй реакции тратятся 1 моль веществаA, 1 моль веществаCи получается по одному молю веществDиE.
Вводим степени полноты первой реакции x1и второй реакцииx2, тогда по уравнению (4.14) имеем
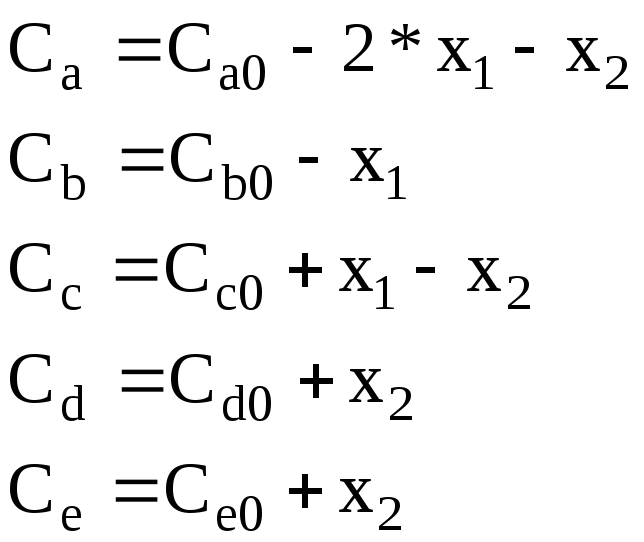
Таким образом, связь между концентрациями веществ и степенями полноты найдена в виде линейных соотношений (4.14).
Теперь переходим непосредственно к решению прямой задачи кинетики. Скорость химической реакции по определению
![]()
Подставляя в это соотношение вместо Cjего выражение, получаем
![]() или
или![]() .
.
Записываем для рассматриваемой системы реакций дифференциальные уравнения кинетики. Левыми частями их будут производные по степеням полноты реакции: dx1/dtиdx2/dt, правые же части записываем на основании закона действующих масс.
Для реакции
![]()
со степенью полноты x1дифференциальное уравнение запишется в виде
![]()
З![]() десь
скорость реакции пропорциональна
концентрации реагентовAиBв степени их
стехиометрических коэффициентов, аkjявляется коэффициентом пропорциональности
(константа скорости первой реакции).
десь
скорость реакции пропорциональна
концентрации реагентовAиBв степени их
стехиометрических коэффициентов, аkjявляется коэффициентом пропорциональности
(константа скорости первой реакции).
Для второй реакции
со степенью полноты x2дифференциальное уравнение запишется в виде
![]()
Подставляя в уравнения для степеней полноты соотношения, связывающие концентрации веществ и степеней полноты соотношения, связывающие концентрации веществ и степени полноты, получаем математическую модель кинетики неэлементарной системы реакции
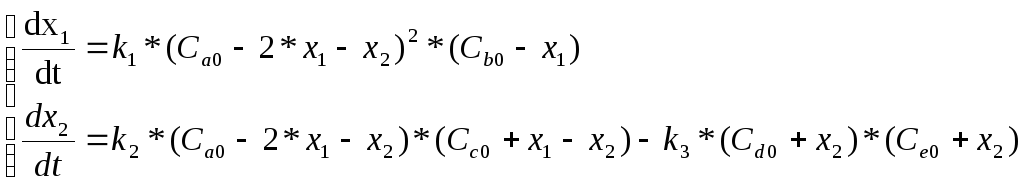
с начальными условиями: t= 0,x1= 0,x2= 0.
Решив систему дифференциальных уравнений кинетики каким – либо численным методом, получим кривые x1(t),x2(t). Используя связь между концентрациями компонентов и степенями полноты, можно рассчитать кинетические кривыеCa(t),Cb(t),Cc(t),Cd(t),Ce(t).
