
книги / Химия окружающей среды
..pdfв котором среди «активных» примесей присутствует лишь диоксид углерода, и карбонатными породами, состоящими из кальцита (СаСО3), в 2080 г.? Ожидается, что концентрация диоксида углерода в воздухе к 2080 г. достигнет 600 млн–1. Температура равна 298 К, общее давление воздуха 101,3 кПа, парциальное давление паров воды 3160 Па. При оценке принять, что коэффициенты активности всех компонентов равны единице.
2.19.Какую жесткость и щелочность будут иметь поверхностные воды, находящиеся в равновесии с атмосферным воздухом, в котором среди «активных» примесей присутствует лишь диоксид углерода, и карбонатными порода-
ми, состоящими из кальцита (СаСО3)? Концентрация диоксида углерода в воздухе равна 600 млн–1, температура 298 К, общее давление воздуха 101,3 кПа, парциальное давление паров воды 3160 Па. При оценке принять, что коэффициенты активности всех компонентов равны единице.
2.20.Определите рН воды в равновесии с СО2 атмосферы и магнезитом (MgCO3), если концентрация в воздухе СО2 342 ppm, температура 25 °С.
2.21.На какую максимальную глубину за счет растворения карбоната кальция в выпадающей на плато дождевой воде может опуститься уровень природного известнякового плато к 3000 году, если дождевая вода полностью стекает
споверхности плато, но лишь после установления равновесия между дождевой водой, карбонатом кальция (кальцитом) и атмосферным воздухом? Уровень осадков, выпадающих на плато в течение этого периода, принять одинаковым и равным 900 мм/год. Температура все время составляла 298 К, давление 101,3 кПа; концентрация диоксида углерода в атмо-
сферном воздухе стабилизируется на уровне 0,060 об.%. Плотность известняка принять равной 2,7 г/см3. В качестве «активной» примеси в воздухе присутствует только диоксид углерода.
221
2.22.Постройте диаграмму ре– – рН для системы Fe – О –
–Н2О, принимая во внимание лишь следующие превраще-
ния: Fe2О3 – Fe3O4; Fe3+– Fe2О3; Fe3+ – Fe2+; Fe2О3 – Fe2+,
и опишите области устойчивого существования соединений железа при различных значениях рН. Принять, что концентрации ионов трех- и двухвалентного железаравны10–9 моль/л.
2.23. Определите отношение активностей ионов Fe2+ и Fe3+ в водоеме, интенсивно аэрируемом воздухом, при давлении 95 кПа, рН = 8,3, температуре 25 °С и парциальном давлении PH2O = 3170 Па.
2.24.Какое значение будет иметь редокс-уровень системы, определяемый верхней границей устойчивости воды, если парциальное давление кислорода в находящемся в равновесии с подземной водой воздухе снизится с 1 атм до 0,01 атм, а рН раствора будет равен 5?
2.25.Какое парциальное давление кислорода должно соответствовать редокс-уровню системы, в которой протекает анаэробный процесс восстановления диоксида углерода до метана (ре– = –4,2), при наступлении равновесия, если рН раствора равен 8,3?
2.26.Какое максимальное количество мг органических
веществ с общей формулой C106H263O110N16P может быть окислено за счет растворенного кислорода (при высоких значениях ре–) в каждом литре природной воды, находящейся
вравновесии с приземным воздухом (температура 298 К, об-
щее давление 101,3 кПа, парциальное давление паров воды 3,1 · 103 Па), если контакт с воздухом был прерван и поступление дополнительного кислорода в процессе окисления отсутствовало?
2.27.Какой минимальный объем природной воды необходим для растворения сероводорода, образовавшегося при окислении 15 г сахара в процессе сульфат-редукции, если весь выделившийся сероводород переходит в раствор, в ко-
222
тором концентрация H2S не превышает значений подпороговой концентрации, определяемой по запаху (ППК(орг) =
=0,05мг/л)? Сахар имеет брутто-формулу С12Н22О11.
2.28.Определите максимально возможное количество
сероводорода в зоне гиполимниона в период летней стратификации (кг, л), если значение ре– соответствовало процессу сульфат-редукции и в водоем в течение 45 суток поступало 3 ммоль/ч фосфора (Р) в виде растворенных фосфатов. Фосфор полностью расходовался на развитие фитопланктона (C106H263O110N16P), который в эпилимнионе и зоне термоклина не окислялся.
223

МОДУЛЬ 3. ХИМИЯ ПОЧВЫ
Глава 9
ФИЗИКО-ХИМИЧЕСКИЕ ПРОЦЕССЫ В ПОЧВАХ
Долгие годы почва рассматривалась либо как разрушенная выветриванием разновидность горных пород, либо как нанос, либо как рыхлый пахотный слой, в котором находятся корни растений. Термины «земля» и «почва» были равнозначны. Лишь в 1874 г. великий русский естествоиспытатель В.В. Докучаев дал первое научное определение понятия «почва». В.В. Докучаеву принадлежит открытие законов происхождения и географического распространения почв. Он первый показал, что именно в почвах наиболее тесно переплетены и взаимосвязаны геологические и биологические процессы, развивающиеся на поверхности Земли [55].
Почвенный покров Земли представляет собой тончайшую оболочку планеты на суше и дне мелководий, которая значительно уступает по массе другим геоcферам. Однако это хрупкое природное образование является источником существования множества живых организмов, включая и человека [49].
Почвенный покров тесно взаимодействует со всеми геосферами: атмосферой, гидросферой, литосферой, а также с биосферой. Процессы, протекающие в почвенном слое, являются частью глобальных и региональных кругооборотов вещества в природе. Поэтому знания о генезисе почв, протекающих в них химических процессах и физических свойствах почв необходимы при рассмотрении вопросов трансформации примесей в окружающей среде и являются неотъемлемой частью представлений о химии окружающей среды [56].
224
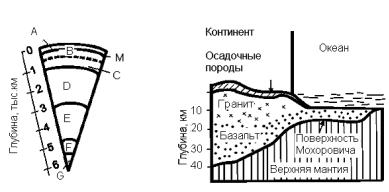
9.1. Строение литосферы и структура земной коры
К важнейшим научным открытиям начала ХХ века, безусловно, следует отнести вывод о наличии на Земле концентрических оболочек различной плотности [51]. На основании данных о скорости прохождения сейсмических волн земные недра разделяют на ряд слоев (рис. 9.1).
а |
б |
Рис. 9.1. Слои Земли (а) и строение коры по Гутенбергу (б) [57]
Верхний слой (слой А) – это земная кора – твердая внешняя оболочка Земли. При переходе от земной коры к внутренней оболочке (слой В) происходит скачкообразное изменение в распространении сейсмических волн. Эта граница получила название раздела Мохоровича (М). По современным данным, глубина залегания поверхности Мохоровича, а следовательно, и толщина земной коры, изменяется от 6 км под дном океана до 70 км в горных районах. Расположенную ниже поверхности Мохоровича толщу называют внутренней оболочкой, или мантией, Земли. Ей соответствуют слои В, С, D (рис. 9.1, а). Мантия Земли почти в 40 раз толще земной коры и простирается до глубины 2900 км.
225
Слои В и С отличаются по скорости прохождения сейсмических волн друг от друга и от слоя D. Они образуют верхнюю мантию. Слои Е, F, G входят в состав ядра Земли: слой Е
(2900–4980 км) – внешнее ядро, слой F (4980–5120 км) – пере-
ходная зона ядра и слой G (5120–6370 км) – внутреннее ядро. Установлено, что плотность земного вещества с глубиной возрастает. На этом основании предполагается, что в составе мантии преобладают более тяжелые химические элементы, такие как железо, хром, магний. Резкое изменение плотности вещества на границе мантии и ядра связано, вероятно, с изменением фазового состояния или, возможно, химического состава преобладающего вещества. Однако до настоящего времени нет единого мнения о химическом составе внутренней оболочки ядра, и отсутствует единая теория глу-
бинного строения Земли [59].
Наиболее изученной частью Земли является ее верхний слой – земная кора. Среднее содержание химических элементов в земной коре впервые определил американский геохимик Ф. Кларк. Более сорока лет работал он над этой проблемой и несколько раз опубликовывал все более подробные сведения о составе земной коры. В честь Ф. Кларка, первым занявшегося этой трудоемкой работой, А.Е. Ферсман предложил называть кларком среднее содержание элементов в земной коре, на Земле в целом или в других природных телах, выраженное в процентах. Анализы большого числа горных пород (табл. 9.1) показывают, что земная кора более чем на 99 % состоит всего из девяти химических элементов.
На долю остальных 80 элементов, встречающихся в земной коре (их называют редкими и рассеянными), приходится всего 0,52 %.
Кислород, кремний и алюминий являются главными элементами земной коры. На их долю приходится 84,55 % ее массы. Но еще более поразительная картина получается при сравнении объемных кларков элементов, рассчитанных на
226

основании данных В. Гольдшмидта об ионных радиусах. В этом случае на кислород приходится 91,97 % всего объема, и земная кора предстает перед исследователем в виде сплошного кислородного каркаса, в пустотах которого располагаются атомы кремния и других элементов. Остальные 80 элементов, встречающиеся в земной коре, или изоморфно входят в кристаллические решетки, образованные главными элементами земной коры, или остаются в твердом кристаллическом веществе в неупорядоченном, рассеянном состоянии.
Таблица 9.1 Кларки важнейших химических элементов земной коры [57]
Элемент |
Кларк |
|
Элемент |
Кларк |
|
||
массовый, |
объемный, |
массовый, |
объемный, |
||||
|
мас.% |
|
об.% |
|
мас.% |
|
об.% |
Кислород |
47,0 |
|
91,97 |
Калий |
2,50 |
|
2,14 |
Кремний |
29,5 |
|
0,89 |
Натрий |
2,50 |
|
1,60 |
Алюминий |
8,05 |
|
0,77 |
Магний |
1,87 |
|
0,56 |
Железо |
4,65 |
|
0,68 |
Титан |
0,45 |
|
– |
Кальций |
2,96 |
|
1,48 |
|
|
|
|
Рассеянные элементы распределены в земной коре очень неравномерно. Поэтому для характеристики распространенности элементов в отдельных участках земной коры недостаточно только среднего содержания элемента. Для количественной оценки распределения химических элементов в земной коре В.И. Вернадский ввел понятие кларк концентрации Kk:
Кk = A/K, |
(9.1) |
где А – содержание элемента в земной коре в данном регионе, мас.%; К – кларк элемента в земной коре, мас.%.
Многочисленные анализы проб земной коры позволяют выделить территории, различающиеся уровнем содержания
227
определенных элементов. Такие территории называют геохимическими провинциями. Так, например, районы Уральских гор, характеризующиеся повышенным содержанием меди, хрома, никеля и других элементов, следует отнести к уральской геохимической провинции. В пределах провинций также имеются участки, различающиеся содержанием рассеянных элементов. Это так называемый геохимический фон эле-
ментов.
Примеры решения задач (строение литосферы) [16]
ПРИМЕР 9.1. Используя данные табл. 9.1, рассчитайте мольное соотношение атомов кислорода и кремния в земной коре.
Решение. Как видно из табл. 9.1, массовые кларки кислорода и кремния в земной коре равны 47,0 и 29,5 мас.% соответственно. Атомные массы кислорода и кремния равны 16
и28 соответственно. Количество молей атомов кислорода
икремния в 100 г земной коры определяется следующим выражением:
n = m/A,
где n – количество молей; т – масса элемента в 100 г земной коры, г; А – молярная масса атомов кислорода, г/моль.
Всоответствии с этим количество молей кислорода nO
икремния nSi соответственно:
nO = 47,0/16 = 2,9 (моль),
nSi = 29,5/28,1 = 1,1 (моль).
Искомое соотношение nO/nSi = 2,9/1,1 = 2,6.
Ответ: мольное соотношение атомов кислорода и кремния в земной коре равно 2,6.
228
ПРИМЕР 9.2. Определите содержание кислорода и кремния в мас.% в нефелине-K[AlSiO4]. .Сравните полученные результаты с данными, приведенными в табл. 9.1.
Решение. Массовое содержаниеWэ (мас.%) элемента в минерале, в частности нефелине, определяется следующим выражением:
Wэ = (mэ/Mнеф)100,
где mэ – общая масса элемента в молекуле; Mнеф – молекулярная масса нефелина.
Значение Mнеф определяется суммированием атомных масс всех составляющих данную молекулу элементов с учетом стехиометрических коэффициентов:
Mнеф = 1AK + 1AAl + 1ASi + 4AO = 39 + 27 + 28 + 64 = 158.
Тогда содержание кислорода и кремния в мас.% соответственно:
WO = (64/158)100 = 40 мас.%,
WSi = (28/158)100 = 18 мас.%.
Полученные значения 40 и 18 мас.% отличаются от соответствующих значений, приведенных в табл. 9.1, поскольку, по определению, кларк есть среднее содержание элемента в земной коре, тогда как в задаче определено содержание элементов в конкретном минерале
Ответ: содержание кислорода и кремния в нефелине составляет 40 и 18 мас.% соответственно.
Глава 10 МИНЕРАЛЫ И ГОРНЫЕ ПОРОДЫ
Химические элементы в земной коре находятся преимущественно в виде химических соединений. Однородные по составу и строению природные химические соединения или однородные структуры, возникающие при различных
229
химических и физико-химических процессах в земной коре, принято называть минералами. В земной коре минералы встречаются в твердом, жидком и газообразном состояниях. Основную массу составляют твердые минералы. Каждый минерал характеризуется внутренней однородностью, определенными физическими свойствами и признаками, по которым его можно отличить от других минералов [60].
В природе минералы находятся чаще всего в виде комплексных минеральных агрегатов – горных пород, образующих самостоятельные геологические тела более или менее постоянного минералогического и химического состава. В настоящее время известно около 3000 минералов, и ежегодно открываются все новые их разновидности. Однако лишь около 100 минералов имеют сравнительно большое практическое значение и только 30 из них могут быть отнесены к породообразующим минералам. В зависимости от условий образования горные породы принято делить на три главные группы: магматические, осадочные и метаморфические. Магматические породы возникают при затвердевании магматического расплава на поверхности или в глубинах земной коры. При этом образуются глубинные (интрузивные)
иповерхностные (эффузивные) породы [61]. В табл. 10.1 представлено ориентировочное содержание главных породообразующих минералов земной коры.
Осадочные породы образуются путем отложения материала разрушенных или растворенных горных пород любого генезиса как на суше, так и в море. Осадочные породы залегают слоями. Метаморфические породы формируются путем преобразования магматических или осадочных пород в глубинах земной коры под воздействием высоких температур
идавлений.
230
