
- •27 Введение
- •Глава 1. Технологические воды гальванических производств
- •Глава 2. Теоретические основы электродиализа
- •2.1 Методы организации
- •Глава 3. Теория массопереноса
- •Глава 4. Основные технологические параметры процессов электрохимической очистки сточных вод
- •4.1. Условия применения метода
- •Глава 5. Расчет электродиализатора
- •Список использованной литературы
2.1 Методы организации
Организация процесса электродиализа: он может быть однонаправленным (классическим) или обратимым. При однонаправленной схеме полярность приложенного постоянного напряжения и назначение камер (опресняющих и концентрирующих) остаются неизменными. Недостаток такой схемы – загрязнение поверхности мембран минеральными и неминеральными веществами, содержащимися в воде (соли жесткости, органические и неорганические коллоиды, микробиологические организмы и т.д.). При обратимом процессе происходит периодическое изменение полярности приложенного напряжения. Отсек, который вначале был опресняющим, при изменении направления тока становится концентрирующим, и наоборот. Так осуществляется очистка мембран от загрязнений. Особенность обратимого электродиализа – использование симметричных мембран, то есть они работают одинаково в обоих направлениях, и системы ОЭД имеют симметричную конфигурацию. Недостаток метода – необходимость предварительной очистки вод от взвешенных и коллоидных частиц, которые могут засорять ионитные мембраны.
Глава 3. Теория массопереноса
Наличие в ионообменных мембранах распределенных по объему фиксированных ионогенных групп приводит к зависимости от координат потенциальной энергии подвижных ионов. Минимальной энергией противоион обладает, находясь непосредственно у ионогенной группы; коион, напротив, в этом положении имеет максимальную потенциальную энергию. Поэтому перенос ионов по объему ионита сопряжен с преодолением ряда потенциальных барьеров. Под влиянием тепловых флуктуации отдельные противоионы могут приобрести достаточную энергию для отрыва от фиксированной группы и выхода из потенциальной ямы. При этом образуются свободная фиксированная группа (ионная вакансия) и "внедренный" ион. Таким образом, движение ионов в ионообменном материале по своему механизму напоминает движение ионов в кристалле. В то же время набухшие ионообменные мембраны содержат большое количество воды, что обеспечивает, по сравнению с кристаллами, аномально высокую степень диссоциации противоионов. Во многих мембранах отмечается также аномально высокая подвижность ионов водорода (в катионообменных) и гидроксила (в анионообменных).
Основываясь на представлениях о структуре ионита, сделано утверждение, что наиболее вероятными в ионообменных материалах являются три механизма переноса ионов: вакансионный, эстафетный и сольватационный . В любом случае перенос ионов в мембране представляется, как совокупность скачков через некоторые потенциальные барьеры, что позволяет отождествлять элементарный акт переноса заряда[10]
массы в мембране с протеканием элементарного акта химической реакции и воспользоваться для описания переноса частиц теорией абсолютных скоростей реакции.
Мы рассмотрим теорию массопереноса в электродиализной ячейке, исходя из стационарных условий процесса и однородного характера ионообменной мембраны. На рис. 1 представлена электродиализная ячейка.
Средняя расчетная плотность тока по длине пути определяется выражением
|
iср= |
L |
|
∫i(l)dl/L, | |
|
|
(2.86)
где l - общая длина пути потока.
Связь площади мембраны FM, требуемой для достижения нужной степени деминерализации ΔС, пропускной способности установки Qуст и средней плотности тока iср определяется, согласно закона Фарадея, как
|
FM= |
FQуст·ΔC |
|
η·iср |
(2.87)
где F - число Фарадея; η - выход по току, т.е. эффективность использования тока с целью "переброски" иона через мембрану.
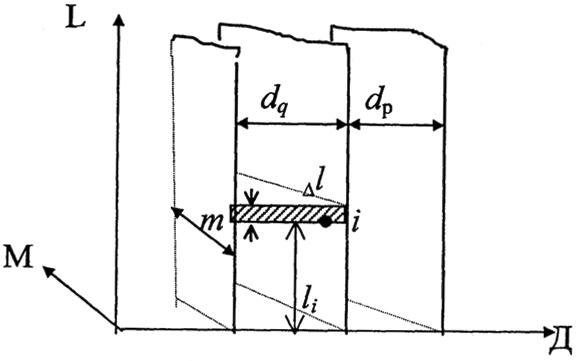
Рис. 1 Расчетная схема процесса деминерализации в электродиализной ячейке
LI - расстояние от входа в ячейку до i-ой точки; Δ1 - приращение длины: dq - толщина дилюатной камеры; dp - толщина рассольной камеры; т - ширина потока
Выход по току можно определить по отношению количества вещества j, перешедшему с одной стороны мембраны на другую, к количеству прошедшего электричества, пропорциональному i,
|
η= |
j·F |
|
i |
(2.88)
Количественно поток ионов определяется из потоков в растворе и мембране. Например, для катионообменной мембраны он может быть рассчитан как
|
j=Δj+ =Z+·j+- |
i·t+ |
|
F |
(2.89)
где Δj+ - убыль катионов на отдающей стороне мембраны.
Общую площадь мембран FM и пропускную способность установки представим в следующем виде:
FM=m·L·nM, Qуст= V·m·da·nяч,
(2.90)
где пм - число мембран, V - скорость протекания дилюата, т - ширина потока, da - расстояние между мембранами, пяч - число ячеек. Подставив в выражение (2.87) уравнения (2.90), получим:
|
L= |
FVdqΔC |
|
η·iср |
(2.91)
Плотность тока распределяется по длине ячейки в зависимости от содержания дилюата и рассола в соответствии с законом Ома. Значение средней плотности тока, учитывающее конструктивные параметры ячеек и прикладываемое напряжение
|
iср= |
| |||||||||
|
(2.92)
где uяч- падение напряжения; XN - безразмерная величина, определяемая отношением концентраций рассола и дилюата в конце пути потока в аппарате, равна
|
XN= |
Kc + β(1-Y) |
|
Y |
(2.92’)
β - коэффициент массопереноса; Y- степень опреснения воды; N- число ступеней опреснения;
Спр - концентрация раствора, соответствующая точке поляризации; φ, χ - толщина и удельная электропроводность соответствующих мембран; λ - эквивалентная электропроводность раствора; T - температура.
Ранее указывалось, что при определенных условиях протекания электрохимического процесса, в т.ч. электродиализного, может возникнуть концентрационная поляризация появление которой связано с величиной плотности тока.
Возникновение концентрационной поляризации, т.е. критических условий, на границе раздела мембраны с раствором вследствие разности чисел переноса ионов в растворе и мембране определяют как
|
iкр |
= |
ZFD |
|
Спр |
(t-t)δкр |
(2.93)
где D - коэффициент диффузии (иона, электролита); t -t- разность чисел переноса Z - валентного иона в мембране и растворе соответственно; δ, φ - критическая толщина диффузного слоя.
Для упрощения дальнейших расчетов примем, что коэффициент диффузии D в пределах диффузионного слоя постоянный и равен коэффициенту молекулярной диффузии.
|
δкр = KL(D/v)1/3(Idq)0,25[v(l- |
h |
)]0,5·Vср-0,5, |
|
dq |
