
Plotnost_veschestv1 (1)
.doc
1. Плотность вещества — это плотность тел, состоящих из этого вещества. Отсюда вытекает и короткая формулировка определения плотности вещества: плотность вещества — это масса его единичного объёма. Пло́тность вещества́ определяется как отношение массы вещества m к занимаемому им объёму V p=m/v ( ро=эм/в)
.
2. Моль – это единица измерения количества вещества. (1 моль вещества - то количество вещества, в котором содержится молекул столько же, сколько в 12 граммах углерода)
3. Газ называется идеальным, у которого объемы молекул бесконечно малы и отсутствуют силы молекулярного взаимодействия. Молекулы идеального газа представляют собой материальные точки, взаимодействие между которыми ограничено молекулярными соударениями. Например, окружающий нас воздух можно считать идеальным газом.
.
4. Единица давления Паска́ль (обозначение: Па, международное: Pa) — единица измерения давления (механического напряжения) в Международной системе единиц (СИ). Паскаль равен давлению (механическому напряжению), вызываемому силой, равной одному ньютону, равномерно распределённой по нормальной к ней поверхностиплощадью один квадратный метр. (Р=F\S)
5. Реальный газ- это газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева. Зависимости между его параметрами показывают, что молекулы вреальном газе взаимодействуют между собой и занимают определенный объём.
6. Изохорный процесс описывается уравнением:
p\T= const
(Изохорный процесс, — это процесс, проходящий при постоянном объёме. При изохорном процессе меняются только давление газа и его температура)
7. Процесс называется адиабатическим, если он протекает: без теплообмена воздушной частицы с окружающей средой.
(Адиабатический процесс - термодинамический процесс, который осуществляется в системе без теплообмена с внешним миром.
Процесс можно считать адиабатическим, если он протекает настолько быстро, что теплообмен между системой и окружающей средой практически не происходит)
8. Первый закон термодинамики для изобарного процесса имеет вид:
p = const.
Подведённое к газу тепло идёт как на изменение внутренней энергии, так и на совершение работы- Q = U + A
9. В ходе какого процесса внутренняя энергия газа не изменяется?
В изотермическом процессе температура газа не изменяется, следовательно, не изменяется и внутренняя энергия газа, ΔU = 0.
10. Уравнение состояния идеального газа имеет вид:
![]()
Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
11. Процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре называют изотермическим. При постоянной массе газа pV = const.
Для газа данной массы произведение давления на его объем постоянно, если температура не меняется.
12. Адиабатический
процесс описывается уравнением: ![]() При
адиабатическом процессе показатель
адиабаты равен
При
адиабатическом процессе показатель
адиабаты равен
![]() .
.
13. Изобарический
процесс описывается уравнением: процесс
изменения состояния термодинамической
системы при постоянном давлении (![]() )
)
![]()
14. Изохорический
процесс описывается уравнением: процесс
изменения состояния термодинамической
системы при постоянном объёме (![]() ).
Для идеальных газов изохорический
процесс описывается законом
Шарля:
для данной массы газа при постоянном
объёме, давление прямо пропорционально
температуре:
).
Для идеальных газов изохорический
процесс описывается законом
Шарля:
для данной массы газа при постоянном
объёме, давление прямо пропорционально
температуре:
![]()
15. Адиабатическим называется процесс, протекающий: без теплообмена между термодинамической системой и окружающими ее внешними телами, т.е. система не получает и не отдает тепло.
16. Газовая постоянная связана с молярными теплоёмкостями соотношением:
молярная теплоёмкость идеального газа с i степенями свободы при постоянном объёме (для одного моля идеального газа) равна:
![]()
где R ≈ 8,31 Дж/(моль·К) — универсальная газовая постоянная.
А при постоянном давлении
![]()
17. Математическая
запись первого начала термодинамики:
![]()
или
![]() .
.
Это выражение представляет собой закон сохранения энергии в применении к макроскопическим системам и является математической формулировкой I-го начала термодинамики:
количество тепла, сообщенное системе, идет на приращение внутренней энергии системы и на совершение системой работы над внешними телами.
18. Молярная теплоемкость газа - это количество теплоты, необходимое для нагревания на 1 К 1 кг вещества.
19. Молекула водорода (Н2) движется быстрее молекулы водяного пара (Н2О) в: 16. Водород — самый лёгкий газ, он легче воздуха в 14,5 раз. Очевидно, что чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа
20. Количество молекул, содержащихся в ! г водорода Н2, (число Авогадро NA=6,021023 моль-1) равно: 1 моль газообразного водорода H2 содержит 6.02*10^23 молекул по определению количества вещества, и весит 2 грамма (потому что один атом водорода весит 1 грамм, находим это в таблице Менделеева. простая пропорция - если в 2 г содержится Na, то сколько содежится в 1? в два раза меньше
21. Количество вещества, содержащееся в ! г водорода Н2 равно: Если необходимо решить по формуле - то количество вещества находится так: n = m/M, где n - количество вещества (моль), m - масса (г), М - молярная масса (г/моль) Масса вещества везде одинакова - 1 г, остается вычислить молярную массу и подставить её в формулу. Например, количество вещества молекулярного водорода равно: n(H2) = m/M(H2) = 1 г : 2 г/моль = 0,5 моль
22.. Как изменится средняя кинетическая энергия теплового движения молекул идеального газа при увеличении абсолютной температуры газа в 3 раза? Е = (3/2)*k*T , значит 3 раза.
23. Как изменится давление идеального газа при увеличении концентрации его молекул в 3 раза, если средняя кинетическая энергия молекул остается неизменной?
Из первой формулы видно, давление не изменяется
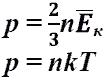
24. Какой формулой можно воспользоваться для нахождения КПД двигателя?
( Q1 - количество теплоты полученное от нагревателя, Q2 - отданное холодильнику).
Q1 – Q2 КПД = ———— · 100% Q1
Ап – полезная работа; Q1 – количество теплоты, полученное от нагревателя (общее количество теплоты); Q2 – количество теплоты, отданное холодильнику (атмосфере); Q1 – Q2 – количество теплоты, которое пошло на совершение работы (полезная часть теплоты).
25. Число степеней свободы молекулы углекислого газа (СО2) равно: 6
26. При постоянном давлении р0 объем газа V0 увеличили на 50%. Работа, совершенная при расширении газа, равна: А= 0,5p0V0
27. Газ, получив 1 МДж теплоты, увеличил внутреннюю энергию на 50кДж. Совершённая газом работа равна: А= 1,05 МДж
-
Температура нагревателя тепловой машины в 3 раза больше температуры холодильника. КПД такой машины составляет: 2\3
T2-температурахолодильника T1-температуранагревателя поусл.T1=3*T2 КПД=(T1-T2)/T1 или КПД=((3*T2)-T2)/3*T2=2/3
-
Тепловая машина с температурой нагревателя 227 С и температурой холодильника 27 С может иметь максимальное значение КПД, равное: кпд=(227+273)-(27+273)\227+273=0, 40*100%=40%
30. Газу сообщили 1 кДж теплоты. Его внутренняя энергия увеличилась при этом на 30 кДж. Работа, совершенная газом, равна: Q=U+A
A=Q-U A= 1000Дж- 30000Дж=29кДж
31. Определите температуру нагревателя, если температура холодильника 375 К, КПД тепловой машины 1%.
КПД=Т1-Т2\Т1
1%=Т1-Т2\Т1
0,01Т1=Т1-Т2
Т2=Т1-0.01Т1
0,99Т1=375 К
Т1= 375\0,99
Т1=378,79 К
32. Идеальный газ получил от нагревателя 60 кДж теплоты при температуре 3270С. Температура холодильника 1 С. Полезная работа, совершенная тепловым двигателем, равна:
Т1=327+273=600 К
Т2=1+273=274 К
КПД=Т1-Т2\Т1 КПД=600-274\600=0,54*100%=54%
КПД
тепловой машины связано с количеством
теплоты, полученным от нагревателя, и
полезной работой за цикл соотношением ![]() .
Отсюда находим работу, которую машина
совершает за цикл:
.
Отсюда находим работу, которую машина
совершает за цикл:
А=КПД\100%*Q1=54%\100%*60000=3240Дж
33. Газ получил количество теплоты 500 Дж и совершил работу 200 Дж. Изменение внутренней энергии газа равно:
Q=A+U
U=Q-A= 500-200= 300Дж
34. 2моля углекислого газа находятся при температуре 227оС; R=8,31Дж/(мольК). Внутренняя энергия газа равна: U=12465Дж U=2\3*m\M*RT
35. Азот массой 10 г находится при температуре Т = 290 К. Средняя кинетическая энергия вращательного движения молекул азота равна: (Газ считать идеальным, NA = 6,02.1023 моль-1). Е=860 Дж
36. Водород Н2 массой 2 кг при 0 С и давлении 105 Па занимает объем: 22,68 м3
37. При постоянной температуре объем идеального газа увеличился в 2 раза. Его давление: уменьшится в 2 раза
38. Концентрация молекул идеального газа при давлении 2,76105 Па и температуре 270С равна: (k=1,3810-23Дж/моль)
Р=пкт
п=р\кТ п= 6,7*1025м-3
39. В сосуде находится 3 моля водорода. Сколько примерно атомов водорода находится в сосуде? N=18,06*1023
40. Какой термодинамической температуре соответствует 870С?
Т=С+273=87+273=360 К
41. При уменьшении объема газа в 1 раза его абсолютная температура повысилась на 25%. Как изменилось давление газа? Давление увеличивается.
42. Средняя кинетическая энергия поступательного движения молекул азота при температуре 200 К равна: (k=1,3810-23Дж/моль)
43. Определите массу одной молекулы, если молярная масса = 1810-3 кг/моль.
( NA = 6,02.1023моль-1 ) m= M\Na m=2,99*10-23=3*10-23 кг
44. Средняя кинетическая энергия идеального газа при повышении его температуры в 2 раза:
эта энергия связана с температурой соотношением E=3/2*kT, т.е. прямо пропорциональна температуре, повышается в 2 раза
45. В сосуде вместимостью 1 л находится кислород массой 1г. Концентрация молекул кислорода равна: 1013см-3.
46. Количество молекул, содержащихся в 1 г водяного пара равно: (NA = 6,023.1023 моль-1) N=Na*m\M N= 0,33*1023=3,3*1022
47. Плотность водорода при температуре 270С и давлении 100 кПа равна:
0,08 кг/м3
48. Температуру идеального газа увеличили в ! раза. Средняя квадратичная скорость молекул:
![]() они в прямопропорциональном отношении
они в прямопропорциональном отношении
49. Укажите неправильное утверждение:
А. При обратимых процессах энтропия системы убывает.
В. При переходе системы в более вероятной состояние её энтропия
возрастает.
С. Энтропия системы и термодинамическая вероятность связаны
соотношением: S=k.lnW
D. Энтропия является мерой неупорядоченности системы
E. Все приведенные выше ответы правильные.
Неправильное А
50. Внутренняя энергия 1 моля идеального одноатомного газа при 270С равна:
( k = 1,38.1023) Внутренняя энергия одноатомного газа - это кинетическая энергия поступательного движения (теплового) на одну молекулу приходится в среднем 3/2 kT (по 1/2kT на каждую степень свободы) на один моль 3/2 RT
Е= 3/2 RT Е= 3\2*8,31*300 К=3739,5Дж=3,74кДж
51. Энергия приходящаяся на одну степень свободы молекулы водяного пара Н2О при 100 К, равна:
![]()
Е1= 106,9-22Дж
