
- •1 Вопрос. Содержание белков в органах и тканях.Функции белков в организме.
- •Вопрос 2.Роль белков в питании. Факторы,определяющие пищевую ценность белков.
- •Вопрос 3. Азотистый баланс организма.
- •4 Вопрос. Коэффициент изнашивания, физиологический минимум белка,нормы белка в питании.
- •Вопрос 5. Переваривание белков в желудке и кишечнике: протеиназы желудочного сока и тонкого кишечника,оптимальные условия и спецефичность их действия
- •Вопрос 6. Всасывание продуктов переваривания белков
- •Вопрос 7. Механизм гниения белков в кишечнике и обезвреживание продуктов гниеня
- •Вопрос 8. Аминокислотный пул организма
- •Вопрос 9. Трансаминирование, его биологическая роль
- •Вопрос 10.Дезаминирование а/к
- •Вопрос 11.Трансдезаминирование а/к
Вопрос 8. Аминокислотный пул организма
В жидкой среде организма постоянно имеется определенное количество свободных аминокислот. Они образуют аминокислотный пул. Для человека массой 70 кг величина этого пула - 30 гр.
Этот пул всегда пополняется за счет трех основных процессов.
всасывание или поступление аминокислот из кишечника - так называемые пищевые а/к
распад тканевых белков
синтез заменимых аминокислот.
Если речь касается пула отдельной аминокислоты то вы должны определить заменимая это аминокислота или нет. Если незаменимая, то только 2 источника.
Аминокислоты постоянно изымаются из пула для использования в самых различных метаболических процессах, что можно отразить на схеме.
Пищевые АК Распад тканевых белков Синтез АК
Синтез белков Окислительный распад
Аминокислотный пул
Синтез полипептидов АцетилКоА пурины, пиримидины Превращение в углеводы и липиды
гормоны, холин, креатин, таурин
Несомненно, что большее количество аминокислот из пула изымается на синтез белков.
Второй путь использования ам. к. это окислительный распад до конечных продуктов. Около 100 гр распадается, обеспечивая 10-15 % необходимой энергии для жизнедеятельности человека.
Третий путь использование - синтез из ам.к. углеводов и липидов. Глюконеогенез идет достаточно интенсивно.
Четвертый путь - синтез других азотосодержащих соединений (креатин, холин, сфингозин, гем).
Синтез азотистых оснований нуклеотидов
Синтез биогенных аминов
Синтез других аминокислот за счет реакции трансаминирования
Синтез гормонов - производных аминокислот
Вопрос 9. Трансаминирование, его биологическая роль
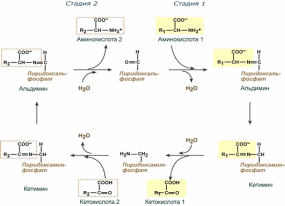
Механизм реакции трансаминирования непрост и протекает по типу "пинг-понг". Катализируют реакцию ферменты аминотрансферазы, Они являются сложными ферментами, в качестве кофермента имеют пиридоксальфосфат (активная форма витамина В6).
пролина, лизина, треонина, которые не подвергаются трансаминированию.
Весь перенос аминогруппы совершается в две стадии:
к пиридоксальфосфату сначала присоединяется первая а/к, отдает аминогруппу, превращается в кетокислоту и отделяется. Аминогруппа при этом переходит на кофермент и образуется пиридоксаминфосфат.
на второй стадии к пиридоксаминфосфату присоединяется другая кетокислота, получает аминогруппу, образуется новая а/к и пиридоксальфосфат регенерирует.
Роль и превращение пиридоксальфосфата сводится к образованию промежуточных соединений – шиффовых оснований (альдимин и кетимин). В первой реакции после отщепления воды образуется иминовая связь между остатком аминокислоты и пиридоксальфосфатом. Полученное соединение называется альдимин. Перемещение двойной связи приводит к образованию кетимина, который гидролизуется по месту двойной связи. От фермента отщепляется готовый продукт – кетокислота.
После отщепления кетокислоты к комплексу пиридоксамин-фермент присоединяется новая кетокислота и процесс идет в обратном порядке: образуется кетимин, затем альдимин, после чего отделяется новая аминокислота.
Чаще всего аминокислоты взаимодействуют со следующими кетокислотами:
пировиноградной с образованием аланина,
щавелевоуксусной с образованием аспартата,
α-кетоглутаровой с образованием глутамата.
Однако аланин и аспартат в дальнейшем все равно передают свою аминогруппу на α-кетоглутаровую кислоту. Таким образом, в тканях осуществляется поток избыточных аминогрупп на один общий акцептор – α-кетоглутаровую кислоту. В итоге образуется большое количество глутаминовой кислоты.
Далее глутаминовая кислота может вовлекается в процессы связывания аммиака (синтез глутамина) либо в прямое окислительное дезаминирование.
