
книги / Общая химическая технология
..pdf2.4. Термодинамический анализ сложного химического равновесия
Химические превращения в промышленных реакторах часто сопровождаются протеканием нескольких последовательных или параллельных реакций. Одновременное протекание нескольких химических реакций влияет на равновесный состав газовой смеси. При этом условия проведения процесса (исходный состав газа, температура, давление) могут по-разному влиять на полноту и выход продуктов каждой реакции. Для того чтобы учесть взаимное влияние реакций на равновесие в газовой системе, необходимо провести термодинамический расчет сложного химического равновесия. Для этого из всей совокупности реакций выбирают две или более независимые основные реакции, исключая реакции, равновесие которых полностью сдвинуто вправо или влево.
Методика термодинамического расчета сложного равновесия состоит из следующих операций:
1.Рассчитывают значения термодинамических констант равновесия для каждой реакции в выбранном интервале температур.
2.Задают исходный состав газовой смеси и выражают равновесный состав через исходный состав, обозначив количество прореагировавших реагентов или образовавшихся продуктов к моменту равновесия для каждой реакции через неизвестные величины x, y, z и т. д. В этом случае с использованием неизвестных равновесный состав газа может быть выражен в мольных долях, а после умножения
на общее давление смеси Робщ получают равновесное давление каждого газового компонента.
3.Записывают выражения для констант равновесия каждой реакции через равновесные парциальные давления с использованием введенных неизвестных величин и приравнивают их рассчитанным ранее численным значениям констант равновесия при соответствующей температуре.
4.Решают полученную систему уравнений и определяют неизвестные значения x, y, z и т. д., что позволит рассчитать равновесный состав газовой смеси.
41
2.5. Термодинамический анализ процесса конверсии метана водяным паром
Впроизводстве водорода для синтеза аммиака используют метан
иводяной пар с заданным мольным соотношением Н2О/СН4, равным n. В газовой смеси протекают две последовательные реакции:
СН4 |
+ Н2 |
О = 3Н2 + СО; |
(1) |
СО |
+ Н2 |
О = Н2 + СО2 . |
(2) |
Для расчета констант равновесия выбираем интервал температур 673–1273 К с шагом 200 К. Значения констант равновесия реакций (1) и (2) рассчитываем по формулам, приведенным в литературе [1]:
lg Kp1 9874T 7,14 lgT 1,88 10 3 T 0,094 10 6 T 2 8,64, (2.9)
lg Kp2 |
|
2203,24 |
5,1588 10 5 T |
|
|
|
T |
|
|
2,5426 10 7 T 2 7,4617 10 11 T 3 2,3. |
(2.10) |
|||
Принимаем, что на один моль метана в исходном газе приходится n моль водяного пара. После установления равновесия прореагировало x моль метана по реакции (1) и y моль СО по реакции (2). Изменение состава газовой смеси при протекании реакций (1) и (2) рассчитываем в соответствии со стехиометрическими коэффициентами. Количество исчезающих (прореагировавших) реагентов берем со знаком (–), а количество образующихся продуктов со знаком (+). Расчет равновесного состава приведен в табл. 2.7.
Используя выражения для равновесных парциальных давлений из табл. 2.7, можно записать уравнения для констант равновесия ре-
акций (1) и (2):
K |
|
|
pH3 |
pCO |
|
P2 (3x y)3 (x y) |
; |
(2.11) |
|||
р1 |
2 |
|
|
|
|
||||||
p p |
(1 n |
2x)2 |
(1 x)(n x y) |
||||||||
|
|
|
|
|
|||||||
|
|
|
CH4 |
H2O |
|
|
|
|
|
|
|
42
Таблица 2.7
Расчет равновесного состава газовой смеси при конверсии метана водяным паром
|
Вещество |
Исходный |
Изменение |
Изменение |
Равновесный |
Равновесный |
Равновесные |
||||||||||
|
состава по ре- |
состава по рек- |
состав, мольные |
парциальные |
|||||||||||||
|
состав, моль |
состав, моль |
|||||||||||||||
|
|
|
акции (1), моль |
ции (2), моль |
|
|
доли |
давления, атм |
|||||||||
|
СН4 |
1 |
–х |
– |
1 – х |
|
1 x |
|
|
|
|
P(1 x) |
|||||
|
|
|
|
|
|
|
1 n 2x |
|
|
|
|
1 n 2x |
|
|
|
||
|
Н2О |
n |
–х |
–y |
n – x – y |
|
n x y |
|
P(n x y) |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
1 n 2x |
|
|||
43 |
|
|
|
|
|
1 n 2x |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СО |
– |
+х |
–y |
x – y |
|
x y |
|
|
|
|
P(x y) |
||||||
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
1 n 2x |
|
|
|
|
1 n 2x |
|||||
|
Н2 |
– |
+3х |
+y |
3x + y |
|
3x y |
|
|
P(3x y) |
|||||||
|
|
|
|
|
|
|
1 n 2x |
|
|
|
1 n 2x |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
СО2 |
– |
– |
+y |
y |
|
y |
|
|
|
|
Py |
|||||
|
|
|
|
|
|
|
1 n 2x |
|
|
|
|
|
1 n 2x |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
Сумма |
1 + n |
+2х |
– |
1 + n + 2x |
1 |
|
|
|
|
|
P |
|||||

Kр2 |
|
pH2 |
pCO2 |
|
(3x y) y |
. |
(2.12) |
|
pCO |
pH 2 O |
(x y)(n x y) |
||||||
|
|
|
|
|
Далее нужно найти численные значения констант по формулам (2.9) и (2.10) при заданных температурах.
Чтобы решить систему из двух уравнений с двумя неизвестными, необходимо задать состав исходной газовой смеси соотношением Н2О / СН4, равным n.
Необходимо учитывать пределы изменения неизвестных 0 < x < 1, 0 < y < x. Степень превращения метана αCH4 x , степень
превращения оксида углерода αСО = y / x.
Результаты решения системы уравнений приведены в табл. 2.8. Таблица 2.8
Зависимость константы равновесия от температуры
Температу- |
lg Kp1 |
lg Kp2 |
Kp1 |
Kp2 |
x |
y |
ра, К |
|
|
|
|
|
|
673 |
-4,34226 |
1,100895 |
4,54719E-05 |
12,61522 |
0,190463 |
0,1862 |
873 |
-0,52118 |
0,412927 |
0,301174363 |
2,587777 |
0,69033 |
0,226552 |
1073 |
1,88723 |
0,009257 |
77,13122366 |
1,021543 |
0,994889 |
0,177778 |
1273 |
3,531084 |
-0,24548 |
3396,907915 |
0,568229 |
0,99998 |
0,000001 |
С использованием данных табл. 2.7 и 2.8 рассчитывают равновесный состав газовой смеси (табл. 2.9).
Таблица 2.9 Равновесный состав газовой смеси при различных температурах
Температу- |
Равновесный состав газовой смеси, мол. % |
||||
ра, К |
СН4 |
Н2О |
СО |
Н2 |
СО2 |
673 |
0,184787 |
0,598809 |
0,000973 |
0,172929 |
0,042503 |
873 |
0,057552 |
0,387149 |
0,086194 |
0,427 |
0,042105 |
1073 |
0,000853 |
0,305075 |
0,136418 |
0,527974 |
0,02968 |
1273 |
3,35E-06 |
0,333333 |
0,333333 |
0,500000 |
0,000001 |
44
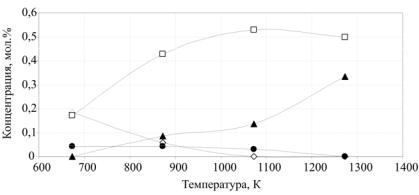
Рис. 2.3. Изменение состава газовой смеси в зависимости от температуры:
 – СH4;
– СH4;  – CO;
– CO;  – H2;
– H2;  – CO2
– CO2
По данным табл. 2.9 строят графическую зависимость изменения равновесного состава газовой смеси от температуры (рис. 2.3).
2.6. Задачи для самостоятельного термодинамического анализа процессов
В соответствии с заданным вариантом исходных данных выполнить следующие задания:
1.Вывести уравнение для расчета равновесного состава газовой смеси при заданном исходном составе с учетом общего давления в системе.
2.Определить наиболее приемлемый интервал температур протекания реакции, рассчитать значения константы равновесия в выбранном интервале температур.
3.Рассчитать равновесный состав газовой смеси и определить
равновесную степень превращения или равновесный выход продукта в зависимости от варьируемого параметра (исходного состава газа, температуры, давления). Результаты расчета привести в виде таблиц.
4. Используя данные таблиц, построить графические зависимости равновесной степени превращения (равновесного выхода) от состава газовой смеси, температуры, давления. Путем анализа полу-
45
ченных зависимостей выявить условия наиболее полного протекания процесса.
5. По данным термодинамического анализа дать рекомендации по оптимизации технологического режима процесса.
Варианты исходных данных 1. В воздухе протекает реакция:
N2 + O2 = 2NO.
2. В газовоздушной смеси протекает реакция: N2O4 = 2NO2.
Смесь содержит 10 об. % N2O4.
3. Синтез аммиака из газовой смеси проводят по реакции: N2 + 3H2 = 2NH3.
Смесь содержит 4 об. % NH3, остальное составляют азот и водород в соотношении H2 и N2, равном 3.
4. Конверсияметанавгазовойсмесиосуществляетсяпореакции: CH4 + H2O = 3 H2 + CO.
Мольное соотношение H2O/CH4 равно 4.
5. Конверсия углекислого газа проводится по реакции: CO + H2O = H2 + CO2.
На конверсию с водяным паром поступает газ, содержащий
(об. %): CO – 34, CO2 – 6, H2 – 37, N2 – 22, CH4 – 1. Мольное соот-
ношение H2O/CO равно 3.
6. Очистка азотоводородной смеси от CO2 метанированием проводится по реакции:
CO2 + 4 H2 = CH4 + 2 H2O.
Исходная азотоводородная смесь содержит 12 об. % CO2. Мольное отношение азота к водороду составляет 1:3.
7. Производство сульфурилхлорида осуществляется по реакции: SO2 + Cl2 = SO2Cl2.
46
Мольное соотношение в исходном газе Cl2/SO2 равно 0,5.
8. При получении фосгена в газовой смеси протекает реакция: CO + Cl2 = COCl2.
Мольное соотношение CO/Cl2 равно 1,5.
9. В производстве хлора по методу Дикона идет реакция:
4 HCl + O2 = 2 Cl2 + 2 H2O.
Газовая смесь содержит 25 об. % HCl и 75 об. % воздуха. 10. В производстве азотной кислоты протекает реакция:
2NO + O2 = 2NO2.
Исходная газовоздушная смесь содержит 10 об.% NO. 11. Получение метанола осуществляют по реакции:
CH4 + 1/2 O2 = CH3OH.
Соотношение исходных реагентов стехиометрическое. 12. В производстве этанола происходит реакция:
C2H4 + H2O = C2H5OH.
Мольное соотношение H2O/C2H4 равно 1,5.
13. В производстве оксида этилена протекает реакция:
C2H4 + 1/2 O2 = C2H4O.
В качестве окислителя используется кислород воздуха в стехиометрическом соотношении.
14. В производстве метанола идет реакция:
CO + 2 H2 = CH3OH.
Соотношение исходных реагентов стехиометрическое, но в газовой смеси содержится 4 об. % CH3OH.
15. При производстве ацетилена из чистого метана протекает реакция:
2CH4 = C2H2 + 3 H2.
16.В производстве метанола протекает реакция:
CO2 + 3 H2 = CH3OH + H2O.
Мольное соотношение реагентов H2/CO2 равно 3, т.е. стехиометрическое.
47
17. Очистка азотоводородной смеси от СО метанированием проводится по реакции:
CO + 3 H2 = CH4 + H2O.
Исходная газовая смесь содержит 8 об. % СО, остальное составляют азот и водород в соотношении 1:3.
18. В производстве брома протекает реакция:
2 HBr + 1/2 O2 = Br2 + H2O.
Газовоздушная смесь содержит 10 об. % HBr.
19.Для очистки природного метана, содержащего 10 об. % CS2,
кнему добавляют водород в соотношении H2/CS2, равном 4,2. Протекает реакция:
CS2 + 4 H2 = CH4 + 2 H2S.
20. Очистка природного метана, содержащего 10 об. % COS, осуществляется путем добавления к газу 50%-ного избытка водорода в соответствии с реакцией:
COS + H2 = H2S + CO.
21. Генераторный газ, имеющий состав (об.%): CO – 36, CO2 – 46, SO2 – 18, используют для получения газовой серы по реакции:
SO2 + 2 CO = 1/2 S2 (г) + 2 CO2.
48
Список рекомендуемой литературы
1.Расчеты химико-технологических процессов / под ред. проф. И.П. Мухленова. – Л.: Химия, 1982. – 247 с.
2.Краткий справочник физико-химических величин / под ред. А.А. Равделя и А.А. Пономаревой. – Л.: Химия, 1983. – 232 с.
3.Карапетьянц М.Х., Карапетьянц М.Л. Основные термодинамические константы неорганических и органических веществ. –
М.: Химия, 1968. – 467 с.
4.Расчеты по технологии неорганических веществ / М.Е. По-
зин [и др.]. – М.: Химия, 1966. – 639 с.
5.Расчеты по технологии неорганических веществ / под ред. П.В. Дыбиной. – М.: Высшая школа, 1967. – 522 с.
6.Бесков С.Д. Технохимические расчеты. – М.: Химия, 1966. –
467 с.
7.Павлов К.Ф., Романков П.Г., Носков А.А. Примеры и задачи по курсу процессов и аппаратов химической технологии. – Л.: Хи-
мия, 1987. – 575 с.
8.Рамм В.М. Абсорбция газов. – М.: Химия, 1976. – 654 с.
9.Справочник химика: в 7 т. / под ред. Б.П. Никольского. – М.;
Л.: Химия, 1964. – Т. 3. – 1005 с.
10.Даниэльс Ф., Альберти Р. Физическая химия. – М.: Высшая школа, 1967. – 783 с.
11.Амирова С.А., Островский С.В. Основы теоретического анализа химико-технологических процессов: в 2 ч. – Екатеринбург: Изд-
во УрО РАН, 1992. – Ч. 1. – 183 с.
12.Широков Ю.Г. Теоретические основы технологии неорганических веществ / Ивановский химико-технологический универси-
тет. – Иваново, 2000. – 336 с.
13.Казанская А.С., Скобло В.А. Расчеты химических равновесий. – М.: Высшая школа, 1974. – 288 с.
14.Широков Ю.Г., Смирнов Н.Н., Прокофьев В.Ю. Теоретические основы технологии неорганических веществ: сб. лабораторных работ с применением ЭВМ / Ивановский химико-технологический университет. – Иваново, 1999. – 116 с.
49

Учебное издание
Федотова Ольга Александровна, Кобелева Асия Рифовна, Тюленева Галина Евгеньевна
ОБЩАЯ ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ
Учебно-методическое пособие
Редактор и корректор Е.В. Копытина
Подписано в печать 4.10.2019. Формат 60×90/16. Усл. печ. л. 3,25. Тираж 43 экз. Заказ № 166/2019.
Издательство Пермского национального исследовательского
политехнического университета.
Адрес: 614990, г. Пермь, Комсомольский проспект, 29, к. 113.
Тел. (342) 219-80-33.
50
