
- •1. Классы химических соединений
- •1.1. Оксиды
- •1.2. Гидроксиды
- •1.3. Соли
- •Домашнее задание № 1 Тема: Классы химических соединений
- •2. Электролиты
- •Тема: Электролиты
- •3. Гидролиз солей
- •3.1. Соли, образованные сильной кислотой и слабым основанием
- •3.2. Соли, образованные слабой кислотой и сильным основанием
- •4. Окислительно-восстановительные реакции (овр)
- •4.1. Степень окисления. Окислители и восстановители
- •4.2. Составление уравнений окислительно-восстановительных реакций
- •4.3. Взаимодействие металлов с растворами кислот
- •4.4. Взаимодействие металлов с водой
- •4.5. Взаимодействие металлов с водными растворами щелочей
- •Домашнее задание № 4 Тема: Окислительно-восстановительные реакции
- •5.Коррозия металлов
- •Домашнее задание № 5 Тема: Коррозия металлов
- •Примерный вариант итогового тестового задания. Часть а.
- •Часть в.
- •Часть с.
- •Часть в.
- •Часть с.
- •Методические указания
- •Неволина Ольга Алексеевна
4.4. Взаимодействие металлов с водой
При взаимодействии металлов с водой вода является окислителем, а металл – восстановителем. Возможность взаимодействия, как и для любой ОВР, определяется условием ок восст. 0.
Стандартные окислительно-восстановительные потенциалы ряда металлов, кислорода и водорода в разных средах приведены в таблице –см. приложение 5.
При рассмотрении возможности реакции металла с водой необходимо учитывать не только разность потенциалов окислителя и восстановителя, но и характер образующегося продукта.
Пример. Рассмотреть устойчивость к воде алюминия.
Сравниваем потенциалы металла и водорода в нейтральной среде(см. приложение 5):
02H2O/H2= 0,41 B, 0Al(OH)3/Al = 1,88 B;
= 0,41 ( 1,88) = 1,47 B 0.
Таким образом, условие взаимодействия выполняется. Записываем уравнение реакции:
2
Al
3e
+ 3H2O
Al(OH)3
+ 3H+
3
2H2O
+ 2e
H2
+ 2OH
2Al
+ 6H2O
+ 6H2O
2Al(OH)3
+ 6H+
+ 6OH
+ 3H2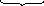
6H2O
Молекулярное уравнение:
2 Al + 6H2O = 2Al(OH)3 + 3H2.
Образовавшаяся пленка нерастворимого гидроксида Al(OH)3 плотно прилегает к поверхности металла, защищая его от дальнейшего окисления. Следовательно, алюминий устойчив по отношению к воде. Вследствие образования нерастворимых гидроксидов не реагируют с водой цинк, хром, никель, титан и ряд других металлов.
Практически в воде растворяются только щелочные и щелочноземельные металлы (Li…Fr, Ca…Ra).
4.5. Взаимодействие металлов с водными растворами щелочей
При взаимодействии металлов с растворами щелочей металл также является восстановителем, вода – окислителем, щелочь создает среду.
Стандартный потенциал восстановления водорода (из молекулы воды) в щелочной среде составляет 0,83 В(см.приложение 5). В соответствии с этим теоретически реагировать с растворами щелочей могут все металлы, потенциалы которых меньше 0,83 В. Однако в действительности в щелочных средах окисляются только металлы, оксиды и гидроксиды которых являются амфотерными – алюминий, цинк, олово, хром, свинец и др (см.пункты 1.1 и 1.2.3). Металлы, образующие нерастворимые основные гидроксиды, в водных растворах щелочей не окисляются.
Пример. Рассмотрим поведение хрома в растворе гидроксида натрия NaOH.
Стандартный потенциал хрома в щелочной среде ниже потенциала водорода(см.приложение 5):
0CrO2
/Cr
=
1,88
B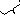
0CrO2 /Cr < 0 2H2O/H2.
0 2H2O/H2 = 0,83 B
Реакция теоретически возможна, и она осуществляется на практике, т.к. гидроксид хрома амфотерен и растворяется в щелочах с образованием растворимых хромитов MeCrO2.
Уравнение реакции:
2 Cr0 + 4 OH 3e CrO2 + 2H2O
3 2H2O + 2e H2 + 2OH
2Cr + 8OH + 6H2O 2CrO2 + 4H2O + 3H2 + 6OH
2Cr + 2OH + 2H2O 2CrO2 + 3H2
2Cr + 2NaOH + 2H2O 2NaCrO2 + 3H2.
