
10.Термодинамика.
Термодинамические параметры состояния газа: 1.Давление. 2.Объем. 3.Моль.4.Число Авогадро. 5.Малярная масса.
Объединенный газовый закон:
 /T=const
/T=const
11. Изотермический процесс -процесс, протекающий при постоянной температуре (T=const). Из-ий.пр описывает закон Бойля-Мариотта. з. Бойля-Мариотта: для данной массы газа при постоянной t произведения давления газа на его объем есть величина постоянная. pV=const
 =
=
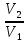 12.
Изохорный процесс.
-процесс,
протекающий при постоянном объеме
(V=const). Из.пр описывает открытый в 1782г
з.Шарля.
З.
Шарля:
давление данной массы газа при постоянном
объеме изменяется с температурой
линейно:
12.
Изохорный процесс.
-процесс,
протекающий при постоянном объеме
(V=const). Из.пр описывает открытый в 1782г
з.Шарля.
З.
Шарля:
давление данной массы газа при постоянном
объеме изменяется с температурой
линейно:
P= dT
(V=const; m=const)
dT
(V=const; m=const)
 =
=

13.
Изобарнный процесс.
-процесс,
протекающий при постоянном давлении
(p=const). Из-ый пр. описывает з. Гей-Люссака.
з.
Гей-Люссака: объем
данной массы газа при постоянном давлении
линейно изменяется с температурой.
V= lt
(p=const; m=const)
lt
(p=const; m=const)
14.
Адиабатный процесс.
-процесс,
происходящий в термодинамической
системе при отсутствии теплообмена с
окр.средой, т.е при отсутствии Q=0.
Процесс
можно считать адиабатным, если он
происходит настолько быстро, что
теплообмен между системой и окр.средой
не успевает произойти.
При
адиабатном расширении (A>0) температура
газа расширяется т.к
U
=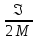 R
T<0
R
T<0
А
при адиабатном сжатии (A<0) температура
газа повышается, поскольку U>0.
Работа
газа при а-м расширении от объема V, от
объема V2:
A=
- U
= R(
R( -
- )
l-число
степеней свободы
M/m
-кол-во вещ-ва
R-малярная
газовая постоянная
T1
и T2-температура в начале и конце процесса
)
l-число
степеней свободы
M/m
-кол-во вещ-ва
R-малярная
газовая постоянная
T1
и T2-температура в начале и конце процесса
15. Работа газа при его расширении. A = p V Работа совершаемая газом при изобарном процессе равна произведению давления газа на изменение его объема, справедлива формула при любом изменении объема твердых, жидких и газообразных тел.
16. Внутренняя энергия тела. Внутренняя энергия термодинамической системы - энергия частично(теплового) движения микро-частиц системы (молекул, атомов) и энергия взаимодействия частиц. Внутр.эн.т-ой системы может измениться только в следствие ее взаимодействия с др.телами(внешней среды). Например:механическая работа и теплообмен. Теплообмен в свою очередь осуществляется 3 способами: 1. Теплопроводность 2. Конвенция 3. Температурное излучение. Внутр.э. идеального газа зависит только от термодинамической системы.
17. Первое начало термодинамики. -теплота, сообщаемая системе, расходится не изменяя ее внутренней энергии и на соврешение его работы против внешних сил.
18.
Теплота
Кол-во
теплоты
- энергия которую получает или теряет
тепло во время теплообмена с
окр.средой.
Удельная
теплоемкость вещ-ва
- величина, показывающая какое кол-во
теплоты необходимо для нагревания 1 кг
вещ-ва на 1К.
C= Уравнение
теплового баланса, выражает закон
сохранения и превращения энергии для
рассматриваемых процессов.
Уравнение
теплового баланса, выражает закон
сохранения и превращения энергии для
рассматриваемых процессов.
 +
+ =0
=0
19.Подсчет теплоты.
|
|
19. Удельная теплота сгорания, т.е. количество теплоты, которая выделяется при полном сгорания 1 кг топлива, обозначают буквой q.
[Q]- Дж / кг. Количество теплоты, выделяющейся при сгорании произвольной массы топлива, определяется по формуле: Q = qm где Q - теплота сгорания, m - масса.
20. Сохранение энергии. Закон сохранения механического энергии: полная механическая энергия замкнутой системы тел, между которыми действует только консервативные силы, сохраняются, т.е не изменяются с течением времени. Закон сохранения тепловой энергии: изменение внутренней энергии термодинамической системы при переходе ее из одного состояния в другое равно сумме работы внешних сил над системой и кол-во теплоты передано ого системе, и не зависит от способа, которым осуществляется этот переход.
21. Тепловой двигатель. -циклически действующий двигатель, совершающий работу за счет полученной извне теплоты. В тепловых двигателях используется прямой цикл. От нагревателя за цикл отнимается кол-во теплоты Q1, а холодильнике передается за цикл кол-во теплоты Q2, при этом совершается работа A=Q1-Q2. КПД теплового двигателя - отношение работы A, совершённой двигателем за цикл, к кол-ву теплоты Q1, подученному от нагревателя.
n= =
=
 КПД<1
КПД<1
22. Испарение и конденсация. Испарение- парообразование происходящее при любой t со свободной поверхности жидкости. Испарение объясняется тем, что как в жидкости так и в твердых телах всегда имеется некоторое кол-во молекул, кинетическая энергия теплового движения которых достаточна для преодоления потенциальной энергии взаимодействия молекул, а они могут оторваться от жидкости и перейти в окр.пространство. Конденсация - процесс обратный парообразованию(испарению). Конденсация происходит с выделеним энергии. Если число молекул покидающих жидкость за единицу времени через единицу поверхности равно числу молекул, переходящих из пара в жидкость, то наступает динамическое равновесие между процессами испарения и конденсации. Идеальная теплота парообразования- кол-во теплоты, необходимое для превращения в пар 1кг жидкости при постоянной t.
[Q]=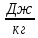
23.
Насыщенный пар.
Пар,
находящийся в состоянии термодинамического
равновесия со своей жидкостью называют,
насыщенным.
Пар
называется насыщенным, если при данной
температуре его давления меньше давления
напыщенного пара. (p< )
)
24. Кипение. -парообразование, которое происходит не только со свободной поверхности, но и внутри самой жидкости. Чем меньше жидкости тем ниже температура кипения и наоборот.
25.
Влажность воздуха.
Абсолютная
влажность-масса
водяных паров содержащихся в 1м3 воздухе
при данных условиях. Значение абсолютной
влажности оценивается по плотности
водяных паров в воздухе.
Относительная
влажность
- выраженное в процентах отношение
пропорционального давления p водяного
пара, содержащегося в воздухе при данной
температуре к давлению
 насыщен
него пара при той же температуре.
насыщен
него пара при той же температуре.
u= *100%
*100%
Точка росы - Температура при которой находящийся в воздухе водяной пар становится насыщенным.
Изменяется влажность в помощью: гигрометров и психрометров. 26. Жидкость. Жидкое состояние - жидкие вещ-ва стремятся сохранить объем, но не сохраняют форму, но их относительные положения не фиксированы и она медленно меняют положение относительно друг друга. Основные признаки жидкости: 1. Текучесть (обусловлена возможностью перемещения молекул относительно друг друга). 2. Сохранение объема (форма жидкого тела обуславливаются формой сосуда, в котором жидкость находится).
27.
Поверхностный слой жидкости.
Сила
поверхностного натяжения
- сила, направленная по касательной к
поверхности жидкости перпендикулярно
участку контура, на который она действует,
и стремящаяся сократить поверхность
до минимума.
Поверхностное
натяжение
определяется силой поверх. натяж,
приходящейся на единицу длинны контура,
ограничивающего поверхность:
G= [G]
=
[G]
=
l-длинна контура, огранич. поверхности жидкости.
28. Смачивание. -искривление свободной поверхности жидкости у поверхности твердого тела. Капиллярные явления- изменение высоты уровня жидкости в капиллярах. В природе на капиллярах завязано снабжение кровью, кислородом и водой тканей животных и растительных организмов.
29,30. Кристаллы. Кристаллические тела -твёрдые тела хар-ся упорядоченным движением и повторяющимися по всему объему расположен тем частиц. 1. Монокристаллы(тв.тела представляющие собой кристаллы с одной упорядоченной крист. решеткой). 2. Поликристаллы (обладают мелкокристаллической структурой). Анизотропия- различие физ. св-в монокристаллов в разных направлениях. Дефекты в кристаллах представляют из себя отклонения от упорядоченного расположения частиц в узлах решетки.
