
- •Методичний посібник
- •З курсу хімії
- •Для студентів заочного відділення
- •Миколаїв 2001
- •1.3. Розв’язок типових задач з елементарної хімії ...................................23
- •Передмова
- •Програма з хімії для заочного відділення
- •2. Загальні закономірності перебігу хімічних ппроцесів
- •3. Розчини
- •4. Окиснювально-відновні та електрохімічні процеси
- •5. Корозія і захист металів
- •6. Загальна характеристика металів та їх сполук
- •Розділ 1. Основи хімічних знань
- •1.1. Основні хімічні поняття
- •1.2. Класи неорганічних сполук
- •S Сульфур сірка
- •Кислоти Кислотами називаються речовини, які при електролітичній дисоціації з катіонів утворюють тільки катіони Гідрогену. Наприклад:
- •Натрій гідроксоалюмінат
- •1.3. Розв’язок типових задач з елементарної хімії і. Визначення масової частки елементів у сполуках
- •Іі. Визначення масової, об’ємної або мольної частки сполук у сумішах.
- •Розділ 2. Хімічні закони
- •2.1. Фундаментальні закони хімії
- •2.2. Газові та стехіометричні закони
- •Розділ 3. Будова речовини
- •3.1. Будова атомів і Періодичний закон
- •Питання і задачі
Розділ 3. Будова речовини
3.1. Будова атомів і Періодичний закон
При кінці XIX ст. були зроблені відкриття, які показали що атом має складну будову і може перетворюватися при відомих умовах в інші атоми. На основі цих відкриттів почало швидко розвиватися вчення про будову атома.
Перші моделі будови атомів
У 1911 році Резерфорд запропонував планетарну модель будови атомів, згідно з якою у центрі атомів знаходиться масивне ядро, навколо якого рухаються електрони, причому позитивний заряд ядра дорівнює негативному заряду усіх електронів. Між електронами і ядром існує електростатичне тяжіння, яке зрівноважено відцентровою силою, що виникає внаслідок руху електронів. Ця модель пояснювала деякі досліджені закономірності і завдяки своєї наочності довго використовувалася вченими для пояснення явищ на атомно–молекулярному рівні. Виходячи з дослідів Резерфорда, його учень Чедвік в 1920 році довів, що заряд ядра чисельно дорівнює порядковому номеру елемента у Періодичній системі. Але ця теорія суперечила класичній механіці, згідно з якою електрон, обертаючись навколо ядра, повинен постійно випромінювати енергію у вигляді світових хвиль і в кінці кінців «впасти» на ядро, що призвело б до знищення атома. Але відомо, що атом – досить стійка система і може існувати без руйнування нескінченно довго. Крім того, при безперервному випромінюванні енергії електроном спектр атома повинен бути суцільним, а дослідження показали, що спектри атомів лінійчаті, тобто теорія не пояснювала лінійчаті спектри атомів.
На зміну теорії Резерфорда прийшла теорія Н. Бора. Датський вчений Бор (1913) на основі квантової теорії випромінювання М. Планка розвинув квантову теорію будови атома. Виходячи з квантової теорії, Бор теоретично обґрунтував модель найпростішого з усіх атомів – атома Гідрогену. Основи своєї теорії Бор висловив у вигляді постулатів.
Електрон може рухатися навколо ядра атома не по будь-яких орбітах, а тільки по цілком визначеним, дозволеним; при цьому атом не випромінює енергії.
Випромінювання і поглинання енергії відбуваються при переході електрона з однієї орбіти на іншу; при цьому енергія випромінюється порціями, або квантами, кожному з яких відповідає певна частота.
Положенню електрона на кожній з стаціонарних орбіт відповідає певний запас енергії. Коли електрон рухається по першій орбіті, міцність його зв'язку з ядром максимальна, а запас енергії мінімальний. Такий стан атома називається основним. Якщо підвести енергію до атома, то електрон переміститься на одну з більш віддалених орбіт, при цьому міцність зв'язку його з ядром зменшується, а запас енергії атома збільшиться. Такий стан атома має назву збудженим.
На основі своєї теорії Бор розрахував спектр атома водню (енергію електрона в атомі, радіус орбіт і частоту випромінювання) і ці розрахунки співпали з експериментально виявленими. Теорія Бора не лише пояснила фізичну природу атомних спектрів, а й дала змогу розрахувати спектри, але її успіхи обмежувались тільки атомом Гідрогену, тому що вона не враховувала взаємне відштовхування електронів в багатоелектронних атомах.
Створюючи свою модель будови атома, Н. Бор розглядав електрон як класичну матеріальну частину. Проте на основі теорії Планка Ейнштейна про світлові кванти було доведено, що не можна автоматично поширювати закони, справедливі для макросвіту на об’єкти мікросвіту – атоми, електрони, фотони. Оскільки розміри цих частинок дуже малі порівняно з розмірами макротіл, їх властивості якісно відрізняються від властивостей останніх. Тому постала потреба в розробці нової фізичної теорії для описання властивостей і поведінки об’єктів мікросвіту.
Основи квантової механіки. Хвильова природа електрона. Електронні хмари У 20-тих роках ХХ сторіччя завдяки роботам де Бройля, Шредінгера, Гейзенберга та інших вчених були розроблені положення квантової механіки, основною особливістю якої є ймовірностний характер. З рівнянь Планка ( Е = h) і Ейнштейна (Е = mc2) випливає , що h = mc2 . Враховуючи, що = с/ і швидкість руху фотона дорівнює швидкості світла, дістанемо основне рівняння хвильової механіки – рівняння де Бройля:
= h / mv
З цього рівняння випливає, що частині з масою m, яка рухається зі швидкістю v, відповідає хвиля з довжиною . Це рівняння використовується не лише для фотонів а і для інших матеріальних частинок – електронів, протонів, тощо, тобто всі вони мають двоїсту корпускулярно–хвильову природу. Як частина, електрон має певну масу покою, енергію і імпульс. Як хвиля, він характеризується довжиною і частотою хвилі, для нього відомі явища интерференції і дифракції.
У 1925 році Гейзенберг запропонував принцип невизначенності, згідно з яким не можна одночасно встановити точне місце перебування електрона у просторі та його швидкість (або імпульс р = mv).
Нові уявлення про електрон примусили відмовитись від прийнятої раніше моделі атома. Згідно з новою теорією, електрон може перебувати у будь-якій точці простору, який оточує ядро атома, однак ймовірність його перебування в тий чи іншій його частині неоднакова.
Хвильове рівняння Шредінгера
Рух електрона має хвильовий характер, тому квантова механіка описує цей рух за допомогою хвильової функції (псі), яка набуває різних значень у різних точках атомного простору. Оскільки рух електронів хвильоподібний, визначення хвильової функції зводиться до знаходження амплітуди і енергії електронної хвилі. Рух хвилі кількісно характеризується амплітудою , яку можна обчислити з диференціального рівняння Шредінгера, що зв’язує з повною енергією електрона. Скорочений вигляд цього рівняння такий:
Н = Е,
де Н – оператор Гамільтона, який показує порядок дій для отримання певного значення хвильової функції, Е – повна енергія електрона.
Розвязуючи це рівняння можна отримати енергетичні рівні та відповідні хвильові функції, які описують стан електрона в атомі. Характеристика руху електронів за допомогою хвильових функцій складають зміст квантової механіки.
Як модель стану електрона в атомі, в квантовій механіки прийнято уявлення про електронну хмару, густина відповідних ділянок якої пропорційна ймовірності перебування там електрона. Електрони ніби розмазані навколо ядра у обємі певної форми, віддаленого від нього на певну відстань. Максимальна густина відповідає найбільшій ймовірності перебування електрона, тобто визначається величиною 2. Очевидно, чим міцніше зв’язок електрона з ядром, тим електронна хмара менше за розміром і компактніша за розподілом заряду. Простір навколо ядра, де перебування електрону найбільш ймовірно називається електронною орбіталлю.
Квантові числа
Наслідком розвязання рівняння Шредінгера для атома Гідрогену є три квантових числа, які характеризуюють поведінку електрона в атомі. Ці ж квантові числа характеризують стан електронів будь-якого атому Періодичної системи елементів.
Головне квантове число n визначає енергію електрона та розміри електронної хмари. Енергія електрона головним чином залежить від відстані електрона від ядра: чим ближче до ядра знаходиться електрон, тим менше його енергія. Головне квантове число n визначає положення електрона на тому або іншому енергетичному рівні (квантовому шарі). Воно може приймати значення ряду цілих чисел від 1 до . При значенні n = 1, електрон знаходиться на найближчьому до ядра енергетичному рівні і має найменшу енергію.
Енергетичні рівні позначаються цифрами або великими латинськими буквами:
Значення n .......... 1 2 3 4 5
Позначення ......... K L M N O
Згідно з квантово-механічними розрахунками, електронні хмари відрізняються не тільки розмірами, але і формою. Форму електронної хмари характеризує орбітальне квантове число l. Різна форма електронних хмар зумовлює зміну енергії електронів в межах одного енергетичного рівня, тобто розщеплення його на енергетичні подрівни. Орбітальне квантове число може приймати значення від 0 до n–1, всього n значень. Енергетичні підрівні позначають маленькими латинськими буквами:
Значення l ..........0 1 2 3 4 5
Позначення ........ s p d f g h
При n = 1 орбітальне квантове число має тільки одне значення l = 0. Ці електронні хмари мають кульову симетрію і називаються s-електронами. На першому енергетичному рівні можуть знаходитися тільки s-електрони, умовний запис підрівня – 1s.
При n = 2, орбітальне квантове число має два значення: l = 0 і l = 1. Орбі-тальному числу l = 1 відповідає гантелевидна форма хмари (форма об'ємної восьмірки) і електрони називаються р-електронами. На другому енергетичному рівні можуть знаходитися s і р-електрони, які утворюють два подрівні: 2s і 2р.
При n = 3 орбітальне квантове число має три значення: l = 0, l = 1 та l = 2. Електрони з l = 2 називаються d-електронами і їм відповідає більш складна форма електронних хмар. На третьому енергетичному рівні можуть знаходитися s-, р- і d-електрони, які утворюють три подрівні: 3s, Зр та 3d.
При значенні n = 4 орбітальне квантове число має чотири значення: l = 0; l = 1; l = 2 та l = 3. Орбітальному числу 3, відповідає ще більш складна форма хмар і електрони мають назву f-електронів. На четвертому енергетичному рівні можуть знаходитися s-, р-, d– і f-електрони, які утворять чотири подрівні 4s, 4p, 4d і 4f.
З розвязання рівняння Шредингера витікає, що електронні хмари орієнтовані в просторі. Просторова орієнтація електронних хмар характеризується магнітним квантовим числом – ml. Воно приймає будь-яке ціле числове значення від +l до –l, включно 0. Таким чином, кількість можливих значень магнітного квантового числа дорівнює 2l + 1. При l = 0 магнітне квантове число має тільки одне значення, ml = 0; при l = 1 магнітне квантове число має три значення: ml = 1, ml = 0 і ml = – l. Три значення магнітного числа характеризують три стани р-електронів, що відповідає орієнтації р-хмар в просторі в трьох взаємо перпендикулярних площинах по вісях координат х, у та z.
При l = 2 ml має п'ять значень: ml = 2, ml = 1, ml = 0, ml = –2, ml = –1. П’ять значень магнітного квантового числа відповідають п'яти просторовим положенням d–електронних хмар. Орбітальному квантовому числу 3 відповідає сім значень магнітного числа і сім просторових положень f-хмар.
Вивчення атомних спектрів показало, що три квантових числа n, l і ml, не повністю характеризують поведінку електронів в атомі. Електрон, рухаючись в полі ядра атома, крім орбітального моменту імпульсу має також власний момент імпульсу, що характеризує його веретеноподібне обертання навколо власної вісі. Ця властивість електрона отримала назву спіна. Розмір і орієнтацію спіна характеризує спінове квантове число s, яке може приймати значення +1/2 та –1/2. Позитивне та негативне значення спіна пов'язані з його напрямленістю. Оскільки спін – векторна величина, його умовно позначають стрілкою, направленою вгору або вниз: і . Електрони, що мають, однаковий напрям спінів називаються паралельними, протилежний напрямок – антипаралельними.
Отже, стан електрона в атомі повністю характеризується чотирма квантовими числами: n, l, ml і s.
Будова багатоелектронних атомів
Для атомів з кількома електронами користуються наближенним розв’язком рівняння Шредінгера. Заповнення електронної оболонки атомів здійснюється згідно наступних принципів і правил.
1.Принцип мінімуму енергії: послідовність заповнення електронами рівней і подрівней здійснюється від підрівня з меншою енергією до підрівнів з більшою енергією так, щоб сумарна енергія атома залишалась мінімальною; У багатоелектронних атомах електргія електрона залежить не тільки від головного, але й від орбітального квантового числа. Головне квантове число визначає лише зону, в межаї якої точне значення енергії електрона визначається величиною l. В результаті енергія зростає за енергетичними підрівнями в такому порядку:
ls<2s<2p<3s<3p<4s 3d<4p<5s 4d<5p<6s 5d 4f <6p і т. д.
Згідно з цим принципом використовується правило Клечковського: заповнення енергетичних рівней відбувається в порядку зростання суми чисел n + l, а при рівних значеннях n + l в порядку зростання n. Наприклад, у атома Аргона завершується заповнення 3р-підрівня. При переході до наступного елемента – Калію (Z=19) виникає питання про заповнення 4s- або 3d-підрівней. Оскільки для першого з них сума n + l дорівнює (4+0), а для другого – 5 (3+ 2), заповнюється 4s- підрівень.
Виключення з правила Клечковського спостерігаються для елементів з повністю або наполовину заповненими d- і f-підрівнями. Так, у Сu електронній конфігурації [Ar]3d10s1 відповідає менша енергія, ніж конфігурації [Ar]3d9s1.
Принцип Паулі, який встановлює, що в атомі не може бути двох електронів з однаковим набором значень чотирьох квантових чисел. Наприклад, електрони атома Берілію мають наступні значення квантових чисел:
|
Ве(1s22s2) № електрона |
Квантове число | |||
|
n |
l |
ml |
ms | |
|
1 2 3 4 |
1 12 2 |
0 0 0 0 |
0 0 0 0 |
+1/2 +1/2 +1/2 −1/2 |
3. Правило Хунда, яке визначає порядок заповнення підрівней. Сумарний спін електронів у підрівні повинен бути максимальним. Наприклад, в атомі Карбону будова електронної оболонки виражається формулою: [126С] 1s22s22р2. р-Електрони другого підрівня можуть мати паралельні спіни (= 1/2 + 1/2 = 1) та антипаралельні спини (= 1/2 + (–1/2) = 0). Отже реалізується перша конфігу-рація, причому ці електрони знаходяться на різних орбіталях (див. розташування електронів по комірках далі).
Будову електронної оболонки атомів і іонів зображають електронною або електронно-графічною формулою. Електронна формула показує розподіл електронів в атомах по орбіталях (енергетичних рівнях) і підрівнях, де рівні позначають цифрами 1, 2, 3, 4,..., підрівні літерами s, р, d, f. Верхній правий індекс показує кількість електронів на підрівні.
Електронно-графічна формула зображує атом елемента у вигляді сукупності орбіталей або квантових комірок.
Н
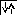 аведемо
декілька прикладів запису електронних
і електронно-графічних формул:
аведемо
декілька прикладів запису електронних
і електронно-графічних формул:
[1Н ] 1s1; [2Не ] 1s2 ;
[4Ве ] 1s22s2; [ 6С] 1s22s2 2р2; [8O] 1s22s22р4;
2



 s
2p
s
2p

 2s 2p 2s
2p
2s 2p 2s
2p
[13 Al] 1s22s22р63s23p3; [18 Ar] 1s22s22р63s23p6;
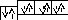
 3s
3p 3s 3p
3s
3p 3s 3p
[24Cr] – 1s22s22p63s23p63d54s1; [25Mn] – 1s22s22p63s23p63d54s2;
[80Нg]1s22s22р63s23p63d104s24p64d104f145s25p65d106s2.
Приклад 1. Написати схему розподілу електронів в атомі Хлора, його електронну і електронно-графічну формули.
Розвязання:
Хлор розташований в третьому періоді, отже, його атом має три енергетичних рівні. Він знаходиться в VII групі головної підгрупи, тому число електронів на останньому рівні дорівнює семи. Число електронів на інших рівнях визначається по формулі N = 2n2, тобто 2 і 8. Отже, схема будови атома Хлора:
17Cl 2(n=1) 8(n=2) 7(n=3)
електронна формула Хлора: електронно-графічна формула:
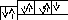 [17Cl]
–
ls22s22p63s23p5,
3s
3p
[17Cl]
–
ls22s22p63s23p5,
3s
3p
Приклад 2. Написати електронні формули атомів Хрому та Купруму. Поясніть розташування одного s-електрона на четвертому рівні.
Розвязання:
У елементів четвертого періоду Хрому (Z=24) і Купруму (Z=29), атоми яких мають по чотири електронні шари, відбувається починаючи з Sc заповнення 3d –подрівня. Згідно з тим, що більш енергетично вигідним для атома є умова мати повністю або напівзаповнений d-підрівень, відбувається "провал" одного з 4s-електронів на незавершений 3d-підрівень. (згідно з виключенням з правилу Клечковського). Електроні формули будуть мати вигляд
[Cr] – 1s22s22p63s23p63d54s1 [Сu] – ls22s22p63s23p63d104s1.
Відомості про будову ядра
Англійський фізик Чедвік (1932) встановив, що є промені, що уявляють собою потік електронейтральних часток, які згодом назвали нейтронами. На основі ретельного вивчення ядерних реакцій німецький фізик В. Гейзенберг в 1932 р. і одночасно радянські фізики Д. Д. Іваненко, Е. П. Гапон запропонували протонно-нейтронну теорію будови атомного ядра. Згідно з цією теорією, атомні ядра складаються з протонів та нейтронів. Ці частини обєднуються під загальною назвою нуклони і мають приблизно однакову масу, яка дорівнює 1 а. е. м.
Оскільки практично вся маса атома зосереджена в ядрі, можна вважати, що масове число А дорівнює сумі протонів N(р) і нейтронів N(n): А = N(р) + N(n).
Число нейтронів в ядрі дорівнює різниці між масовим числом і числом протонів: N(n) = А – N(р). Наприклад, атоми Гідрогену мають масові числа 1, 2, 3 і називаються Протій, Дейтерій і Тритій. Ядра цих атомів містять однакову кількість протонів, але різну кількість нейтронів, ядро Протію складається з 1 протона, ядро Дейтерію з 1 протона і 1 нейтрона, ядро Тритію з 1 протона і 2 нейтронів. Атоми, що мають однаковий заряд ядра, але різні масові числа, називаються ізотопами. У Періодичній системі елементів Д. І. Менделеєва атомна маса елемента вказується як середня величина масових чисел всіх його ізотопів, узятих в відсотковому відношенні, що відповідає їх поширеності в природі. Атоми різних ізотопів одного і того ж хімічного елемента з різною кількостю нейтронів мають однакову будову електронної оболонки, тому хімічні і і більшість фізичниї властивостей ізотопів майже однакові. Ізотопи займають одне і те ж місце в Періодичній системі.
Періодичний закон і періодичні властивості елементів
В 1871 році Д.І.Менделєєв дав стисле формулювання відкритому ним Періодичному закону: властивості елементів, а також властивості утворенних ними простих і складних тіл перебувають у періодичній залежності від величини ваг (атомних мас) елементів. Заслуга вченого полягяє у тому, що він перший зрозумів виявлену зележність як об’єктивну закономірність природи, чого не змогли зробити його попередники. Менделєєв вважав, що у періодичній залежності перебувають склад сполук, їхні хімічні і фізичні властивості, температури кипіння і плавління, будова кристалів, реакційна здатність, тощо.
Д.І.Менделєєв передбачив існування близько 20 нових елементів й залишив для них вільні місця в Періодичній системі. Його передбачення підтвердились відкриттям багатьох елементів на прикінці ХІХ сторіччя.
Періодична система елементів це графічний вираз періодичного закону – певне розташування елементів у порядку зростання їх атомних мас.
Основними структурними одиницями періодичної системи є періоди і групи. Період – це горизонтальний ряд, в якому елементи розташовані в порядку зростання їхніх атомних мас. Всього є сім періодів. Першій період найкоротший і має два елементи: Гідроген і Гелій. Другий (від Li до Ne) і третій (від Na до Ar) періоди містять по вісім елементів. Ці періоди називаються малими періодами. Елементи другого та третього періодів називаються також типовими, оскільки їхні властивості є основою розподілу всіх інших елементів на вісім груп. Четвертий і п’ятий великі періоди містять по 18 елементів, а шостий – 32 елементи. Останній сьомий період – незакінчений.
Групою періодичної системи називают вертикальний ряд, в якому розміщені подібні за електроною структурою і властивостями елементи. У Періодичній системі є вісім груп. З кожного малого періоду до групи входять по одному типовому елементу, а з кожного великого, який поділяється на два підперіоди, входять по два елементи, один з яких є типовим, а другий – неповним аналогом типових елементів. Саме тому кожна група має дві підгрупи: головну (А-підгупу) і побічну (В-підгрупу). Головна група об’єднує типовї елементи, до побічної підгрупи належать елементи великих періодів.
Основні закономірності Періодичної системи
У малих періодах із збільшенням порядкового номера спостерігається поступове зменшення металічних і наростання неметалічних властивостей. Для елементів великих періодів ця закономірність ускладнюється. Періодична зміна властивостей всередині великих періодів дає змогу розділити їх на два ряди, де друга частина періоду повторює першу. Тому пасивні метали родини платини (Ru, Rh, Pd, Os, Ir, Pt) можна розглядати, як аналоги благородних газів, а Zn, Cd, Hg – як аналоги лужно-земельних металів (Са, Мg).
У групах в міру зростання атомної маси закономірно зростають металічні властивості.
Зростання металічних властивостей у підгрупах зверху вниз, а також зменшення цих властивостей у межах одного періоду зліва направо зумовлюють появу діагональної закономірності. Так Be дуже подібний до Al, B до Si, Тi до Nb. Це яскраво виявляється в тому, що в природі ці елементи часто зустрічаються разом і утворюють подібні мінерали. Наприклад, титан завжди буває разом з ніобієм, утворюючи мінерал титаноніобат.
З розвитком теорії будови атома пояснити деякі властивості елементів виходячи з атомних мас виявилося недостатнім. У 1911 р. Мозлі встановив, що порядковий номер елемента у таблиці Д.І. Менделєєва дорівнює заряду його ядра. На основі точного визначення порядкового номера елемента було встановлено, що в Періодичній системі елементи розташовані у порядку зростання величини заряда їх ядра. Тому періодичний закон дістав нове формулювання: властивості елементів, а також форми і властивості їх сполук перебувають у періодичній залежності від заряда ядра їхніх атомів.
Властивості атомів хімічних елементів
Енергія іонізації. Спорідненість до електрона. Електронегативність
Хімічні властивості елементів зумовлені здатністью їх атомів віддавати або приєднувати електрони, що кількісно характерізуються енергією іонізації, спорідненістю до електрона і електронегативністю.
Енергія іонізації ( потенціал іонізації, І) – це мінімальна енергія, яка потрібна для відриву електрона від незбудженого атома. Вимірюється у кДж/моль або еВ/атом (1 еВ = 1,6 10-19 Дж). Багатоелектронні атоми мають декілька потенціалів іонізації (І1, І2, І3...) що відповідає відриву першого, другого і дальших електронів. При цьому завджи І1 < I2 < I3 <....In. Ця характеристика атома залежить від положення елемента в Періодичній системі, тобто від величини заряду ядра, розмірів і конфігурації атома, екрануючьої дії внутрішніх електронів, тощо. Потенціал іонізації закономірно змінюється в межах періодів і груп.
В межах періодів найменший І мають s-елементи І групи ( Li, Na, K та ін)., а найбільший – елементи VIII групи (Не, Ne, Ar). Це зростання зумовлене зрос-танням ефективного заряду ядра (із збільшенням заряду збільшується притягання до нього електронів, внаслідок чого збільшується і енергія відриву їх від атома). В рядах перехідних елементів збільшення заряду ядра компенсується екрануючою дією електронів, розміщених на внутрішніх енергетичних рівнях, тому потенціал іонізації змінюється мало.
Збільшення заряду ядра в підгрупах менше впливає на зв’язок зовнішнього електрона з ядром, ніж збільшення розміру атома і числа екрануючих електронів, тому в межах підгруп s-i p – елементів зв’язок зовнішнього електрона з ядром зменшується, що приводить до зменшення І. Величина І характеризує «металіч-ність» елемента: чим вона менше, тим більш «металічний» елемент. І є також кількісною характеристикою відновної активності певного елемента.
Спорідненість до електрона (Е) – це енергетичний ефект реакції прєднання електрона до нейтральної частини (атома, молекули, радикала). Найбільшу Е мають р-елементи сьомої групи (F, Cl, Br, I), а найменші, і, навіть, від’ємні значення мають атоми з конфігурацією s2 (Be, Mg), s2p6 (Ne, He) або атоми з наполовину заповненими р-підрівнями. Величина Е є кількісною характеристикою окиснювальної властивості елементів.
Електронегативність (Х) – характеристика відносної здатності атомів певної сполуки набувати собі негативного заряду відтягуванням на себе електронної густини зв’язку. Маллікен запропонував розраховувати Х за формулою:
Х = (І + Е)/ 2
Як приклад визначимо Хдля Флуору і Літію. Із довідкових таблиць знаходимо, щоIF= 17,42 еВ,EF= 3,62 еВ,ILi= 5,39 еВ,ELi = 0,22 еВ (обчислено непрямим способом). Тоді
XF= 17,42 + 3,62 = 21,04 еВ,ХLi= 5,39 + 0,22 = 5,61 еВ.
Флуор має найбільше значення I + Е, тому він є найбільш електронегативним елементом. Найменші значення електронегатавності мають атоми лужних металів
Полінг запропонував визначати Х в умовних відносних одиницях і склав таблицю відносних електронегативностей (). Найменшу має Францій, найбільшу – Флуор. Використовуючи поняття треба вважати, що її неможливо експериментально визначити; величина не є сталою і залежить від природи другого атома, з яким утворюється певний зв’язок. В межах періодів елементів збільшується, в межах підгруп - зменшується. Найменші значення її мають s-елементи, найбільші – р-елементи VII і VI груп (F, Cl, O, S). Зараз широко використовують таблицю відносних електронегативностей, яка надається у методичному посібнику [ ].
Х і характеризує здатність атомів до поляризації ковалентного зв’язку. Чим більше різниця в електронегативностях двох атомів, тим більше ступінь іонізації утворенного ними зв’язку.
Розміри атомів та іонів
Абсолютні розміри ізольованих атомів визначити неможливо, тому що їх електронні хмари не мають певних меж. Для характеристики атомних розмірів використовують декілька умовних понять.
Орбітальний радіус вільного атома – це відстань від ядра до теоретично розрахованого положення головного максимуму густини зовнішньої електронної хмари. Він залежить від електронної конфігурації атомів і має певні значення для нормального і збудженого станів.
Ефективний атомний радіус – це половина найкоротшої відстанї між атомами в кристалах чи молекулах при припущенні, що атоми дотикаються один до одного своїми поверхнями, і вважаються пружними кулями. Ці радіуси визначаються виходячи з експериментальних даних про міжатомні відстані. Для типових металів ці величини майже співпадають, а для неметалів ця різниця досить велика.
Радіуси періодично змінюються в залежності від заряду ядра. Найбільші радіуси в періоді мають s-елементи. В періодах радіуси зменшуються внаслідок збільшення притягання електронів до ядра при збільшенні його заряду. В групах радіуси зростають зверху вниз, що зумовлено зростанням кількості електронних рівнів. У підгрупах s- та р-елементів атомні радіуси зростають більш інтенсивно, ніж у підгрупах d-елементів. Таке аномальне зменшення розмірів атомів елементів великих періодів зумовлене стисненням d– і f– оболонок.
При приєднанні електронів до атомів утворюються аніони, розмірі яких завжди більше, ніж розміри нейтральних атомів. При відриві електронів від атомів утворюються катіони, розміри яких завжди меньше розмірів нейтральних атомів.
Спінова валентність і ступінь окиснення елементів
Спінова валентність або валентність по Гейтлеру і Лондону визначається кількостю наспарених електронів. Неспареними називаються ті електрони, які мають паралельні спіни. Під час хімічної реакції атоми можуть переходити у збуджений стан, при цьому спарені електрони розпарюються. Це відбувається, якщо енергія, яка витрачається на розпарювання, компенсується енергією, яка виділяється при утворенні зв’язка.
Розглянемо основний та збуджений стан деяких елементів ІІ і ІІІ періодів.
[Li] = 1s22s1, має один неспарений електрон і виявляє валентність 1.
[Be] = 1s22s2, в основному стані не має неспарених електронів.
[Be]* = 1s22s12p1, в збудженому стані має два неспарених електрони і виявляє валентність 2. Енергія збудження становить 356 кДж/моль, енергія утворення одного зв’язку – 464 кДж/ моль, отже при утворенні двох зв’зків виділяється значно більше енергії, ніж її витрачається на збудження.
[B] – 1s22s22p1; [B]* – 1s22s12p2; Бор найчастіше виявляє валентність 3.
[C] – 2s22p2 ; [C]* – 2s12p3, відомі сполуки двовалентного Карбону, але значно більше поширені сполуки чотирьохвалентного Карбону.
Збудження атомів Нітрогену ( 2s22p3), Окисгену ( 2s22р4), та Флуору ( 2s22p5) в межах другого квантового рівня не може привести до збільшення числа неспарених електронів, тому що другий рівень має тільки два підрівня, а перехід їх на новий квантовий рівень потребує значної енергії, яка не компенсується відділеням її при утворенні зв’язку. За рахунок неспарених електронів атом Нітрогену може утворити тільки три зв’язки, атом Оксигену - два, атом Флуору - один зв’язок.
Атоми елементів третього періоду на зовнішньому рівні мають вакантний d-підрівень, на який при збудженні можуть переходити 3р- та 3s-електрони. При цьому з’являється додаткова можливість збільшення числа неспарених електронів. Так, наприклад, атом хлору може бути переведений у збуджений стан, який характеризується наявністью трьох, п’яти або семи неспарених електронів, виявляючи при цьому валентність 1 (основний стан), 3, 5, 7 (збуджений стан).
[Cl]* – 2s23p43d1
[Cl] = 3s23p5 [Cl]* – 2s23p33d2
[Cl]* – 2s13p33d3
Ступень окиснення (СО) – умовний електричний заряд на атомі, виходячи з допущення, що дана сполука складається з іонів. Це одна з найважливіших характеристик атомів елементів. В залежності від співвідношення величин електронегативностей атоми можуть мати позитивний, негативний (цілий або дробовий), або рівний нулю ступінь окиснення.
Величину та знак ступеня окиснення визначають, виходячи з положень, які розглянуті у розділі "окиснювальн–відновні реакції".
Поняття валентності і СО не слід отожнювати, навіть у тих випадках, коли вони випадково співпадають.
Періодичні властивості сполук елементів будуть розглянуті у розділі "Елементи неорганічної хімії" на прикладі сполук металів.
