
- •Химические свойства Основные оксиды
- •Кислотные оксиды
- •Амфотерные оксиды
- •1. Реакции соединения
- •2. Реакции разложения
- •3. Реакции замещения
- •4. Реакции обмена
- •5. Реакции переноса.
- •2. Окислительно-восстановительные реакции.
- •3. Лиганднообменные реакции.
- •4. Реакции атомно-молекулярного обмена.
- •Химические свойства Основные оксиды
- •Кислотные оксиды
- •Амфотерные оксиды
- •1. Реакции соединения
- •2. Реакции разложения
- •3. Реакции замещения
- •4. Реакции обмена
- •5. Реакции переноса.
- •2. Окислительно-восстановительные реакции.
- •3. Лиганднообменные реакции.
- •4. Реакции атомно-молекулярного обмена.
Билет №1
Химия как предмет в дореволюционной и современной школе
Современное содержание учебного предмета химии в школе сложилось не срезу. В Западной Европе химия находит свое место в школах уже в конце 18 века. Во Франции в 1789 г. Лавуазе опубликовал первый учебник химии для школы. В России первые попытки введения химии, как учебного предмета в учебный план гимназий относятся к 1857 г. Программа по химии в этот период носили ярко выраженный прикладной характер. Изложение материала курса было не систематическим и только в 1858 -70 гг. Менделеев написал первый систематический учебник «Основы химии», который строился на базе периодического закона. Решающий скачек в методики разработки содержания обучения химии произошел после открытия Менделеевым периодического закона. Когда в первые годы после Революции витал вопрос о создании школьных программ по химии двумя комиссиями – Петроградской (Верховский) и Московской (Лебедев) - в 1920 г. Были разработаны две программы по химии, которые сильно отличались друг от друга. Главная позиция Петроградских авторов – общеобразовательное значение предмета, развитие познавательного интереса, мыслительной активности. С этой целью давалась идея классификации веществ, а также ПЗ, хотя и помещен он был в конце курса как итоговое обобщение. Курс должен быть построен так, чтобы учащиеся могли пользоваться своими знаниями. Несмотря на недостатки (отсутствие понятий об атомах и молекулах) программа все же отражала основы химической науки. В основу Московского проекта была положена идея практического применения химии в народном хозяйстве. В ее основе – исследовательский подход. Недостаток – отсутствие четкой системы построения, программа представляла собой лишь перечень законов, теорий, понятий. ПЗ не изучался, библиография не приводилась. Из предложенных двух проектов было отдано предпочтение Московскому, как более связанному с жизнью. В 1932 г. Был принят проект Верховского. Первый учебник по этой программе «Неорганическая химия» Верховского. Современное содержание школьного курса химии получила научное обоснование в работах Верховского, Лебедева, Смирнова, Цветкова, Кузнецовой. Еще методические концепции разработки содержания школьного курса химии выражены у каждого из авторов школьных учебников. Подводя итого по всем подходам можно выделить дидактические единицы, составляющие структуру курса: 1. Законы и теории 2. Понятия 3. Факты 4. Метод химической науки 5. Вклад в науку выдающихся химиков.
Развитие творческих способностей учащихся в обучении химии
Цели творческих заданий: 1. Устранение формализма знаний 2. Привитие навыков самостоятельности 3. Изучение общих психолого-педагогических требований. Для развития творческих способностей учитель на уроке или в виде ДЗ должен давать различные ребусы и развивающие задания.
Методика изложения понятия «валентность» и «степень окисления» в 8 классе
При изучении ионной или ковалентной полярной хим связей используются сложные вещества, состоящие из двух ХЭ – бинарные соединения (HCl). Связь образуется за счет спаривания неспаренных внешних электронов и образования общей электронной пары атомов водорода и хлора.
![]() При
химическом взаимодействии общая
электронная пара смещена в сторону
более электроотрицательного атома
хлора
При
химическом взаимодействии общая
электронная пара смещена в сторону
более электроотрицательного атома
хлора
![]() .
Если предположить, что электрон от
водорода полностью переходит к хлору,
то связь можно представить как:H+1Cl-1.
А заряды +1 и -1. Такие условные заряды
называют степенью окисления. Степень
окисления – это условный заряд атомов
ХЭ в соединении, вычисленный на основе
предположения, что все соединения
состоят только из ионов. СО может быть
положительной, отрицательной или
нулевой, ставится над символом ХЭ:
Na2+1S-2,
Mg3+2N2+3,
H3+1N-3,
Cl20.
Отрицательная со – принял электрон,
положительное – отдал.
.
Если предположить, что электрон от
водорода полностью переходит к хлору,
то связь можно представить как:H+1Cl-1.
А заряды +1 и -1. Такие условные заряды
называют степенью окисления. Степень
окисления – это условный заряд атомов
ХЭ в соединении, вычисленный на основе
предположения, что все соединения
состоят только из ионов. СО может быть
положительной, отрицательной или
нулевой, ставится над символом ХЭ:
Na2+1S-2,
Mg3+2N2+3,
H3+1N-3,
Cl20.
Отрицательная со – принял электрон,
положительное – отдал.
I группы во всех соединения СО равна +1, II группы равна +2, III группы +3, например K2+1O-2, Ca+2Cl2-1, Al2+3S3-2.
В большинстве соединений атомы водорода имеют СО равную +1: H+1Cl-1. H2+1S-2, H3+1N-3.
Но в соединениях с металлами у водорода СО равна -1: Na+1H-1, Ca+2H2-1.
Нулевые значения СО имеют атомы в молекулах простых веществ и атомы в свободном состоянии, например: H20, N20, Fe0, Al0.
Валентность (с лат. «имеющий силу») — способность атомов химических элементов образовывать определённое число химических связей с атомами других элементов.
В основном, под валентностью химических элементов понимается способность свободных его атомов к образованию определённого числа ковалентных связей. В соединениях с ковалентными связями валентность атомов определяется числом образовавшихся двухэлектронных двухцентровых связей. Именно такой подход принят в теории локализованных валентных связей, предложенной в 1927 году В. Гайтлером и Ф. Лондоном в 1927 г. Очевидно, что если в атоме имеется n неспаренных электронов и m неподелённых электронных пар, то этот атом может образовывать (n + m) ковалентных связей с другими атомами. При оценке максимальной валентности следует исходить из электронной конфигурации гипотетического, т. н. «возбуждённого» (валентного) состояния. Например, максимальная валентность атома бериллия, бора и азота равна 4 (например, в Be(OH)42-, BF4- и NH4+), фосфора — 5 (PCl5), серы — 6 (H2SO4), хлора — 7 (Cl2O7).
Билет №2
Цели и задачи обучения химии в средней школе. Образовательная, воспитательная и развивающая функция обучения в изучении химии
Химия формирует личность учащихся. Для достижения этой цели обучение химии ставит перед собой задачи, решение которых осуществляется с позиции единства образовательной, воспитывающей и развивающей функции обучения. Школьный курс химии должен знакомить учащихся с основами науки, т.е.
* обеспечивать сознательное усвоение учащимися важнейших химических законов, теорий, понятий, знакомить с методами химической науки.
* формировать научное мировоззрение, а также понятие того, что химическое образование – обязательный элемент культуры.
* воспитывать трудолюбие, нравственность, интерес к предмету, понимание приоритета человеческих ценностей.
* развивать мышление учащихся, их самостоятельность и творческую активность в овладении знаниями.
* обеспечить знакомство с главными направлениями химизации народного хозяйства, с возрастающим значением химии в окружающей действительности.
* формировать практические умения и навыки, способствовать профориентации.
Выбор методов обучения в преподавании химии
Методы обучения химии — сложная категория; через них устанавливается связь между химическим содержанием и процессом его усвоения учащимися. Методы и содержание образуют диалектическое единство, так как любое содержание вводится в учебный процесс посредством метода. По отношению к учащимся методы обучения — это методы учебного познания. Усваивая содержание, ученик воспринимает и метод его изучения, который может быть в дальнейшем применен и по отношению к другому содержанию.
Каждый метод нужно применять там, где он наиболее эффективно выполняет свои функции. Любой метод должен выполнять все 3 функции : если применен правильно, выбран адекватно содержанию и возрастным особенностям учащихся и используется не изолированно, а в сочетаниями с другими методами обучения. При выборе оптимального метода учитывается следующее: закономерности и принципы обучения, задачи, содержание и методы химии, учебные возможности школьников(возрасти уровень знаний).
Методы обучения имеют сложную структуру, в основе которой лежит единство преподавания и учения, направленное на реализацию образовательной, воспитывающей и развивающей функций обучения. Выбор методов обучения осуществляется учителем и зависит от многих факторов.
Широко известна классификация методов:
1) по характеру познавательной деятельности учащихся (общие методы): объяснительно-иллюстративный, репродуктивный, эвристические и исследовательский, различающиеся по степени познавательной активности и самостоятельности обучаемых;
2) по дидактической цели: методы изучения нового материала, закрепления и совершенствования и контроля знаний и умений учащихся;
3) по источнику знаний: словесные, словесно-наглядные и словесно-наглядно-практические. Названия последних говорят о том, что любые из них предполагают прежде всего использование слова как источника знаний самого по себе или в сочетании с химическим экспериментом, средствами наглядности и объектами практической деятельности учащихся.
Методика изложения понятия «простое вещество», «металл», «неметалл» в 8 классе
Из всех химических элементов ПСХЭ почти 96 элементов образуют в свободном состоянии простые вещества с металлической связью. Все металлы, кроме ртути, в обычном состоянии твердые вещества. Металлы – ковкие, пластичные, тягучие вещества, которые имеют металлический блеск и способны проводить тепло и электрический ток.
6 элементов в группе щелочных металлов, 6 в группе щелочноземельных металлов, 38 в группе переходных металлов, 11 в группе лёгких металлов, 7 в группе амфотерные металлы, 14 в группе лантаноиды + лантан, 14 в группе актиноиды (физические свойства изучены не у всех элементов) + актиний, вне определённых групп бериллий и магний.
Вещество – это то, из чего состоят физические тела. Они состоят из молекул, а молекулы из атомов. Определенный вид атомов называют химическим элементом.
Вещества, которые образованы атомами одного ХЭ, называются простыми, а если разными – сложные. Свойства веществ – это признаки, по которым одни вещества отличаются от других. Металлы – простые вещества, в которых атомы связаны между собой металлической связью, поэтому главным принципом разделения простых веществ на металлы и неметаллы является тип химической связи. В большинстве неметаллов связь ковалентная. Но есть еще благородные газы (простые вещества элементов VIIIA группы), атомы которых в твердом и жидком состоянии связаны только межмолекулярными связями. Отсюда и определение.
Неметаллы – простые вещества, в которых атомы связаны между собой ковалентными (или межмолекулярными) связями.
Среди металлов по химическим свойствам выделяют амфотерные металлы. Они могут реагировать как с щелочами, так и с кислотами. Кроме того из-за химической инертности выделяют благородные металлы. К ним относят золото, рутений, родий, палладий, осмий, иридий, платину. Так же иногда к ним относят серебро, хотя оно более реакционноспособно, но не относят инертные металлы, такие как лантал, ниобий и некоторые другие. В металлургии металлы делят на черные (железо и его сплавы) и цветные.

Металлическая решетка
Ряд напряжения металлов
Li→Rb→K→Ba→Sr→Ca→Na→Mg→Al→Mn→Zn→Cr→Fe→Cd→Co→Ni→Sn→Pb→H→Sb→Bi→Cu→Hg→Ag→Pd→Pt→Au
Из металлов наиболее распространены в земной коре (% масс.) Al (8,45), Fe (4,40), Ca (3,30), Na (2,60), K (2,50), Mg (2,10), Ti (0,61). Лишь немногие металлы (Au, металлы платиновой группы, Cu, Hg) встречаются в свободном (самородном) состоянии. Получение металлов в этом случае сводится к их выделению различными физическими (промывки водой) и химическими (при помощи различных реагентов) методами
Химические свойства металлов.
Восстановление неметаллов.
2Мg + О2 = 2МgО
4Аl + ЗО2 = 2А12О3
2К + Сl2 = 2КСl
2W + 3O2 = 2WO3
Менее энергично металлы взаимодействуют с серой:
Сu + S = СuS
Fе + S = FеS
Трудно вступают в реакцию с азотом и фосфором:
ЗМg + N2 = Мg3N2 (нитрид магния)
ЗСа + 2Р = Са3Р2 (фосфид кальция)
Активные металлы взаимодействуют с водородом:
Са + Н2 = СаН2 (гидрид кальция)
Взаимодействие с водой:
Активные металлы (щелочные металлы) взаимодействуют с водой при обычных условиях с образованием гидроксидов и выделением водорода:
2Nа + 2Н2О == 2NаОН + Н2
Са + 2Н2О = Са(ОН)2 + Н2
2Аl + 6Н2O = 2Аl(ОН)3 + ЗН2
С водными растворами щелочей:
Zn + 2H2O + 2NaOH = Na2[Zn(OH)4] + H2
С кислотами:
Pb + 2HCl = PbCl2 + H2
Pb + H2SO4 = PbSO4 + H2
Sn + HCl + H2O = SnOHCl + H2
3Ca + 2H3PO4 = Ca3(PO4)2 + 3H2
4Mg + 5H2SO4(к) = 4MgSO4 + H2S + 4H2O
3Zn + 4H2SO4(к) = 3ZnSO4 + S + 4H2O
Cu + 2H2SO4(к) = CuSO4 + SO2 + 2H2O
Pb + 3H2SO4(к) = H2[Pb(SO4)2] + SO2 + 2H2O
или Pb(HSO4)2
Химические свойства неметаллов.
Химические свойства 1. Окислительные свойства неметаллов проявляются при взаимодействии с металлами
4Al + 3C = Al4C3
2. Неметаллы играют роль окислителя при взаимодействии с водородом
H2 + F2 = 2HF
3 Любой неметалл выступает в роли окислителя в реакциях с теми металлами, которые имеют низкую ЭО
2P + 5S = P2S5
4. Окислительные свойства проявляются в реакциях с некоторыми сложными веществами
CH4 + 2O2 = CO2 + 2H2O
5. Неметаллы могут играть роль окислителя в реакциях со сложными веществами
2FeCl2 + Cl2 = 2FeCl3 6. Все неметаллы выступают в роли восстановителей при взаимодействии с кислородом
4P + 5O2 = 2P2O5
7. Многие неметаллы выступают в роли восстановителей в реакциях со сложными веществами-окислителями
S + 6HNO3 = H2SO4 + 6NO2 + 2H2O
8. Наиболее сильные восстановительные свойства имеют углерод и водород
ZnO + C = Zn + CO;
CuO + H2 = Cu + H2O 9. Существуют и такие реакции, в которых один и тот же неметалл является одновременно и окислителем, и восстановителем. Это реакции самоокисления-самовосстановления (диспропорционирования)
Cl2 + H2O =HCl + HClO
Билет №3
Принципы формирования содержания школьного курса химии. Анализ вариантов построения альтернативных методов
Современное содержание школьного курса химии получило научное основание в работах крупнейших отечественных методистов Верховского, Лебедева, Цветкова и др. при разных подходах во всех курсах можно выделить определенный набор дидактических единиц составляющих структуру курса: 1. Законы и теории ПЗ и ПС Менделеева Атомно-молекулярное учение. Теория строения вещества и т.д. 2. Понятия. Вещество химический элемент химической реакции. 3. Факты. 4. Методы химической науки. В школьном курсе химии должна найти отражение сущность научно химических методов в связи с чем предусмотрено формирование определённых групп умений позволяющих приобщить учащихся к пониманию пути химического исследования: 1)проверка выдвинутой гипотезы экспериментом, вывод, теоретическое осмысление, использование в практике 2) приобретение умения работать с посудой, реактивами, приборами и т.д. 3) освоение химической символики, методов моделирования веществ процессов. В школьном курсе химии 5 основных теоретических концепций атомно-молекулярные учения, - ПЗ и ПСЭ Менделеева и теории строения вещества, - теория электролитической диссоциации, закономерности возникновения и протекания химической реакции, современная теория строения органических веществ.
Особенности объяснительно-иллюстрационного метода преподавания химии
При этом методе учитель сообщает учащимся готовые знания используя разные частные и конкретные методы – объяснения учителя, работа с книгой, магнитофоном и т.д. При этом при меняются средства наглядности (эксперимент, модели, таблицы и т.п.). Этот метод чаще используется в начале изучения химии, когда у учащихся недостаточно знаний и умений. Не постоянное использование этого метода во всех учебных ситуациях может неблагоприятно сказаться на развитии учащихся или на их активности.
Методика изложения понятия «оксиды» в 8 классе- определение, классификация, получение, свойства
Оксид — бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. К исключениям относятся, например, дифторид кислорода OF2.
В зависимости от химических свойств различают:
Солеобразующие оксиды:
основные оксиды (например, оксид натрияNa2O, оксид меди(II)CuO): оксиды металлов,степень окислениякоторых I—II;
кислотные оксиды (например, оксид серы(VI)SO3, оксид азота(IV)NO2): оксиды металлов со степенью окисления V—VII и оксиды неметаллов;
амфотерные оксиды (например, оксид цинкаZnO,оксид алюминияAl2О3): оксиды металлов со степенью окисления III—IV и исключения (ZnO, BeO, SnO, PbO);
Несолеобразующие оксиды: оксид углерода(II)СО,оксид азота(I)N2O, оксид азота(II)NO.
|
Основные-реагируют с избытком кислоты с образованием соли и воды.Основным оксидам соответствуют основания. 1.Взаимодействие с водой(оксиды щелочных и щелочноземельных мет.) CaO+H2O=Ca(OH)2 2.Все-с кислотами МgO+2HCl=MgCl2+H2O 3.С кислотнями оксидами CaO+CO2=CaCO3 4.С амфотерными оксидами Li2O+Al2O3=2LiAlO2 |
Амфотерные (ZnO, Al2O3,Cr2O3, MnO2 ) 1.Взаимодействуют как с кислотами, так и с основаниями. ZnO+2HCl=ZnCl2+H2O ZnO+2NaOH+H2O=Na2[Zn(OH)4] 2.Реагируют с основными и кислотными оксидами ZnO+CaO=CaZnO2 ZnO+SiO2=ZnSiO3 |
Кислотные-реагируют с избытком щелочи с образованием соли и воды. Кислотным оксидам часто соответствуют кислоты. 1.Большинство взаимодействуют с водой SO3+H2O=H2SO4 2.Со щелочами NaOH+SiO2=Na2SiO3+H2O 3.С основными оксидами SiO2+CaO=CaSiO3 4.С амфотерными оксидами Al2O3+3SO3=Al2(SO4)3 |
Получение
1. Взаимодействие простых веществ (за исключением инертных газов,золотаиплатины) скислородом:
2Н2 + O2 = 2H2O 2Cu + O2 = 2CuO
При горении в кислородещелочных металлов(кромелития), а такжестронцияибарияобразуютсяпероксидыинадпероксиды:
2 Na + O2 = Na2O2 K + O2 = KO2
2. Обжиг или горение бинарных соединенийвкислороде:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2 Cs2 + 3O2 = CO2 + 2SO2 2PH3 + 4O2 = P2O5 + 3H2O
3. Термическое разложение солей:
CaCO3 = CaO + CO2 2FeSO4 = Fe2O3 + SO2 + SO3
4. Термическое разложение основанийиликислот:
2Al(OH)3 = Al2O3 + 3H2O 4HNO3 = 4NO2 + O2 + 2H2O
5. Окисление низших оксидов в высшие и восстановление высших в низшие:
4FeO + O2 = 2Fe2O3
6. Взаимодействие некоторых металловс водой при высокой температуре:
Zn + H2O = ZnO + H2
7. Взаимодействие солей с кислотными оксидами при сжигании кокса с выделением летучего оксида:
Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 2P + 5CO
8. Взаимодействие металлов с кислотами-оксилителями:
Zn + 4HNO3 = Zn(NO3)2 + 2NO2 + 2H2O
9. При действии водоотнимающих веществ на кислотыисоли:
2KClO4 + H2SO4 = K2SO4 + CL2O7 + H2O
10. Взаимодействие солей слабых неустойчивых кислотс более сильнымикислотами:
NaHCO3 + HCl = NaCl + H2O + CO2
Химические свойства Основные оксиды
1. Основный оксид + cильная кислота → соль + вода: CuO + H2SO4 = CuSO4 +H2O
2. Сильноосновный оксид + вода → щелочь: CaO + H2O = Ca(OH)2
3. Сильноосновный оксид + кислотный оксид → соль: CaO + Mn2O7 = Ca(MnO4)2 Na2O + CO2 = Na2CO3
4. Основный оксид + водород → металл + вода: CuO + H2 = Cu + H2O
Примечание: металл менее активный, чем алюминий.
Кислотные оксиды
1. Кислотный оксид + вода → кислота: SO3 + H2O = H2SO4
Некоторые оксиды, например SiO2, с водой не вступают в реакцию, поэтому их кислоты получают косвенным путём.
2. Кислотный оксид + основный оксид → соль: CO2 + CaO = CaCO3
3. Кислотный оксид + основание → соль + вода: SO2 + 2NaOH = Na2SO3 + H2O
Если кислотный оксид является ангидридом многоосновной кислоты, возможно образование кислых или средних солей:
Ca (OH)2 + CO2 = CaCO3 + H2O CaCO3 + H2O + CO2 = Ca(HCO3)2
4. Нелетучий оксид + соль1 → соль2 + летучий оксид: SiO2 + Na2CO3 = Na2SiO3 + CO2
5. Ангидрид кислоты 1 + безводная кислородосодержащая кислота 2 → Ангидрид кислоты 2 + безводная кислородосодержащая кислота 1: 2P2O5 + 4HClO4 = 4HPO3 + Cl2O7
Амфотерные оксиды
При взаимодействии с сильной кислотой или кислотным оксидом проявляют основные свойства: ZnO + 2HCl = ZnCl2 + H2O
При взаимодействии с сильным основанием или основным оксидом проявляют кислотные свойства:
ZnO + 2KOH + H2O = K2[Zn(OH)4] (в водном растворе)
ZnO + 2KOH = K2ZnO2 (при сплавлении)
Билет №4
особенности системы содержания курса химии в 8 классе
Предметом
наибольшего внимания авторов программ
и учебников оказался курс химии основной
школы, а именно VIII и IX классов. Этот курс
в дальнейшем именуется базовым. Базовому
курсу предшествуют либо естествознание
с элементами химических знаний, либо
пропедевтический курс химии. И
естествознание в V—VI классах, и
пропедевтические курсы в VII классе можно
считать сравнительно новым явлением в
школе. Правда, естествознание уже в
течение ряда лет проходило экспериментальную
проверку по инициативе проф. А. В.
Тарасова, а также акад. А. Г. Хрипковой,
проф. И. Т. Суравегиной, проф. А. И.
Захлебного. Но пропедевтические курсы
и сейчас еще не везде получили признание.
Базовый курс создает основу для изучения
химии на старшей ступени обучения (X—XI
классы). Систему курсов химии по ступеням
обучения с учетом углубленности и
профильности можно выразить схемой.
Главным ядром в системе является базовый
курс VIII—IX классов.Его особенность в
том, что в учебник IX класса включены
некоторые сведения по органической
химии. Этот курс достаточно традиционен,
что объясняет наилучшую обеспеченность
его программами и учебниками.
выбор методов обучения и преподавания химии. эвристический подход
Методы обучения химии — сложная категория; через них устанавливается связь между химическим содержанием и процессом его усвоения учащимися. Методы и содержание образуют диалектическое единство, так как любое содержание вводится в учебный процесс посредством метода. По отношению к учащимся методы обучения — это методы учебного познания. Усваивая содержание, ученик воспринимает и метод его изучения, который может быть в дальнейшем применен и по отношению к другому содержанию.
Каждый метод нужно применять там, где он наиболее эффективно выполняет свои функции. Любой метод должен выполнять все 3 функции : если применен правильно, выбран адекватно содержанию и возрастным особенностям учащихся и используется не изолированно, а в сочетаниями с другими методами обучения. При выборе оптимального метода учитывается следующее: закономерности и принципы обучения, задачи, содержание и методы химии, учебные возможности школьников(возрасти уровень знаний).
Методы обучения имеют сложную структуру, в основе которой лежит единство преподавания и учения, направленное на реализацию образовательной, воспитывающей и развивающей функций обучения. Выбор методов обучения осуществляется учителем и зависит от многих факторов.
Широко известна классификация методов:
1) по характеру познавательной деятельности учащихся (общие методы): объяснительно-иллюстративный, репродуктивный, эвристические и исследовательский, различающиеся по степени познавательной активности и самостоятельности обучаемых;
2) по дидактической цели: методы изучения нового материала, закрепления и совершенствования и контроля знаний и умений учащихся;
3) по источнику знаний: словесные, словесно-наглядные и словесно-наглядно-практические. Названия последних говорят о том, что любые из них предполагают прежде всего использование слова как источника знаний самого по себе или в сочетании с химическим экспериментом, средствами наглядности и объектами практической деятельности учащихся.
Эвристические методы могут осуществляться при активном участии учителя. В качестве примера можно привести эвристическую беседу о выявлении сравнительной активности галогенов, в которой поиск учащихся постоянно корректируется учителем. Демонстрируя опыт, приливают в раствор иоди-да калия крахмальный клейстер — окраски не наблюдается.
Отдельно в хлорную воду также приливают крахмальный клейстер — окраски тоже нет. Когда же смешивают все три компонента вместе — иодид калия, крахмальный клейстер и хлорную воду, крахмал синеет. Далее учитель ведет беседу по анализу данного опыта.
При исследовательском методе также возможна разная степень самостоятельности и сложности задачи исследования. Ученическое исследование, как и научное, сочетает в себе использование теоретических знаний и эксперимента, требует умения моделировать, осуществлять мысленный эксперимент, строить план исследования, например, при решении экспериментальных задач. В более сложных случаях при исследовательском методе ученик сам формулирует проблему, выдвигает и обосновывает гипотезу и разрабатывает эксперимент для ее проверки. Для этого он пользуется справочной и научной литературой и т. д. Таким образом, при исследовательском методе от учащихся требуется максимум самостоятельности. Вместе с тем при использовании такого метода требуется значительно больше времени.
3) пер.зак. 4 группа 9 класс
В настоящее время Периодический закон Д. И. Менделеева имеет следующую формулировку: «свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов».
Переодический закон возможности использования ПС в кач ЛОС
1. Опрелять число электронов и протонов в атоме эелементов (порядковый номер)
2. Определять массовое число природной смеси изотопов
А=N1*f1+...
3. Опрелеять атомы каких элементов имеют стабильные изотопы, а какие не имеют(в квадратных скобках указаны радиоактивные элементы
4. определять число электронных слоев, на которых находится электрон Номер периода
5. определять число электронов на внешнем слое номер группы
6. определять высшую положительную и высшее отрицательную сткпень окисления( условный заряд электролита вычисленный из предположения что соединение состоит из простых ионов)
7. Определить валентность элемента( номер группы или 8-томер)
8. опрелелять отношение к металлам или не металлам
9. определять формулу оксидов
10. определять формулу соединений с водородом
11. оценить электроотрицательность
12. оценить проявляет ли вещество простое вещество элемента св-ва окисления и восстановления
13. предположить возможность протекания реакции
14. вещества в пр/пол. Колонках им. Высок.хим. Сродства
X= ЭО=1/2(J+E)
Билет №5
Обоснование системы содержания курса химии в 9 классе
Предметом
наибольшего внимания авторов программ
и учебников оказался курс химии основной
школы, а именно VIII и IX классов. Этот курс
в дальнейшем именуется базовым. Базовому
курсу предшествуют либо естествознание
с элементами химических знаний, либо
пропедевтический курс химии. И
естествознание в V—VI классах, и
пропедевтические курсы в VII классе можно
считать сравнительно новым явлением в
школе. Правда, естествознание уже в
течение ряда лет проходило экспериментальную
проверку по инициативе проф. А. В.
Тарасова, а также акад. А. Г. Хрипковой,
проф. И. Т. Суравегиной, проф. А. И.
Захлебного. Но пропедевтические курсы
и сейчас еще не везде получили признание.
Базовый курс создает основу для изучения
химии на старшей ступени обучения (X—XI
классы). Систему курсов химии по ступеням
обучения с учетом углубленности и
профильности можно выразить схемой.
Главным ядром в системе является базовый
курс VIII—IX классов.Его особенность в
том, что в учебник IX класса включены
некоторые сведения по органической
химии. Этот курс достаточно традиционен,
что объясняет наилучшую обеспеченность
его программами и учебниками.
Исследовательский метод в преподавании химии
В исследовательском методе возможна разная степень самостоятельности и сложности задачи исследования. Ученическое исследование, как и научное, сочетает в себе использование теоретических знаний и эксперимента, требует умения моделировать, осуществлять мысленный эксперимент, строить план исследования, например, при решении экспериментальных задач. В более сложных случаях при исследовательском методе ученик сам формулирует проблему, выдвигает и обосновывает гипотезу и разрабатывает эксперимент для ее проверки. Для этого он пользуется справочной и научной литературой и т. д. Таким образом, при исследовательском методе от учащихся требуется максимум самостоятельности. Вместе с тем при использовании такого метода требуется значительно больше времени.
Методика изложения понятия «кислоты» в 8 классе- определение, классификация, получение, свойства
Кисло́ты — сложные вещества, в состав которых обычно входят атомы водорода, способные замещаться на атомы металлов, и кислотный остаток. Водные растворы кислот имеют кислый вкус, обладают раздражающим действием, способны менять окраску индикаторов, отличаются рядом общих химических свойств.
При обычных условиях кислоты могут быть твердыми (фосфорная. Кремневая) и жидкими ( серная). Такие газы, как хлороводород и бромоводород, в водных растворах образуют кислоты. Кислоты угольная H2CO3 и сернистая H2SO3 существуют только в водных растворах, так как являются слабыми и нестойкими. Они легко разлагаются на оксиды углерода (IV) и серы(IV) и воду. Выделить эти кислоты в чистом виде невозможно. Летучими называют кислоты, молекулы которых легко переходят в газообразное состояние, например соляная кислота. Водные растворы соляной, азотной, серной, фосфорной и других кислот не имеют окраски. Водные растворы хромовой кислоты H2CrO4 имеют желтую окраску, марганцевой кислоты HMnO4 – малиновую. Однако, все они образуют при диссоциации катионы водорода, которые обуславливают общие свойства: кислый вкус, изменение окраски индикатора.
Классификация кислот

Типичные реакции для кислот:
Кислота + основание = соль + вода (реакция обмена)
Протекает между любыми кислотами и основаниями. Например, со щелочью (реакция нейтрализации):
HCl +NaOH = NaCl + H2O или H+ + OH- = H2O
2HNO3 + Fe(OH)2 = Fe(NO3)2 + 2H2O или 2H+ + Fe(OH)2 = Fe2+ + 2H2O
Кислота + оксид металла = соль + вода (реакция обмена)
Протекает между оксидами металлов и большинством кислот:
CuO + H2SO4 = CuSO4 + H2O или CuO + 2H+ = Cu2+ + H2O
Кислота + металл = соль + водород (реакция замещения)
Чтобы реакция прошла необходимо соблюдение некоторых условий:
В ряду напряжения металлов элемент должен находиться до водорода:
Zn + 2HCl = ZnCl2 + H2 или Zn0 + 2H+ = Zn2+ + H20 , а между Cu и HCl – невозможна.
В продуктах должна быть растворимая соль
Pb + H2SO4 = PbSO4 + H2
Нерастворимый сульфат свинца (II) прекращает доступ кислоты к металлу и реакция прекращается.
Характерна для растворов кислот, поэтому нерастворимые кислоту с металлами не реагируют
Концентрированный раствор серной и азотной кислот реагирут с металлами несколько иначе.
4Mg + 5H2SO4(к) = 4MgSO4 + H2S + 4H2O
3Zn + 4H2SO4(к) = 3ZnSO4 + S + 4H2O
Cu + 2H2SO4(к) = CuSO4 + SO2 + 2H2O
Pb + 3H2SO4(к) = H2[Pb(SO4)2] + SO2 + 2H2O или Pb(HSO4)2
Sn + 4HNO3(к) = H2SnO3 + 4NO2 + H2O
2Sb + 10HNO3(к) = Sb2O5 + 10NO2 + 5H2O
Os + 8HNO3(к) = OsO4 + 8NO2 + 4H2O
3Re + 7HNO3(к) = 3HReO4 + 7NO2 + 2H2O
Кислота + соль = новая кислота + новая соль (реакция обмена)
Протекает только в случае образования осадка, газа или воды:
H2SO4 + BaCl2 = BaSO4 + 2HCl
Способы получения кислот
1)Взаимодействие кислотного оксида с водой
SO3 + H2O = H2SO4
2) Вытеснение летучих кислот
2NaCl + H2SO4(конц) = Na2SO4 + 2HCl
3) Взаимодействие соли и кислоты с образованием нерастворимой соли
BaCl2 + H2SO4 = BaSO4 + 2HCl
4) Взаимодействие водорода с элементом с образованием бескислородной кислоты
H2 + S = H2S
5) Комплексные кислоты
Au + HNO3 + 4HCl = H[AuCl4] + NO + 2H2O
SnCl4 + 2HCl = H2[SnCl6]
Билет №6
Обоснование системы содержания курса химии в 10 классе

На старшей ступени обучения (X—XI классы), где реализуется принцип концентризма. Не отвергая другие дидактические принципы, принцип концентризма приобретает особое значение в связи с переходом на обязательное девятилетнее.
Методы и средства обучения

Методы обучения химии — сложная категория; через них устанавливается связь между химическим содержанием и процессом его усвоения учащимися.
Средства обучения образуют три большие группы, которые различают между собой по своему назначению и способу воздействия на учащихся:
пособия для учителя — общественно-политическая, методическая, научно-популярная и другая литература — воздействует на учащихся опосредованно через учителя;
— оборудование школьного кабинета предназначено для непосредственного обеспечения учебно-воспитательного процесса; оно оказывает прямое воздействие на учащихся во время уроков и внеурочных занятий;
— учебник химии — средство обучения, которым ученик пользуется индивидуально в школе и дома.
Все эти компоненты тесно связаны между собой, и в отсутствие любого из них невозможен полноценный процесс обучения химии.
В последние годы появились и другие средства индивидуального обучения: рабочие тетради, компьютерные программы, видеокассеты с учебным содержанием и др.
Среди многочисленных средств обучения, используемых в учебно-воспитательном процессе, центральное место занимает учебник, которым учащийся пользуется самостоятельно. В учебнике содержится полный объем материала, необходимого для усвоения программы, а также некоторые методы и средства обучения. На этом основании учебник называют обучающей системой, выполняющей образовательную, воспитывающую, развивающую функции.
Формирование у учащихся умения работать с учебником — одна из важнейших задач учителя химии.
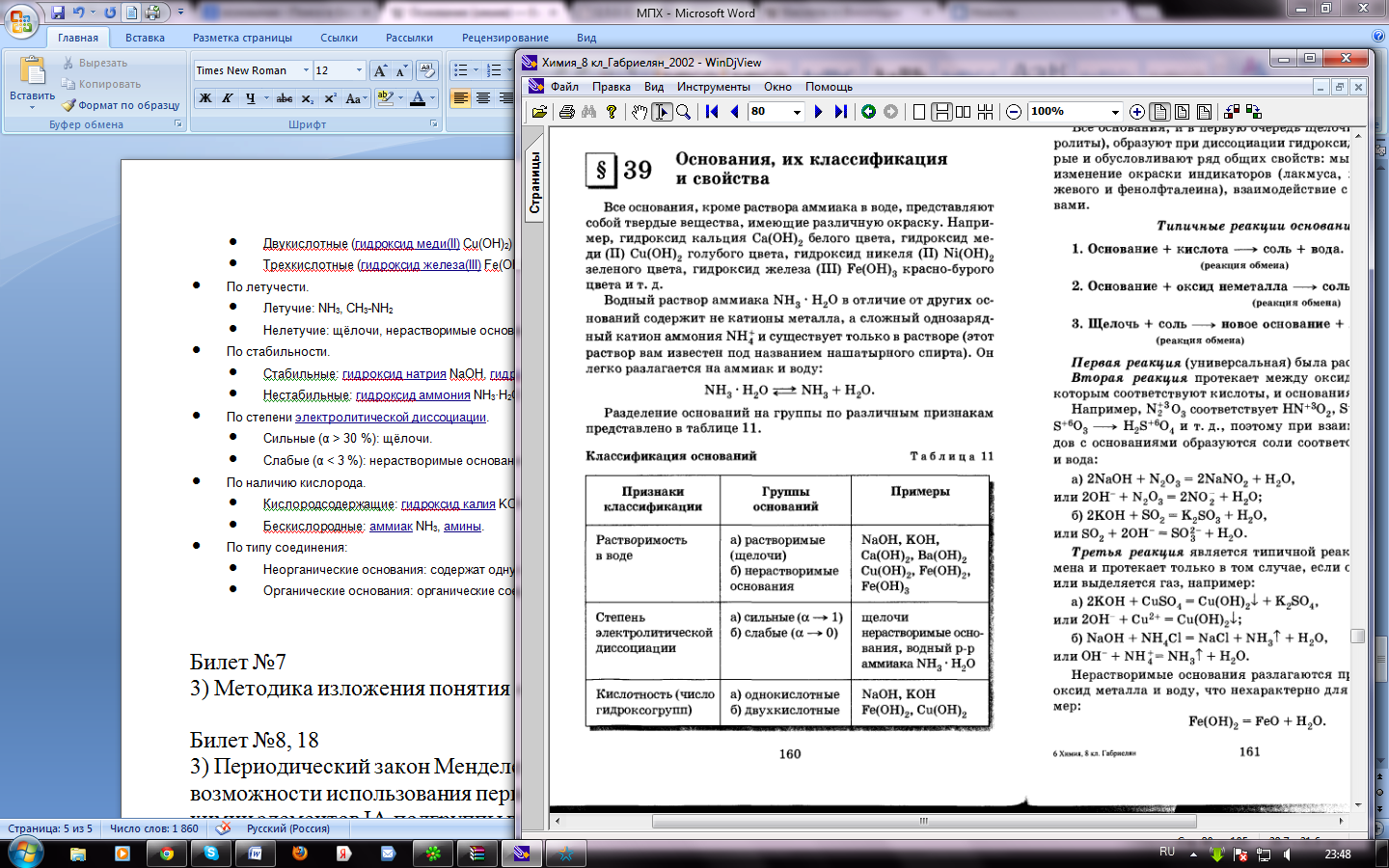
Методика изложения понятия «основание» в 8 классе- определение, классификация, получение, свойства
Основания (осно́вные гидрокси́ды) — сложные вещества, которые состоят из атомов металла или иона аммония и гидроксогруппы (-OH). В водном растворе диссоциируют с образованиемкатионов и анионов ОН−. Название основания обычно состоит из двух слов: «гидроксид металла/аммония». Хорошо растворимые в воде основания называются щелочами.
Классификация
Получение
Взаимодействие сильноосновного оксида с водой позволяет получить сильное основание или щёлочь: CaO + H2O = Ca(OH)2
Слабоосновные и амфотерные оксидыс водой не реагируют, поэтому соответствующие им гидроксиды таким способом получить нельзя.
Гидроксиды малоактивных металлов получают при добавлении щелочи к растворам соответствующих солей. Так как растворимость слабоосновных гидроксидов в воде очень мала, гидроксид выпадает из раствора в виде студнеобразной массы: CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Также основание можно получить при взаимодействии щелочного или щелочноземельного металла с водой: Ca + 2H2O = Ca(OH)2 + H2
Гидроксиды щелочных металлов в промышленности получают электролизом водных растворов солей: 2NaCl + 2H2O = 2NaOH + H2 + Cl2
Некоторые основания можно получить реакциями обмена: Li2SО4 + Ba(OH)2 = 2LiOH + BaSO4
Основания металлов встречаются в природе в виде минералов, например: гидраргиллитаAl(OH)3, бруситаMg(OH)2.
Химические свойства:
В водных растворах основания диссоциируют, что изменяет ионное равновесие:
NaOH = Na+ + OH-
это изменение проявляется в цветах некоторых кислотно-основных индикаторов:
лакмус становится синим,
метилоранж — жёлтым,
фенолфталеин приобретает цвет фуксии.
Основание + кислота = соль + вода (реакция обмена)
Протекает между любыми кислотами и основаниями. Например, со щелочью (реакция нейтрализации):
HCl +NaOH = NaCl + H2O или H+ + OH- = H2O
2HNO3 + Fe(OH)2 = Fe(NO3)2 + 2H2O или 2H+ + Fe(OH)2 = Fe2+ + 2H2O
Основание + оксид металла = соль + вода (реакция обмена)
Протекает между оксидами неметаллов, которым соответствуют кислоты, и основаниями. Например, N2+3O3 соответствует HN+3O2, S+4O2 – H2S+4O3, S+6O3 – H2S+6O4 и т.д., поэтому при взаимодействии оксидов с основаниями образуются соли соответствующих кислот и вода:
а) 2NaOН + N2O3 = 2NaNO2 + H2O
или 2OH- + N2O3 = 2NO2- + H2O
б) 2KOH + SO2 = K2SO3 + H2O
или SO2 + 2OH- = SO32- + H2O
Щелочь + соль = новое основание + новая соль (реакция обмена)
Типичная реакция ионного обмена, протекает только в том случае, если образуется осадок или выделяется газ:
а) 2KOH + CuSO4 = Cu(OH)2 + K2SO4,
или 2OH- + Cu2+ = Cu(OH)2
б) NaOН + NH4Cl = NaCl + NH3 + H2O,
или OH- + NH4+ = NH3 + H2O
Нерастворимые основания разлагаются при нагревании на оксид металла и воду, что нехарактерно для щелочей, например:
Fe(OH)2 = FeO + H2O
Билет №7
Анализ структуры государственной программы по химии
Современное содержание школьного курса химии получило научное обоснование в работах крупнейших отечественных методистов: В. Н. Верховского, П. П. Лебедева, Ю. В. Ходакова, С. Г. Шаповаленко, Л. А. Цветкова, И. Н. Черткова, Е. Е. Минченкова, А. Д. Смирнова, Г. И. Шелинского, Н. Е. Кузнецовой, В. П. Гаркунова.
Во всех курсах можно выделить определенный набор дидактических единиц, составляющих структуру курса.
1. Законы и теории. Периодический закон и периодическая система элементов Д. И. Менделеева. Атомно-молекулярное учение. И т.д.
2. Понятия. Вещество. Хим элемент. Хим реакция. Хим производство.
3. Факты.
4. Методы химической науки.
Химия — это наука экспериментально-теоретическая. Изучение веществ и процессов в этой области основано на анализе фактов, полученных в результате эксперимента, и их теоретическом объяснении и обобщении. Если факты можно объяснить на основе уже имеющихся законов и теорий, то они служат подкреплению этих законов и теорий.
При попытках объяснить факты ученые выдвигают гипотезы, которые затем проверяются экспериментом. Если экспериментальные данные подтверждают гипотезу, она превращается в теорию. Теория существует до тех пор, пока не накопятся многочисленные факты, противоречащие ей. Тогда возникает новая теория.
В школьном курсе химии также должна найти отражение сущность научных химических методов, в связи с чем предусмотрено формирование определенных групп умений, позволяющих приобщить учащихся к пониманию пути химического исследования:
1) проверка выдвинутой гипотезы экспериментом, вывод, теоретическое осмысление, использование в практике;
2) приобретение умений работать с посудой, материалами, ре-активами, инструментами, приборами, освоение приемов, операций, манипуляций, техники химического эксперимента;
3) освоение химической символики, методов моделирования веществ и процессов.
5. Вклад в науку выдающихся химиков.
Очень важно для учеников понять, что наука делается людьми и требует больших знаний и затрат интеллектуальной энергии. Одновременно они должны понимать, какое огромное удовлетворение приносит успех в науке
Теперь рассмотрим связи между конкретными компонентами содержания.
Важнейшие химические теории, разработанные в разные исторические периоды развития науки, связаны между собой через понятия. Это находит отражение в структуре содержания школьного курса химии.
В школьном курсе химии — пять основных теоретических концепций:
— атомно-молекулярное учение;
— периодический закон, периодическая система элементов Д. И. Менделеева и теория строения вещества;
— теория электролитической диссоциации;
— закономерности возникновения и протекания химических реакций;
— современная теория строения органических веществ.
Каждая из этих концепций представляет собой своеобразный рубеж, проходя через который, важнейшие понятия претерпевают качественные изменения, развиваются и совершенствуются. Это может быть выражено схемой 1.1,* из которой видно, что теории связываются между собой через понятия. Структура содержания школьного курса химии.

Основные химические понятия также тесно связаны между собой. При этом, как показано на схеме 1.2., ведущими являются понятия «вещество» и «химическая реакция». Именно этим понятиям принадлежит решающая роль при построении содержания различных курсов химии.
Отбор необходимых фактов для изучения химии превращается в сложную проблему. Постоянное стремление уменьшить описательный материал в курсе химии в пользу теоретического таит опасность недооценки фактов, а это может привести к догматическому изложению теорий, нанести ущерб формированию диалектико-материалистического мировоззрения. Но избыток фактов при недостаточном теоретическом анализе
Формы организации обучения в современной школе
В современной дидактике организационные формы обучения, включая обязательные и факультативные, классные и домашние занятия, подразделяют на фронтальные, групповые и индивидуальные.
При фронтальном обучении учитель управляет учебно-познавательной деятельностью всего класса, работающего над единой задачей.
При групповых формах обучения учитель управляет учебно-познавательной деятельностью групп учащихся класса. Оно есть не что иное, как самостоятельное выполнение одинаковых для всего класса или группы заданий.
Индивидуальное обучение учащихся не предполагает их непосредственного контакта с другими учениками. Предполагается использование опорных конспектов.
В современной общеобразовательной практике чаще всего используются две общие организационные формы: фронтальная и индивидуальная. Урок как основная форма обучения. С позиции целостности образовательного процесса основной организационной формой обучения является урок. В нем отражаются преимущества классно-урочной системы обучения, которая при массовости учащихся обеспечивает организационную четкость и непрерывность учебной работы. Знание учителем индивидуальных способностей учащихся и учащимся друг друга позволяет с большим эффектом использовать стимулирующее влияние классного коллектива на учебную деятельность каждого ученика. Неоспоримым ее преимуществом является возможность в рамках урока ограничено соединить фронтальные, групповые и индивидуальные формы обучения. Можно выделить следующие функции форм организации обучения: 1. Обучающе-образовательная, 2. Воспитательная, 3. Организационная, 4. Психологическая, 5. Развивающая, 6. Интегрирующее- дифференцирующая, 7. Систематизирующая и структурирующая, 8. Комплексирующая и координирующая, 9. Стимулирующая. Функции форм обучения сложны и многообразны. Среди них на первом месте обучающе-образовательная. Форма обучения конструируется и используется для того, чтобы создать наилучшие условия для передачи детям знаний, умений, навыков, формированию их мировоззрения, развития дарований, практических способностей, активного участия в производстве и общественной жизни.
Методика изложения понятия «соли» в 8 классе
Соли — класс химических соединений, состоящих из катионов и анионов.
В роли катионов в солях могут выступать катионы металлов, ониевые катионы (катионов аммония NH4+, фосфония PH4+ , гидроксония H3O+ и их органические производные), комплексные катионы и т.д., в качестве анионов — анионы кислотного остатка различных кислот Бренстеда - как неорганических, так и органических, включая карбанионы, комплексные анионы и т.п.
Типы солей
Средние (нормальные) соли — все атомы водорода в молекулах кислотызамещены наатомыметалла. Пример: Na2CO3, K3PO4 , .
Кислые соли — атомы водорода в кислоте замещены атомами металла частично. Они получаются при нейтрализации основания избытком кислоты. Пример: NaHCO3, K2HPO4.
Основные соли — гидроксогруппы основания (OH−) частично замещены кислотными остатками. Пример: (CuOH)2CO3.
Двойные соли — в их составе присутствует два различных катиона, получаются кристаллизацией из смешанного раствора солей с разными катионами, но одинаковыми анионами. Пример: KAl(SO4)2*12H2O .
Смешанные соли — в их составе присутствует два различных аниона. Пример: Ca(OCl)Cl .
Гидратные соли (кристаллогидраты) — в их состав входят молекулы кристаллизационнойводы. Пример: Na2SO4*10H2O .
Комплексные соли — в их состав входит комплексный катион или комплексный анион. Пример:K3[Fe(CN)6], [Cu(NH3)4](OH)2.
Особую группу составляют соли органических кислот, свойства которых значительно отличаются от свойств минеральных солей. Некоторые из них можно отнести к особенному классу органических солей, так называемых ионных жидкостейили по-другому «жидких солей», органических солей с температурой плавления ниже 100 °C.
Методы получения
1.С использованием металлов
-) металл+неметалл Mg+Cl2=MgCl2
-) металл+кислота Zn+2HCl=ZnCI2+H2
-) металл+соль Fe+CuSO4=FeSO4+Cu
2.С использованием оксидов
-) основной оксид+кислота CaO+2HCl=CaCl2+H2O
-) кислотный оксид+основание CO2+Ca(OH)2=CaCO3+H2O
-) кислотный+основной оксиды CaO+CO2=CaCO3
-) основной+амфотерный оксиды Al2O3+CaO=Ca(AlO2)2
3.Реакция нейтрализации
-) кислота+основание H2SO4+2NaOH=Na2SO4+2H2O
4.Из солей
-) соль+соль AgNO3+NaCl=AgCl+NaNO3
-) соль+щелочь CuSO4+2NaOH=Cu(OH)2+Na2SO4
-) соль+кислота Na2CO3+2HCl=2NaCl+H2O+CO2
4. Кислые соли получают такими же способами, что и средние, но при других мольных соотношениях(при избытке кислоты)
NaOH+H2SO4=NaHSO4+H2O
5. Основные соли образуются при взаимодействии некоторых солей со щелочами (при избытке щелочи)
ZnCl2+NaOH=ZnOHCl+NaCl
Типичные реакции солей.
Соль + кислота = другая соль + другая кислота (реакция обмена)
Na2CO3+2HCl=2NaCl+H2O+CO2
Соль + щелочь = другая соль + другое основание (реакция обмена)
CuSO4+2NaOH=Cu(OH)2+Na2SO4
Соль1 + соль2 = соль3 + соль4 (реакция обмена)
AgNO3+NaCl=AgCl+NaNO3
Соль + металл = другая соль + другой металл (реакция замещения)
Fe+CuSO4=FeSO4+Cu
Разложение при прокаливании
CaCO3=CaO+CO2
Гидролиз солей
CuCl2+H2O = CuOHCl+HCl
Na2CO3+H2O = NaHCO3+NaOH
(NH4)S=2NH4++S2-
NH4++H2O = NH3· H2O+H+
S2-+H2O = HS-+OH-
Al2S3+6H2O=2Al(OH)3+3H2S
Билет №8
Воспитание обучающихся в процессе обучения химии.
Ведущая роль в воспитывающем обучении отводится формированию у учащихся диалектико-материалистического мировоззрения. Мировоззрение всегда формируется в действии. Учебный предмет поставляет ученику информацию, а философские взгляды формируются в процессе самостоятельной деятельности учащихся по усвоению и применению мировоззренческих идей. Учитель должен организовать эту деятельность так, чтобы она способствовала проявлению и корректировке имеющихся убеждений. Процесс формирования мировоззрения – это прежде всего процесс формирования мышления. Осознанность восприятия, понимание изучаемого – первое важное условие формирования научных взглядов. Учащиеся должны научиться обобщать, систематизировать, экстраполировать, видеть проблему и намечать пути ее решения, устанавливать межпредметные связи. Они способствуют развитию широты взглядов, формированию сначала химической, а затем и естественнонаучной картины мира, возникновению потребности объяснить явления с материалистических позиций. Химия, как и все другие предметы, должна поставлять материал для широких философских обобщений. Вместе с тем знание исходных принципов и представлений материалистической диалектики позволяет лучше понять взаимосвязь химических явлений, движущие силы и закономерности химических процессов. Легко устанавливаются межпредметные связи с биологией: биологическая роль химических элементов, физиологическое действие веществ, а также тесная связь органических веществ с биологическими объектами. Важное мировоззренческое значение имеет рассмотрение круговорота отдельных элементов (азота, углерода) в природе. Здесь особенно легко установить межпредметную связь с биологией и подчеркнуть идею неисчезаемости материи. Межпредметные связи с биологией устанавливаются и при постановке вопросов охраны окружающей среды и т. д. Межпредметные связи с географией могут быть осуществлены через изучение природных соединений отдельных элементов и их месторождений. С физикой межпредметные связи особенно тесные. Они устанавливаются через систему понятий о строении вещества и его свойствах, при изучении сущности процессов, общих для физики и химии законов (закон сохранения и превращения энергии, периодический закон Д. И. Менделеева), при ознакомлении с терминологией, системой единиц и т. д. С математикой связь легко осуществляется при решении расчетных задач, а также при построении всевозможных графиков. Однако просматривается и более глубокая связь с математикой, осуществляющаяся посредством использования в химии рациональных приемов мышления, которые формируются в процессе обучения математике. С историей связь устанавливается при рассмотрении развития химических производств и разнообразных исторических фактов. Химия располагает большими возможностями в воспитании у учащихся неприятия алкоголизма, наркомании и токсикомании. Если это делается на основе межпредметных связей с биологией, физиологией, то резко возрастает убедительность воспитательных воздействий. Учитель пользуется всеми возможностями для того чтобы убедить учащихся бережно относиться к своему здоровью, а не только к окружающей среде. Воспитательная функция химии реализуется не только на уроках, но и особенно широко на внеклассных занятиях. Межпредметные связи являются объективным отражением взаимосвязей в науке и, следовательно, выражают их специфику. Осуществлению межпредметных связей помогает экологическое воспитание. В условиях личностно-ориентированного обучения экологическое воспитание занимает особое место, так как играет важную роль в формировании личности. Учитель химии подходит к этому вопросу с двух сторон: 1) раскрывает роль химических процессов в жизнедеятельности живых организмов и в неживой природе; в этом случае отмечается положительная роль химии в жизни живой природы; 2) показывает, насколько губительно необдуманное вторжение химии в окружающую нас среду и к каким тяжелым последствиям это может привести. Такой подход воспитывает бережное, гуманное отношение к природе, стремление к приобретению химических знаний о природных процессах и факторах, которые могут на них повлиять. Содержание экологических знаний по химии, используемых в разных темах курса химии, частично разработано. Очень важно воспитывать в учащихся активных борцов за сохранность окружающей их природы, пробудить желание к активной деятельности по охране окружающей среды. Мероприятия по природоохранной тематике полезно проводить совместно с учителями других предметов — биологии, географии, истории, литературы. Работа по охране окружающей среды имеет эстетическую и патриотическую направленность. Формированию мировоззрения способствует и методологизация обучения. Важно показывать учащимся, что наука «делается» людьми, хорошо образованными, творческими, владеющими методологией науки. Для этого важно доводить до сведения учащихся не только сами научные достижения, но и методы, которыми они были получены. Желательно по возможности приобщать учащихся к работе если не совсем исследовательской, то хотя бы по характеру выполняемых действий моделирующей действия ученого. Особое значение приобретает при этом изучение творческих биографий ученых, достижения которых — результат большого труда. На таких примерах полезно приучать школьников преодолевать трудности, ответственно относиться к учебному труду, что как известно, главное требование трудового воспитания. Важным условием трудового воспитания является формирование практических умений и навыков, ознакомление с принципами современного химического производства, с химизацией сельского хозяйства, приобретение умения проводить химический эксперимент, пользуясь для этого посудой, материалами, инструментами, реактивами, производить химические расчеты при помощи вычислительной техники, организовывать свой труд. Проблема трудового воспитания реализуется при помощи деятельности учащихся на уроках, в основе которой лежит самостоятельная работа. Учебный труд должен способствовать воспитанию коллективизма, сотрудничества и взаимопомощи. На это направлена и технология сотрудничества, широко освещавшаяся в педагогической прессе в 80-е годы как опыт учителей-новаторов. Коллективный труд и взаимопомощь определяют одновременно и нравственную атмосферу урока, способствуя нравственному воспитанию учащихся, формируют любовь и уважение к труду. Нельзя не использовать в воспитательной работе на уроках химии и памятные даты (не случайно они регулярно публикуются в методической печати), посвященные великим открытиям или выдающимся химикам, работы которых составляют гордость химической науки и современной цивилизации.
Пути повышения эффективности методов и приемов обучения
Эффективность процесса обучения прежде всего зависит от организации деятельности учащихся. Поэтому педагог стремится самыми разнообразными приемами активизировать эту деятельность, и потому наряду с понятием «методы обучения» мы употребляем и понятие «приемы обучения».
Приемы могут определяться особенностями обучающей системы: при проблемном обучении это постановка проблемных ситуаций, при объяснительно-иллюстративном – это подробное планирование действий учащихся для достижения конкретных целей и т.п.
Метод обучения — это вид (способ) целенаправленной совместной деятельности учителя и руководимых им учащихся.
Главной задачей учителя является оптимальный выбор ме¬тодов обучения, чтобы они обеспечивали образование, воспитание и развитие учащихся.
Система работы по повышению эффективности обучения химии:
Этап концептуализации и параметризации образовательной деятельности по предмету(;
Диагностико-прогностический этап(конкретизации целей учебных занятий;определения индивидуальных образовательных задач;сравнения конечных результатов с уровнем обучаемости школьников.);
Этап целеполагания(Цель – это ожидаемый, желаемый, прогнозируемый результат деятельности. Поставленная цель будет служить ориентиром в отборе основного содержания, методов, средств обучения, форм организации познавательной деятельности учащихся.);
Этап планирования(Отбор содержания материала каждого раздела и распределение его по темам осуществляется на основе работы с учебной программой и стандартами образования по предмету(распределение темы и количество часов на тему));
Этап конструирования и реализации учебных занятий (Повышению эффективности обучения химии способствуют:
1. Уроки(изучения нового материала-формы деятельности: беседа, самостоятельная работа с книгой, групповая работа или работа в парах; уроках повторения, закрепления знаний- элементы содержания и виды деятельности, которыми должны владеть учащиеся; уроки-практикумы по решению экспериментальных задач; уроки-практикумы по решению расчетных задач уроках систематизации и обобщения знаний, а тем более во время контрольной работы Урок создание проекта и урок-защита проекта).
2. Элективные (групповые) занятия – обединяют и помогают научить одноклассинок объяснять друг другу и следовательно подтянуть отстающих; ликвидация пробелов в знаниях и устранение типичных ошибок).
3. Индивидуальные занятия, консультации (индивидуальная форма работы с каждыи учеником, напрявленная на выявление и устранение индивидуальной проблемы учащегося и/или устранение проелов по причине отсутствия на занятиях или продготовка к олимпиадам)).
4. Пробный экзамен(репетиция ответственного и психологичечской ситуации
Домашняя подготовка. – (чередование и/или совместное использование) самоконтроля и взаимоконтроля необходимо предлагать ученикам рефлексировать свои затруднения.)
Контрольно-регулировочный этап - Для повышения эффективности обучения химии целесообразно после освоения стержневых тем проводить поверку и оценку знаний, а также способов деятельности. В связи с этим в конце каждой крупной темы проводятся контрольные работы. Мы используем контрольные работы, разработанные авторами программы и учебников.;
Этап рефлексии – (скорость воспроизведения изученного материала и желание изучать его дальше).
Качество обучения зависит от того, насколько основательно и обоснованно выполняется тематическое и поурочное планирование.
Периодический закон Менделеева в современной формулировке. Проиллюстрировать возможности использования периодического закона и периодической системы на примере изучения химии элементов IA подгруппы в 9 классе
Периодический закон был сформулирован Д. И. Менделеевым в следующем виде (1871): «свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
В настоящее время Периодический закон Д. И. Менделеева имеет следующую формулировку: «свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов».
Переодический закон возможности использования ПС в кач ЛОС
1. Опрелять число электронов и протонов в атоме эелементов (порядковый номер)
2. Определять массовое число природной смеси изотопов
А=N1*f1+...
3. Опрелеять атомы каких элементов имеют стабильные изотопы, а какие не имеют(в квадратных скобках указаны радиоактивные элементы
4. определять число электронных слоев, на которых находится электрон Номер периода
5. определять число электронов на внешнем слое номер группы
6. определять высшую положительную и высшее отрицательную сткпень окисления( условный заряд электролита вычисленный из предположения что соединение состоит из простых ионов)
7. Определить валентность элемента( номер группы или 8-томер)
8. опрелелять отношение к металлам или не металлам
9. определять формулу оксидов
10. определять формулу соединений с водородом
11. оценить электроотрицательность
12. оценить проявляет ли вещество простое вещество элемента св-ва окисления и восстановления
13. предположить возможность протекания реакции
14. вещества в пр/пол. Колонках им. Высок.хим. Сродства
X= ЭО=1/2(J+E)
В 1 группе главной подгруппе элементы с валентностью 1, и СО +1, 0. Гидроксиды имеют вид ЭОН, способны образовывать оксиды Э2О, гидриды ЭН.
В главных подгруппах с увеличением порядкового номера:
1) Усиливаются металлические свойства
2) Ослабевают неметаллические свойства
3) Высшая валентность равна номеру группы.
4) атомный радиус - в подгруппе сверху вниз возрастает;
5) энергия ионизации - в подгруппе уменьшается;
6) электроотрицательность - в подгруппе уменьшается
Элементы, атомы которых обладают сходными по строению электронными оболочками, попадают в одну подгруппу периодической системы. У всех элементов главных подгрупп электронами заполняется внешний электронный слой, причём число электронов на этом слое равно номеру группы. У элементов I и II групп электронами заполняется s–подуровень, поэтому они называются s–элементами. У элементов III - VIII групп происходит заполнение р-подуровня, поэтому эти элементы относятся к семейству р-элементов. У элементов побочных подгрупп происходит заполнение электронами d–подуровня предпоследнего слоя, а у лантаноидов и актиноидов f- -подуровня предпредпоследнего слоя.
Свойства элементов определяются их строением. Элементы, имеющие на последнем слое 1 – 2 электрона являются металлическими, 2 – 5 электронов – переходными, 4 – 8 электронов – неметаллическими.
В 1 группе главной подгруппе находятся щелочные металлы, такие как Li, Na, K, Rb, Cs, Fr. Франций (Fr) является элементом, в котором наиболее выражены металлические свойства. При увеличении порядкового номера по группе, наблюдается увеличение размера атома, так как с каждым поледующим периодом увеличивается количество энергетических уровней, однако реакционная способность атома падает.
Эти элементы являются s-элементами, на внешнем энергетическом уровне 1 электрон, поэтому:
Me -1̅e = Me+1 + 1̅e
В группе степень ионизации уменьшается, следовательно уменьшается способность отдавать электрон – увеличивается сродство к нему. Однако, размер атома увеличивается, что обуславливает увеличение реакционной способности:
-) с кислородом
Только литий сгорает на воздухе с образованием оксида стехиометрического состава: 4Li + O2 = 2Li2O
При горении натрия в основном образуется пероксид Na2O2 с небольшой примесью надпероксида NaO2: 2Na + O2 = Na2O2
В продуктах горения калия, рубидия и цезия содержатся в основном надпероксиды: K + O2 = KO2
Для получения оксидов натрия и калия нагревают смеси гидроксида, пероксида или надпероксида с избытком металла в отсутствие кислорода:2Na + 2NaOH = 2Na2O + H2
2Na + Na2O2 = 2Na2O
3K = KO2 = 2K2O
На воздухе цезий мгновенно окисляется с воспламенением, образуя надпероксид CsO2. При ограниченном доступе кислорода окисляется до оксида Cs2O
-) Важное свойство щелочных металлов — их высокая активность по отношению к воде. Наиболее спокойно (без взрыва) реагирует с водой литий:2Li + 2H2O = 2LiOH + H2
При проведении аналогичной реакции натрий горит жёлтым пламенем и происходит небольшой взрыв. Калий ещё более активен: в этом случае взрыв гораздо сильнее, а пламя окрашено в фиолетовый цвет.
Для цезия взаимодействие с водой происходит со взрывом, продуктом взаимодействия являются гидроксид CsOH и водород H2. Цезий вступает в реакцию со льдом (даже при −120 °C), простыми спиртами, галогеноорганическими соединениями,галогенидами тяжёлых металлов, кислотами, сухим льдом.
Билет №9
Развитие мышления учащихся в процессе обучения химии
Осуществляется с помощью проблемного обучения, т.к. мыслить человек начинает лишь тогда, когда у него есть потребность что-то понять, а такая потребность возникает лучше всего в условиях проблемного обучения. Главное проанализировать содержание, чтобы обнаружить в нем проблемы, затем выстроить их в порядке подчинения друг к другу. В этом случае использование проблемного обучения приобретает свойство системности, что очень важно для развития мышления.
Методы закрепления материала в изучении химии
Домашние, доклады, рефераты, исследования, лабораторные работы, факультативы, беседа с учеником, кружки.
Проверочные работы – небольшая работа на занятии чтобы проверить усвоение материала (текуший).
Домашние работа – самостоятельная работа ученика на дому с изученным материалом, чтобы еще раз его закрепить самому «Пропустить через себя».
Самостоятельная работа – это такая познавательная учебная деятельность, когда последовательность мышления ученика, его умственных и практических операций и действий зависит и определяется самим учеником.
Доклады и Рефераты –— письменный доклад или выступление по определённой теме, в котором собрана информация из одного или нескольких источников.
Исследовательская работа – это форма работы, связанная с решением исследовательской задачи и включающая определенные элементы цель, задачи, гипотеза, актуальность и т.д.) в ходе которой, ученик закрепляет материал путем более широкого исследованиятемы.
беседа с учеником – направленная на выявление пробелов в знаниях ученика и удаления их.
факультативные занятия – дополнительные занятия во внеурочное время, направленные на закрепление изученного материала, путем доп заданий и доп объяснения, иногда решение нестандартных или усложненных заданий.
лабы – применение на практике теоретических знаний, отличный способ попрактиковаться и укрепить свои знания. осмыслил теоретическую базу, для формирования личной точки зрения на изучаемый предмет или вопрос, для того, чтобы база аргументов или тезисов по данному вопросу расширилась, для вырабатывания навыков и приемов в профессиональной деятельности.
Методика изложения классификации химических реакций в 8 классе
Превращения веществ, сопровождающиеся изменением их состава и (или) строения, называются химическими реакциями. Часто встречается и такое определение: химической реакцией называется процесс превращения исходных веществ (реагентов) в конечные вещества (продукты).
Химические реакции записываются посредством химических уравнений и схем, содержащих формулы исходных веществ и продуктов реакции. В химических уравнениях, в отличие от схем, число атомов каждого элемента одинаково в левой и правой частях, что отражает закон сохранения массы.
В левой части уравнения пишутся формулы исходных веществ (реагентов), в правой части - веществ, получаемых в результате протекания химической реакции (продуктов реакции, конечных веществ). Знак равенства, связывающий левую и правую часть, указывает, что общее количество атомов веществ, участвующих в реакции, остается постоянным. Это достигается расстановкой перед формулами целочисленных стехиометрических коэффициентов, показывающих количественные соотношения между реагентами и продуктами реакции.
Химические уравнения могут содержать дополнительные сведения об особенностях протекания реакции. Если химическая реакция протекает под влиянием внешних воздействий (температура, давление, излучение и т.д.), это указывается соответствующим символом, как правило, над (или "под") знаком равенства.
Огромное число химических реакций может быть сгруппировано в несколько типов реакций, которым присущи вполне определенные признаки.
В качестве классификационных признаков могут быть выбраны следующие:
1. Число и состав исходных веществ и продуктов реакции.
2. Агрегатное состояние реагентов и продуктов реакции.
3. Число фаз, в которых находятся участники реакции.
4. Природа переносимых частиц.
5. Возможность протекания реакции в прямом и обратном направлении.
6. Знак теплового эффекта разделяет все реакции на: экзотермические реакции, протекающие с экзо-эффектом - выделение энергии в форме теплоты (Q>0, ∆H <0):
С +О2 = СО2 + Q
и эндотермические реакции, протекающие с эндо-эффектом - поглощением энергии в форме теплоты (Q<0, ∆H >0):
N2 +О2 = 2NО - Q.
Такие реакции относят к термохимическим.
Классификация по числу и составу реагентов и конечных веществ
