
- •Неорганическая химия способы выражения состава растворов
- •Практическое занятие.
- •Задачи для самостоятельного решения
- •Задачи для самостоятельного решения
- •Растворы сильных электролитов
- •Коэффициенты активности ионов
- •Задачи для самостоятельного решения
- •Растворы слабых электролитов
- •Задачи для самостоятельного решения
- •Буферные растворы
- •Буферное действие
- •Границы буферного действия
- •Буферная емкость
- •Кривые титрования
- •Произведение растворимости
- •Окислительно-восстановительные реакции
- •Окислители и восстановители
- •Окислители.
- •Окислительно-восстановительные свойства сложныхвеществ
- •Влияние среды реакции.
- •Влияние среды на состав продуктов реакции
- •Влияние концентрации на состав продуктов реакции
- •Водород в реакциях с азотной кислотой практически не выделяется! Реакции серной кислоты
- •Реакции самоокисления-самовосстановления
- •Химическая связь.
- •Ковалентная связь
- •Метод валентных связей
- •Валентность
- •Гибридизация атомных орбиталей и геометрия молекул
- •Метод молекулярных орбиталей
- •Невозможность образования химической связи между атомами He
- •Ионная связь Ионные молекулы существуют только в парах над нагретыми солями. Энергия разрыва ионной связи не определяется энергией притяжения ионов.
- •Потенциальная энергия для однозарядных ионов:
- •Поляризующее действие ионов тем больше, чем меньше радиус и чем устойчивее электронная оболочка иона. Наибольшее поляризующее действие оказывают те ионы, которые слабо поляризуются.
- •Понять механизм восприятия цвета нашими глазами может помочь "круг цветов",
- •Энергия связи
- •1649 КДж/моль. В молекуле метана имеются четыре равноценные связи с-н поэтому средняя энергия такой связи равна
- •При переходе от одинарной связи двойной и тройной (между одними и теми же атомами) энергия связи возрастает, однако связь укрепляется непропорцианально увеличению её кратности.
- •Б)что длина связи уменьшается с возрастанием порядка или кратности связи, а прочность увеличивается с уменьшением длины связи.
- •Окислительно-восстановительные процессы.
- •Комплексные соединения
- •Задачи для самостоятельного решения
- •17. Напишите уравнения окислительно- восстановительных реакций между комплексами:
- •5. Изобразите геометрическую форму ионов: ClO-, ClO3-, ClO4-.
- •Вопросы для подготовки к экзамену
- •Окислительно_восстановительные реакции
Буферное действие
Механизм буферного действия заключается в том, что частицы сопряженного основания реагируют с ионом H3O+, образуя сопряженнуюслабуюкислоту.
В общем виде: H3O++A-=H2O+HA
Например, в случае аммиачной буферной системы имеем: H3O++NH3=NH4++H2O
Ионы же OH-взаимодействуют с сопряженной кислотой, превращая ее в сопряженноеслабоеоснование.
В общем случае: HA+OH-=H2O+A-
В случае той же аммиачной буферной системы: NH4+ + OH- = NH3 + H2O
Границы буферного действия
Границы буферного действия определяются, исходя из значения рК данной буферной системы и отличаются от него в обе стороны не более чем на единицу.
pH = pK ± 1
Буферная емкость
Буферная емкость является количественной характеристикой буферного раствора. Определяются буферная емкость по кислоте (Вк) и буферная емкость по щелочи (Вщ).
Буферная емкость определяется как количество вещества H3O+ (илиOH-) которое надо добавить к 1л данной буферной системы, чтобы его рН изменился на 1. Напомнить студентам, что при добавлении сильной кислоты к буферной системе рН немного уменьшается, а при добавлении щелочи немного увеличивается.
n(H3O+)добавл.n(ОH-)добавл.
Bк = ------------------- Вщ = -------------------
Vбуф.р-ра.|ΔpH|Vбуф.р-ра.|ΔpH|
Пример1. Рассмотреть буферные равновесия в буферной системеNH3-NH4Cl
Решение. Соль диссоциирует на ионы практически полностью:
NH4Cl=NH4+ + Cl-
Ион аммония является слабой катионной кислотой:
NH4++ Н2О ↔NH3 + Н3О+ (1)
Аммиак – нейтральное слабое основание, его протолиз записывается так:
NH3+ Н2О ↔NH4++ ОН- (2)
Уравнения (1) и (2) представляют собой уравнения буферных равновесий. По принципу Ле Шателье равновесие в обоих процессах сильно смещено влево . По этой причине равновесные концентрации аммиака и иона аммония практически равны их начальным концентрациям.
Расчет рН в буферных системах производится с помощью уравнения Гендерсона- Хассельбальха.
a(сопр.осн-я)
pH=pKa+lg-----------------
а(сопр. к-ты)
Аммиак – нейтральная молекула и для него коэффициент активности равен 1. Тогда для данной системы уравнение приобретает вид:
с0(NH3)
pH=pKa+lg-----------------
c0(NH4+).f(NH4+)
Пример 2. Рассчитайте рН раствора, приготовленного смешением 300мл 0,05МKH2PO4 и 200мл 0,1МNa2HPO4.pKa(H2PO4 -/HPO42-)= 7,2.
Решение:
рН
буферного раствора равно: рН = рКа + lg
Определяем ионную силу раствора.
KH2PO4=K++H2PO4-Na2HPO4= 2Na++HPO42-
0,05 0,05 0,05 ( моль) 0,1 0,2 0,1 (моль)
Объём буферного раствора: 300мл + 200мл = 500 мл =0,5л.
Концентрации ионов в буферном растворе равны:
 )=
)= моль/лc(Na
моль/лc(Na )=
)= =
0,08моль/л
=
0,08моль/л
c(H2PO4-)= =
0,03 моль/лc(HPO42-)=
=
0,03 моль/лc(HPO42-)=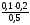 =
0.04 моль/л
=
0.04 моль/л
Ионная сила J= 0,5 ( 0,03·12+ 0,03·12+ 0,08·12+ 0,04·22)= 0,15.
По
таблице находим коэффициенты активности
f ионов.

f(H2PO4-) =0,81.f(HPO42-) = 0,41.Рассчитываем рН данного буферного раствора:
pH= +lg
+lg =
7,03.
=
7,03.
Пример 3.Какие объёмы 0,2М NH3·H2O и 0,1М NH4Cl необходимо взять для приготовления 200 мл буферного раствора с рН=9,54? pKb(NH3·H2O)=4,76.
Ионную силу раствора точно определить заранее нельзя, так как неизвестно количество и концентрация сильного электролита в полученном растворе. Однако можно создать требуемую ионную силу введением инертного электролита типа NaCl, Na2SO4. Для определенности примем ионную силу равную I = 0,1.
Решение:
Коэффициент активности нейтральных молекул можно принять равными 1. Коэффициент активности иона аммония при данном значении ионной силы равен 0,81.
pН
данной буферной системы равно: рН =
рКа(NH4+) +lg
pKa(NH4+)
= 14 – pKb = 14 – 4,76 = 9,24. pH = 9,24 + lg
Предположим, что для приготовления буферного раствора взяли x(л) раствора аммиака. Тогда раствора хлорида аммония будет (0,2 –x)л.
c(NH3·H2O)
=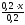 =x(моль/л)c(NH4+)=
=x(моль/л)c(NH4+)= =(0,1-0,5x)
моль/л.
=(0,1-0,5x)
моль/л.
Подставляем полученные данные в уравнение для рН буферной системы:
9,54
= 9,24 + lg lg
lg
 x= 0,0895 (л) =89,5 мл
x= 0,0895 (л) =89,5 мл 90мл.
90мл.
V(NH3·H2O) = 90млV(NH4Cl) = 110мл
Пример 4. а) Рассчитайте рН ацетатной буферной системы, приготовленной смешением 200мл 0,1м СН3СООН и 200мл 0,1М СН3СООNa. рКа(СН3СООН) = 4,76.
б) Рассчитайте рН данной буферной системы после добавления 10мл 1М HClи буферную ёмкость по кислоте.
в) Рассчитайте рН данной буферной системы после добавления
10 мл1М NaOHи буферную ёмкость по щёлочи.
Решение:
а)
рН ацетатной буферной системы равна:
рН= 4,76 + lg
Концентрации буферных кислоты и основания равны:
c(CH3COO-)
= с(СH3COOH)
= моль/л
моль/л
Для определения коэффициента активности определяем ионную силу по концентрации сильного электролита:
J=0,5(0,05
+ 0,05)= 0,05.
Концентрацией ионов, которые даёт слабый электролит – уксусная кислота пренебрегаем ввиду их малости.
Из таблицы находим коэффициенты активности ацетат – иона и иона натрия:f=0,84.
Рассчитываем рН буферной системы:
pН
= 4,76 +lg
б) При добавлении соляной кислоты протекает реакция:
CH3COO- + H3O+ = CH3COOH +H2O,
n(исх) 0,02 0,01 0,02 моль
n(прореаг.) 0,01 0,01 0,01 моль
n(оставш.) 0.01 0 0,03 моль
В растворе было:n(CH3COO-) = 0,05·0,4 = 0,02 моль. Добавилиn(HCl) = 0,01·1 = 0,01моль.
При этом сильная кислота заменяется в эквивалентных количествах на слабую (буферную) кислоту, а буферное основание в эквивалентных количествах уменьшается. (В этом заключается механизм буферного действия).
В результате реакции буферного основания осталось: 0,02 –0,01 = 0,01 моль,
а буферной кислоты стало: 0,02 + 0,01 = 0,03 моль.
Поскольку количество ионов в результате такой реакции не меняется, ионная сила не изменяется и коэффициент активности остаётся прежним.
Тогда
рН = 4,76 + lg
Буферная ёмкость по кислоте равна:
Bк
=
 моль/(л.ед
рН)
моль/(л.ед
рН)
в) При добавлении щёлочи в буферную систему протекает реакция:
CH3COOH+OH-=CH3COO-+H2O
0,02 0,01 0,02 моль
В растворе было: n(CH3COOH) = 0,05·0,4 = 0,02моль. Добавилиn(NaOH) = 0,01·1моль.
При этом сильное основание ОН-заменяется в эквивалентных количествах на слабое (буферное основание), а буферная кислота в эквивалентных количествах уменьшается. В результате реакции буферной кислоты осталось: 0,02 –0,01 = 0,01 моль, а буферного основания стало: 0,02 + 0,01 = 0,03 моль. Поскольку ионная сила не меняется, коэффициент активности остаётся прежним 0,84.
Тогда
рН = 4,76 + lg
Буферная
ёмкость по щёлочи равна: Вщ =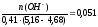 моль/(л.ед.рН)
моль/(л.ед.рН)
Пример 1.Рассчитайте рН раствора, приготовленного смешением 300мл 0,05МKH2PO4 и 200мл 0,1МNa2HPO4.pKa(H2PO4 -)= 7,2.
Решение:
рН
буферного раствора равно: рН = рКа + lg
Определяем ионную силу раствора.
KH2PO4 = K+ +H2PO4- Na2HPO4 = 2Na+ + HPO42-
0,05 0,05 0,05 ( моль) 0,1 0,2 0,1 (моль)
Объём буферного раствора: 300мл + 200мл = 500 мл =0,5л.
Концентрации ионов в буферном растворе равны:
 )=
)= моль/лc(Na
моль/лc(Na )=
)= =
0,08моль/л
=
0,08моль/л
c(H2PO4-)= =
0,03 моль/лc(HPO42-)=
=
0,03 моль/лc(HPO42-)=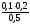 =
0.04 моль/л
=
0.04 моль/л
Ионная сила J= 0,5 ( 0,03·12 + 0,03·12 + 0,08·12 + 0,04·22)= 0,15.
По
таблице находим коэффициенты активности
fионов.

f(H2PO4-) =0,81.f(HPO42-) = 0,41.Рассчитываем рН данного буферного раствора:
pH= +lg
+lg =
7,03.
=
7,03.
Пример 2Какие объёмы 0,2М NH3·H2O и 0,1М NH4Cl необходимо взять для приготовления 200 мл буферного раствора с рН=9,54? pKb(NH3·H2O)=4,76. Ионная сила раствора J= 0,1.
Решение:
Коэффициент активности нейтральных молекул можно принять равными 1,
а f(NH4+) = 0,81 в соответствии с ионной силой.
pН
данной буферной системы равно: рН =
рКа(NH4+) +lg
pKa(NH4+)
= 14 – pKb = 14 – 4,76 = 9,24. pH = 9,24 + lg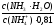
Предположим, что для приготовления буферного раствора взяли x(л) раствора аммиака. Тогда раствора хлорида аммония будет (0,2 –x)л.
c(NH3·H2O)
= =x(моль/л)c(NH4+)=
=x(моль/л)c(NH4+)= =(0,1-0,5x)
моль/л.
=(0,1-0,5x)
моль/л.
Подставляем полученные данные в уравнение для рН буферной системы:
9,54
= 9,24 + lg lg
lg
 x= 0,0895 (л) =89,5 мл
x= 0,0895 (л) =89,5 мл 90мл.
90мл.
V(NH3·H2O) = 90млV(NH4Cl) = 110мл
Пример 3 а) Рассчитайте рН ацетатной буферной системы, приготовленной смешением 200мл 0,1м СН3СООН и 200мл 0,1М СН3СООNa. рКа(СН3СООН) = 4,76.
б) Рассчитайте рН данной буферной системы после добавления 10мл 1М HClи буферную ёмкость по кислоте.
в) Рассчитайте рН данной буферной системы после добавления
10 мл1М NaOHи буферную ёмкость по щёлочи.
Решение:
а)
рН ацетатной буферной системы равна:
рН= 4,76 + lg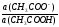
Концентрации буферных кислоты и основания равны:
c(CH3COO-)
= с(СH3COOH)
= моль/л
моль/л
Для определения коэффициента активности определяем ионную силу:
J=0,5(0,05
+ 0,05)= 0,05.
Концентрацией ионов, которые даёт слабый электролит – уксусная кислота пренебрегаем в виду их малости.
Из таблицы находим коэффициенты активности ацетат – иона и иона натрия:f=0,84.
Рассчитываем рН буферной системы:
pН
= 4,76 +lg
б) При добавлении соляной кислоты протекает реакция:
CH3COO- + H3O+ = CH3COOH +H2O,
0,02 0,01 0,01 моль
В растворе было:n(CH3COO-) = 0,05·0,4 = 0,02 моль. Добавилиn(HCl) = 0,01·1 = 0,01моль.
При этом сильная кислота заменяется в эквивалентных количествах на слабую (буферную) кислоту, а буферное основание в эквивалентных количествах уменьшается. (В этом заключается механизм буферного действия).
В результате реакции буферного основания осталось: 0,02 –0,01 = 0,01 моль,
а буферной кислоты стало: 0,02 + 0,01 = 0,03 моль.
Поскольку количество ионов в результате такой реакции не меняется, ионная сила не изменяется и коэффициент активности остаётся прежним.
Тогда
рН = 4,76 + lg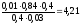
Буферная
ёмкость по кислоте равна: Bк
=
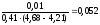 моль/л.
моль/л.
в) При добавлении щёлочи в буферную систему протекает реакция:
CH3COOH + OH- = CH3COO- + H2O
0,02 0,01 0,01 моль
В растворе было: n(CH3COOH) = 0,05·0,4 = 0,02моль. Добавилиn(NaOH) = 0,01·1моль.
При этом сильное основание ОН-заменяется в эквивалентных количествах на слабое(буферное основание), а буферная кислота в эквивалентных количествах уменьшается. В результате реакции буферной кислоты осталось: 0,02 –0,01 = 0,01 моль, а буферного основания стало:
0,02 + 0,01 = 0,03 моль. Поскольку ионная сила не меняется, коэффициент активности остаётся прежним 0,84.
Тогда
рН = 4,76 + lg
Буферная
ёмкость по щёлочи равна: Вщ = моль/л.
моль/л.
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1. Напишите уравнения протолитических равновесии в следующих буферных растворах:
а) уксусная кислота и ацетат натрия;
б) угольная кислота и гидрокарбонат натрия;
в) аммиак и хлорид аммония;
г) дигидрофосфат калия и гидрофосфат натрия.
2. Рассчитайте рН буферного раствора, содержащего 0,01 моль КН2 РО4. и
0,02 моль Na2 НРО4 в 500 мл раствора
[Ка(H3PO4) =7,1 • 10-3,Ка (H2PO4-) = 6,210-8, Kа ( HPO42-) = 5,0 10 –13 ].
Какие реакции будут протекать при добавлении к этому раствору небольшого количества КОН или HNO3 ? Объясните механизм буферного действия.
3. Какие объёмы 0,2 М NH3 и 0,5 М NH4NO3 необходимо взять для
приготовления 200 мл буферного раствора с рН=8,16 [Кв (NH3 H2O) =1,76 10-5]
Вычислите рН после добавления в этому раствору 5 мл 0,2 М НС1 и напишите уравнения протекающих реакций. Плотности растворов считать равными 1,00 г/мл.
4. Рассчитайте молярное соотношение основания и сопряженной кислоты в буферном растворе, содержащем СН3 СООН и СН3 COONa, рН
которого равен 4,86 [Ка(СН3СООН) =1,76 • 10-5 ]. Какова буферная ёмкость этого раствора по кислоте?
