
- •Физическая химия
- •Магнитогорск
- •Расчетно-графическоезадание№1
- •1. Составить уравнение зависимости от температуры величины теплового эффекта и изменения энтропии.
- •2. Вычисление величин , ,и 1пКр при различных температурах и построение графиков в координатах: -т; - т; -т и lпКр-1/т
- •4. Определение количества фаз, независимых компонентов и числа степеней свободы
- •5. Определение возможного направления протекания реакции и равновесного состава газовой смеси
- •6. Установление направления смещения равновесия
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФГБОУ ВПО «МАГНИТОГОРСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ ИМ. Г. И.НОСОВА»
КАФЕДРА ХИМИЧЕСКОЙ ТЕХНОЛОГИИ НЕМЕТАЛЛИЧЕСКИХ МАТЕРИАЛОВ
И ФИЗИЧЕСКОЙ ХИМИИ
 http://www.magtu.ru/index.php?option=com_datsogallery&func=slideshow&catid=103&id=695&format=raw
http://www.magtu.ru/index.php?option=com_datsogallery&func=slideshow&catid=103&id=695&format=raw
Физическая химия
Методические указания
к выполнению расчетно-графического задания № 1
Магнитогорск
2012
Введение
Расчеты
химических равновесий являются важнейшим
этапом рассмотрения
любых металлургических процессов.
Предлагаемое руководство
позволяет на основе термодинамических
характеристик простых
веществ и соединений рассчитать изменения
термодинамических функций
 ,
, ,
, и
далее
и
далее
 для различных химическихпревращений
и определить состав равновесной системы
при различных условиях
протекания процесса. Необходимость
подобных расчетов возникает
на всем протяжении учебного процесса:
в курсах физической химии,
теории металлургических процессов,
специальных курсах, а также в курсовых
научно-исследовательских работах,
курсовых и дипломных проектах.
для различных химическихпревращений
и определить состав равновесной системы
при различных условиях
протекания процесса. Необходимость
подобных расчетов возникает
на всем протяжении учебного процесса:
в курсах физической химии,
теории металлургических процессов,
специальных курсах, а также в курсовых
научно-исследовательских работах,
курсовых и дипломных проектах.
Цель
задания - освоение методики расчета
термодинамических характеристик
химической реакции с помощью таблиц
стандартных термодинамических
величин. При выполнении задания студент
определяет по таблицам необходимые
характеристики компонентов реакции и
находит далее
стандартные изменения энтальпии
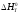 ,
энтропии
,
энтропии
 ,
энергии
Гиббса
,
энергии
Гиббса
 а
затем константы равновесия Кр
. Располагая
этими величинами,
можно определить направление реакции,
ее тепловой эффект при
заданной температуре, оценить выход
продуктов реакции, рассчитать состав
равновесной системы и изменение всех
этих характеристик при изменении
внешних параметров, подобрать оптимальные
условия проведения
процесса.
а
затем константы равновесия Кр
. Располагая
этими величинами,
можно определить направление реакции,
ее тепловой эффект при
заданной температуре, оценить выход
продуктов реакции, рассчитать состав
равновесной системы и изменение всех
этих характеристик при изменении
внешних параметров, подобрать оптимальные
условия проведения
процесса.
1. ФОРМУЛИРОВКА ЗАДАНИЯ
Для реакции протекающей по схеме аА + bВ= сС + dD, где А, В, С, D - вещества - участники реакции (колонки 3, 4, 5, б в табл.1); a,b,c,d -стехиометрические коэффициенты (вариант и номер задания указаны в колонках 1 и 2 табл. 1):
1. Составить
уравнение зависимости от температуры
величины теплового
эффекта
 =
f(T)
и
изменения энтропии
=
f(T)
и
изменения энтропии
 ,
= f(T).
,
= f(T).
2.
Вычислить
величины
 ,
,
 ,
, и
1пКр
при
нескольких температурах,
значения которых задаются температурным
интервалом и шагом
температур (колонки 7 и 9 в табл.1).
Полученные значения свести в таблицу
и построить графики в координатах:
и
1пКр
при
нескольких температурах,
значения которых задаются температурным
интервалом и шагом
температур (колонки 7 и 9 в табл.1).
Полученные значения свести в таблицу
и построить графики в координатах:
 -Т;
-Т;
 - Т;
- Т;
 -Т;
lпКр-1/Т
-Т;
lпКр-1/Т
3. Пользуясь графиком lпКр-1/Т, вывести приближенное уравнение вида lпКр = А/Т + В , где А, В - постоянные.
Используя правило фаз Гиббса, для рассматриваемой системы определить количества фаз, независимых компонентов и число степеней свободы.
Определить возможное направление протекания исследуемой реакции и равновесный состав газовой фазы при заданном давлении и температуре (колонки 14 и 15 в табл.1). При решении из задачи использовать выведенное в первой части эмпирическое уравнение lпКр = А/Т + В и данные об исходном составе газовой фазы (колонки 10,11,12,13 в табл. 1).
6. Установить направление смещения равновесия в рассматриваемой системе при:
а) увеличении давления(при постоянной температуре);
б) увеличении температуры (при постоянном давлении).
2. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ
В
первой части необходимо составить
уравнение зависимости от температуры
величины теплового эффекта
 -
Т
и
изменения энтропии
-
Т
и
изменения энтропии
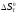 - Т,
a
также
вычислить величины
- Т,
a
также
вычислить величины ,
,
 ,
, и
1пКр
при
нескольких температурах.
и
1пКр
при
нескольких температурах.
3ависимость теплового эффекта реакции от температуры определяется законом Кирхгофа:
 (1)
(1)
 - стандартный
тепловой эффект реакции при 298К;
- стандартный
тепловой эффект реакции при 298К;
∆ср - изменение теплоемкости системы в результате протекания реакции.
Значение
 определяется по закону Гесса:
определяется по закону Гесса:
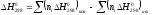 . (2)
. (2)
Изменение теплоемкости ∆ср рассчитывается по уравнению:
 , (3)
, (3)
где сpi – мольная изобарная теплоемкость i-го вещества;
ni – стехиометрический коэффициент i-го вещества в уравнении реакции.
Теплоемкость зависит от температуры по уравнению:
 , (4)
, (4)
где
 - эмпирические коэффициенты.
- эмпирические коэффициенты.
В результате реакции теплоемкость изменяется, а разность теплоемкостей определяется по уравнению:
 , (5)
, (5)
где
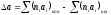 ;
;

 (6)
(6)
Коэффициенты а.b,с' приводятся в справочнике. Изменение энтропии системы в результате протекания процесса определяется по уравнению:
 , (7)
, (7)
где
 - стандартное изменение энтропии для
реакции при 298К.
- стандартное изменение энтропии для
реакции при 298К.
Его
можно определить по мольным стандартным
энтропиям веществ


Значения
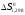 для соответствующих веществ приведены
всправочнике.
для соответствующих веществ приведены
всправочнике.
При расчете изменения стандартной энергии Гиббса для реакции необходимо воспользоваться уравнением Гиббса- Гельмгольца:
 . (9)
. (9)
Константа равновесия связана с изменением стандартной энергии Гиббса соотношением:
 , (10)
, (10)
где R - универсальная газовая постоянная, равная R = 8,31 Дж/мольК;
Т - абсолютная температура.
Во второй части необходимо определить количество фаз, независимых компонентов и число степеней свободы по правилу фаз Гиббса, а также возможное направление протекания исследуемой реакции и равновесный состав газовой смеси; установить направление смещения состояния равновесия рассматриваемой системы.
Количество фаз определяют исходя из определения фазы - это однородная часть гетерогенной системы, с одинаковыми физическими и химическими свойствами, имеющая границы раздела, при переходе через которые свойства системы меняются скачком.
Например, реакция СО(Г) +С12(Г)= СОС1(2Г). Рассматриваемая система состоит из одной фазы (газообразной), которая представляет смесь газов СО(Г) , С12(Г) , СОС1(2Г) .
Или, например, реакция
FeS(TB) + 2HCl(Г) = FeCl2(TB) + H2S(Г).
Рассматриваемая система состоит из трех фаз: двух твердых фаз FeS(TB) и FeCl2(TB) , а также одной газообразной, которая представляет смесь газов 2HCl(Г) и H2S(Г).
Число независимых компонентов k равно наименьшему числу составных частей системы, необходимых для образования всех ее фаз при равновесии. Это число определяют как общее число веществ в системе т за вычетом числа связей между ними r,то есть:
к = т - r. (11)
Число степеней свободы с (вариантность системы) равно наибольшему числу термодинамических параметров (давления, температуры, концентрации компонентов), которые можно изменять в некоторых пределах так, чтобы число и природа фаз в равновесной системе оставались прежними.
Число степеней свободы определяют по правилу фаз Гиббса:
с=n+k-ф (12)
где п - число внешних параметров, влияющих на состояние равновесия системы. Обычно это давление и температура, то есть n=2 .
Для определения возможного направления протекания реакции необходимо воспользоваться уравнением изотермы Вант-Гоффа:
∆G = RТ(lпПр-1пКр), (13)
где П - произведение фактических парциальных давлений газовых компонентов реакции;
Кр – константа равновесия реакции при данной температуре.
В соответствии со вторым законом термодинамики в изобарно-изотермических условиях возможно самопроизвольное протекание процессов, сопровождающихся уменьшением энергии Гиббса системы:
∆G<0. (14)
В применении к химической реакции это означает, что процесс самопроизвольно может идти слева направо при ∆G < 0 и справа налево при ∆G > 0 . Из уравнения (14) следует, что первое условие (∆G < 0 ) выполняется при Пр < Кр а второе( ∆G > 0)-при Пр > Кр .
Равновесный состав газовой смеси рассчитывается при заданной температуре по известной константе равновесия. Рассмотрим эту задачу на пример е реакции
4НС1(Г)+О2(Г)=2Н2О+2Cl2(Г)
Дано: общее давление Р= 0,1атм., исходные количества веществ равны(слева направо) 1,0; 5,0; 2,0; 0,1 молей, Кр = 0,0495.
Пусть при переходе в состояние равновесия прореагировало х молей компонента со стехиометрическим коэффициентом 1, в данном случае кислорода. Запишем под уравнением реакции исходные и равновесные числа молей компонентов:
4НС1(Г)+О2(Г)=2Н2О+2Cl2(Г)
|
nисх |
1,0 |
5,0 |
2,0 |
0,1 |
|
nравн |
1,0 -4х |
5,0-х |
2,0 + 2х |
0,1 + 2х |
Суммарное количество молей газообразных веществ равно
nΣ = 1,0 - 4х + 5,0 – х + 2,0 + 2х + 0,1 + 2х = 8,1 - х
Мольные доли каждого вещества в момент равно веси я равны:
 ;
;
 ;
; ;
;
Умножим каждую мольную долю на общее давление, выраженное в относительных единицах. При этом получим парциальные давления газообразных реагентов (конденсированные вещества при этом не учитываются).
 ;
;
 ;
; ;
;
Равновесный состав газовой смеси определяется из выражения константы равновесия рассчитываемой реакции:

 ,
, ,
,
 -
равновесные парциальные давления О2(Г),
Н2О,
Сl2(Г),
НСl2(Г)
соответственно, выраженные
в относительных единицах.
-
равновесные парциальные давления О2(Г),
Н2О,
Сl2(Г),
НСl2(Г)
соответственно, выраженные
в относительных единицах.
Для нахождения относительного давления следует давление, выраженное в Паскалях, разделить на стандартное давление, равное 101325 Па.
Найдем общее давление, выраженное в относительных единицах:
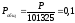 (16)
(16)
Подставим
 ,
, ,
,
 в выражение(15).
в выражение(15).

Учитывая, что Р = 0,1 , можно записать
 (17)
(17)
Это уравнение можно решить любым численным методом, например методом половинного деления. После нахождения корня х можно рассчитать числа молей каждого компонента в состоянии равновесия и мольные доли газообразных реагентов. Это и будет результатом расчета со става равно весной си темы.
Если константа равновесия очень велика или очень мала, то уравнение типа (17) можно легко решить методом последовательных приближений.
Предположим,
что в уравнении (17) справа стоит очень
большое число,
например 1010.
Это означает, что какой-то множитель в
знаменателе очень
мал. Очевидно, мал может быть только
множитель (1
— 4х),
так как ни
одна из скобок не может быть отрицательной
и
(5-х)
> (1-4х).
Введем обозначение у
= 1 -4х,
причем y
<< 1 .Тогда
 и
выражение(17) можно записать в виде:
и
выражение(17) можно записать в виде:
 , (18)
, (18)
 , (19)
, (19)
Поскольку величина «у» очень мала, то в первом приближении отбросим «у» во всех скобках. Тогда находим

Откуда
У1 = 2,469 10-3
Это
- первое приближение. Для следующего
приближения подставим во
все скобки уравнения (19) величину у. При
этом получается второе приближение:у2
=
2,466
10-3,
которое мало отличается от первого.
Аналогично
находим третье приближение: у3
= 2,466
10-3.
На этом
вычисления
можно закончить. Теперь находим
 .
Зная х,
рассчитываем
мольные доли.
.
Зная х,
рассчитываем
мольные доли.
Следует иметь в виду, что у одного из компонентов при этом получится очень малая величина мольной доли. Ясно, что ее надо вычислять не через х, а непосредственно через у.
Аналогично решается задача, если константа Кр очень мала. Тогда надо искать тот множитель в числителе выражения (18), который очень мал, обозначить его через у и действовать, как описано выше.
Последний пункт задания выполняется исходя из принципа Ле Шателье: если на систему, находящуюся в равновесии, оказывается внешнее воздействие, то в системе самопроизвольно происходят процессы, ослабляющие это воздействие.
ПРИЛОЖЕНИЕ 1
ТРЕБОВАНИЯ К ОФОРМЛЕНИЮ ЗАДАНИЯ
Расчетно-графическая работа должна содержать:
- титульный лист;
- формулировку задания;
само задание (исходные данные);
расчет (включая таблицы и рисунки).
Расчетно-графическое задание пишут от руки или печатают на машинке или компьютере на одной стороне листа белой бумаги формата 297 x 210 мм (А4) с полями не менее 25 мм слева и не менее 8 мм справа, которые затем помещают в файл.. Все страницы рукописи должны быть пронумерованы. Номера страниц проставляют в середине нижнего листа. Первой считается титульный лист, на ней цифра «1» не ставится. На следующей странице ставится цифра «2» и т.д.
Каждый новый раздел следует начинать с новой страницы. Разделы и подразделы должны иметь наименования. Точка в конце заголовка, раздела и подраздела не ставится. Разделы, подразделы и пункты нумеруются арабскими цифрами.
Рисунки и таблицы должны иметь порядковый номер и название, их нумерация сквозная по всему тексту расчетно-графической работы. В тексте слова «рисунок» и «таблица» пишутся сокращенно, как «рис.» и «табл.», а в заголовке слово таблица пишется полностью. Остальные сокращения в тексте не допускаются.
Формулы должны быть вписаны в текст тщательно, разборчиво и иметь сквозную нумерацию.
Приложение 2
таблица 1
3. ИСХОДНЫЕ данные для выполения расчетно-графического задания по дисциплине «физическая химия»
|
Вариант |
Номер задания |
Исследование 1 | |||||
|
Схема реализации: аА + bВ= сС + dD |
Интервал температур Тн-Тk | ||||||
|
Компоненты | |||||||
|
а |
в |
с |
d | ||||
|
|
|
|
|
|
|
| |
|
1 |
|
AgI(тв) |
H2S(Г) |
Ag2S(тв) |
HI(Г) |
200-600 | |
|
|
Pb(тв) |
HBr(Г) |
PbBr2(тв) |
H2 (Г) |
200-600 | ||
|
|
SnCl2(тв) |
H2S(Г) |
SnS2 |
HCl (Г) |
300-400 | ||
|
|
Fe3O4 (тв) |
H2 (Г) |
FeO (тв) |
H2O(Г) |
450-900 | ||
|
|
H2 (Г) |
CO2 (Г) |
H2O(Г) |
CO (Г) |
1600-2500 | ||
|
|
H2S(Г) |
CO2 (Г) |
H2O(Г) |
COS (Г) |
800-1700 | ||
|
|
CO(Г) |
PbO (тв) |
CO2 (Г) |
Pb (тв) |
300-750 | ||
|
|
H2S(Г) |
SO2 (Г) |
S2 (Г) |
H2O(Г) |
500-1400 | ||
|
|
FeO (тв) |
CO (Г) |
Fe (тв) |
CO2 (Г) |
300-525 | ||
|
|
CO2 (Г) |
- |
CO (Г) |
O2 (Г) |
1100-2000 | ||
|
|
SO2 (Г) |
Cl2 (Г) |
SOCl2 (Г) |
- |
300-480 | ||
|
|
SOCl2 (Г) |
- |
SO2 (Г) |
Cl2 (Г) |
500-700 | ||
|
|
PCl5 (Г) |
- |
PCl3 |
Cl2 (Г) |
400-850 | ||
|
|
NO2 (Г) |
- |
NO (Г) |
O2 (Г) |
300-1200 | ||
|
|
PbO (тв) |
H2 (Г) |
Pb (тв) |
H2O(Г) |
300-570 | ||
|
|
CuCl2 (тв) |
H2 (Г) |
Cu (тв) |
HCl (Г) |
300-660 | ||
|
|
H2O(Г) |
- |
H2 (Г) |
O2 (Г) |
1600-2500 | ||
|
|
SO2 (Г) |
O2 (Г) |
SO3 (Г) |
- |
300-1200 | ||
|
|
N2 (Г) |
O2 (Г) |
N2O (Г) |
- |
1100-2000 | ||
|
|
CdBr2 (тв) |
HCl (Г) |
CdCl2 (Г) |
HBr (Г) |
750-950 | ||
|
№ п/п |
Исследование 2 |
Общее давление Робщ, гПа |
Температура, К | ||||||
|
Шаг в градусах, ∆Т |
Фактический состав смеси, об, % | ||||||||
|
Компоненты | |||||||||
|
А |
В |
С |
D | ||||||
|
8 |
9 |
10 |
11 |
8 |
9 |
10 |
11 | ||
|
|
50 |
- |
15 |
- |
85 |
1520 |
500 | ||
|
|
50 |
- |
25 |
- |
75 |
1520 |
500 | ||
|
|
25 |
- |
35 |
- |
65 |
1520 |
350 | ||
|
|
50 |
- |
20 |
- |
80 |
1013 |
800 | ||
|
|
100 |
20 |
10 |
40 |
30 |
3039 |
2000 | ||
|
|
100 |
10 |
30 |
30 |
30 |
1013 |
1300 | ||
|
|
50 |
20 |
- |
80 |
- |
1013 |
570 | ||
|
|
100 |
40 |
10 |
25 |
25 |
2026 |
900 | ||
|
|
25 |
- |
80 |
- |
20 |
1013 |
450 | ||
|
|
50 |
30 |
- |
30 |
40 |
1013 |
1600 | ||
|
|
20 |
20 |
10 |
70 |
- |
3039 |
400 | ||
|
|
50 |
90 |
- |
5 |
5 |
2026 |
650 | ||
|
|
50 |
40 |
- |
30 |
30 |
1013 |
500 | ||
|
|
100 |
20 |
- |
40 |
40 |
1013 |
1000 | ||
|
|
20 |
- |
80 |
- |
20 |
1013 |
450 | ||
|
|
20 |
- |
10 |
- |
90 |
5065 |
580 | ||
|
|
100 |
40 |
- |
20 |
40 |
1013 |
2500 | ||
|
|
100 |
20 |
20 |
60 |
- |
1013 |
900 | ||
|
|
100 |
40 |
40 |
20 |
- |
1013 |
2000 | ||
|
|
25 |
- |
55 |
- |
45 |
1013 |
800 | ||
|
Вариант |
Номер задания |
Исследование 1 | |||||
|
Схема реализации: аА + bВ= сС + dD |
Интервал температур Тн-Тk | ||||||
|
Компоненты | |||||||
|
а |
в |
с |
d | ||||
|
|
|
|
|
|
|
| |
|
2 |
|
FeO (тв) |
H2 (Г) |
Fe (тв) |
H2O(Г) |
700-1000 | |
|
|
Fe2O3 (тв) |
H2 (Г) |
Fe (тв) |
H2O(Г) |
800-1400 | ||
|
|
Fe3O4 (тв) |
H2 (Г) |
Fe (тв) |
H2O(Г) |
600-1300 | ||
|
|
Fe2O3 (тв) |
CO (Г) |
Fe (тв) |
CO2 (Г) |
800-1300 | ||
|
|
Fe3O4 (тв) |
CO (Г) |
Fe (тв) |
CO2 (Г) |
800-1100 | ||
|
|
Mn2O3 |
CO (Г) |
Mn (тв) |
CO2 (Г) |
750-1100 | ||
|
|
MnO |
CO (Г) |
Mn (тв) |
CO2 (Г) |
650-1000 | ||
|
|
CO (Г) |
H2 (Г) |
CO2 (Г) |
H2 (Г) |
700-1200 | ||
|
|
C (тв) |
H2O(Г) |
CO2 (Г) |
H2 (Г) |
800-1100 | ||
|
|
Cr2O3 (тв) |
CO (Г) |
CO2 (Г) |
Cr (тв) |
1900-1200 | ||
|
|
Fe3C (тв) |
CO2 (Г) |
Fe (тв) |
CO (Г) |
700-950 | ||
|
|
Al2O3 (тв) |
CO (Г) |
Al (тв) |
CO2 (Г) |
350-900 | ||
|
|
MnO2 (тв) |
CO (Г) |
MnO (тв) |
CO2 (Г) |
900-1150 | ||
|
|
Ti (тв) |
CO2 (Г) |
TiO2 (тв) |
CO (Г) |
850-1350 | ||
|
|
V2O5 (тв) |
CO (Г) |
V (тв) |
CO2 (Г) |
750-1350 | ||
|
|
Fe (тв) |
CO2 (Г) |
FeO (тв) |
CO (Г) |
900-1300 | ||
|
|
HCl (Г) |
O2 (Г) |
H2O(Г) |
Cl2 (Г) |
980-1500 | ||
|
|
H2O(Г) |
Cl2 (Г) |
HCl (Г) |
O2 (Г) |
1300-1800 | ||
|
|
SO2 (Г) |
O2 (Г) |
SO3 (Г) |
- |
500-1800 | ||
|
|
H2(Г) |
Br2 (Г) |
HBr (Г) |
- |
1800-2000 | ||
|
№ п/п |
Исследование 2 |
Общее давление Робщ, гПа |
Температура, К | ||||||
|
Шаг в градусах, ∆Т |
Фактический состав смеси, об, % | ||||||||
|
Компоненты | |||||||||
|
А |
В |
С |
D | ||||||
|
8 |
9 |
10 |
11 |
8 |
9 |
10 |
11 | ||
|
|
50 |
- |
30 |
- |
70 |
2026 |
700 | ||
|
|
100 |
- |
60 |
- |
40 |
1013 |
800 | ||
|
|
100 |
- |
25 |
- |
75 |
1520 |
1000 | ||
|
|
50 |
- |
85 |
- |
15 |
1013 |
1100 | ||
|
|
50 |
- |
75 |
- |
25 |
2026 |
1100 | ||
|
|
50 |
- |
30 |
- |
70 |
1520 |
950 | ||
|
|
50 |
- |
40 |
- |
60 |
2026 |
850 | ||
|
|
100 |
20 |
40 |
30 |
10 |
1013 |
1100 | ||
|
|
50 |
- |
60 |
15 |
25 |
1520 |
1000 | ||
|
|
50 |
- |
30 |
70 |
- |
2026 |
1050 | ||
|
|
50 |
- |
80 |
- |
20 |
1520 |
900 | ||
|
|
50 |
- |
85 |
- |
15 |
1520 |
650 | ||
|
|
50 |
- |
80 |
10 |
10 |
2026 |
1050 | ||
|
|
100 |
- |
60 |
- |
40 |
1013 |
1250 | ||
|
|
100 |
- |
70 |
- |
30 |
1013 |
1250 | ||
|
|
50 |
- |
80 |
- |
20 |
1013 |
1000 | ||
|
|
50 |
20 |
30 |
10 |
40 |
505 |
1000 | ||
|
|
100 |
70 |
10 |
10 |
10 |
2026 |
900 | ||
|
|
200 |
40 |
40 |
20 |
- |
1013 |
400 | ||
|
|
25 |
30 |
60 |
10 |
- |
2026 |
1200 | ||
|
Вариант |
Номер задания |
Исследование 1 | |||||
|
Схема реализации: аА + bВ= сС + dD |
Интервал температур Тн-Тk | ||||||
|
Компоненты | |||||||
|
а |
в |
с |
d |
| |||
|
|
|
|
|
|
|
| |
|
3 |
|
СО(Г) |
O2 (Г) |
CO2(Г) |
- |
500-2000 | |
|
|
Н2(Г) |
O2 (Г) |
H2O(Г) |
- |
500-2000 | ||
|
|
СО2(Г) |
H2 (Г) |
CO2(Г) |
H2O(Г) |
500-2000 | ||
|
|
С(тв) |
O2 (Г) |
CO2(Г) |
- |
500-2000 | ||
|
|
С(тв) |
O2 (Г) |
CO2(Г) |
- |
500-2000 | ||
|
|
С(тв) |
H2O(Г) |
CO2(Г) |
H2O(Г) |
500-2000 | ||
|
|
СО(Г) |
C (тв) |
CO2(Г) |
- |
500-1800 | ||
|
|
Fe2O3 (тв) |
СО(Г) |
Fe3O4 (тв) |
CO2(Г) |
500-2000 | ||
|
|
Fe3O4 (тв) |
СО(Г) |
FeO (тв) |
CO2(Г) |
500-2000 | ||
|
|
FeO (тв) |
СО(Г) |
Fe (тв) |
CO2(Г) |
500-1800 | ||
|
|
MnO2 (тв) |
СО(Г) |
Mn (тв) |
CO2(Г) |
900-1150 | ||
|
|
NiO (тв) |
СО(Г) |
Ni (тв) |
CO2(Г) |
500-2000 | ||
|
|
MnO (тв) |
СО(Г) |
Mn (тв) |
CO2(Г) |
500-2000 | ||
|
|
Fe2O3 (тв) |
СО(Г) |
Fe (тв) |
CO2(Г) |
800-1300 | ||
|
|
Fe3O4 (тв) |
СО(Г) |
Fe (тв) |
CO2(Г) |
800-1100 | ||
|
|
Mn2O3 |
СО(Г) |
Mn (тв) |
CO2(Г) |
750-1100 | ||
|
|
FeO (тв) |
H2 (Г) |
Fe (тв) |
H2O(Г) |
700-1000 | ||
|
|
Fe2O3 (тв) |
H2 (Г) |
Fe (тв) |
H2O(Г) |
800-1400 | ||
|
|
Fe3O4 (тв) |
H2 (Г) |
Fe (тв) |
H2O(Г) |
600-1300 | ||
|
|
FeO (тв) |
СО(Г) |
Fe (тв) |
CO2(Г) |
850-1200 | ||
|
№ п/п |
Исследование 2 |
Общее давление Робщ, гПа |
Температура, К | ||||||||
|
Шаг в градусах, ∆Т |
Фактический состав смеси, об, % | ||||||||||
|
Компоненты | |||||||||||
|
А |
В |
С |
D |
|
| ||||||
|
8 |
9 |
10 |
11 |
8 |
9 |
10 |
11 | ||||
|
|
200 |
30 |
10 |
60 |
- |
1013 |
1000 | ||||
|
|
200 |
20 |
20 |
60 |
- |
1013 |
1100 | ||||
|
|
200 |
10 |
20 |
50 |
20 |
1013 |
1083 | ||||
|
|
200 |
- |
20 |
80 |
- |
1013 |
1200 | ||||
|
|
200 |
- |
30 |
- |
70 |
2026 |
1400 | ||||
|
|
200 |
- |
20 |
10 |
70 |
2026 |
1600 | ||||
|
|
200 |
40 |
- |
60 |
- |
1520 |
1300 | ||||
|
|
200 |
- |
50 |
- |
50 |
1520 |
1100 | ||||
|
|
200 |
- |
60 |
- |
40 |
2026 |
1300 | ||||
|
|
200 |
- |
70 |
- |
30 |
1013 |
1500 | ||||
|
|
200 |
- |
80 |
- |
20 |
2026 |
1050 | ||||
|
|
200 |
- |
20 |
- |
80 |
1013 |
1000 | ||||
|
|
200 |
- |
10 |
- |
90 |
1520 |
1100 | ||||
|
|
50 |
- |
75 |
- |
25 |
2026 |
1100 | ||||
|
|
50 |
- |
30 |
- |
70 |
1520 |
950 | ||||
|
|
50 |
- |
80 |
- |
20 |
1013 |
950 | ||||
|
|
50 |
- |
30 |
- |
70 |
2026 |
700 | ||||
|
|
100 |
- |
60 |
- |
40 |
1013 |
800 | ||||
|
|
100 |
- |
25 |
- |
75 |
1520 |
1000 | ||||
|
|
50 |
- |
85 |
- |
15 |
1013 |
1100 | ||||
|
Вариант |
Номер задания |
Исследование 1 | |||||
|
Схема реализации: аА + bВ= сС + dD |
Интервал температур Тн-Тk | ||||||
|
Компоненты | |||||||
|
а |
в |
с |
d | ||||
|
|
|
|
|
|
|
| |
|
4 |
|
SiO2(тв) |
HF (Г) |
SiF4 (Г) |
H2O(Г) |
350-800 | |
|
|
Cl(Г) |
- |
Cl2 (Г) |
- |
600-1500 | ||
|
|
COS(Г) |
- |
CO2(Г) |
CS2 (Г) |
300-1200 | ||
|
|
H2S(Г) |
O2 (Г) |
SO2(Г) |
H2O(Г) |
900-1800 | ||
|
|
H2(Г) |
Br2 (Г) |
HBr (Г) |
- |
600-1500 | ||
|
|
TeSe (Г) |
- |
Te2 (Г) |
Se (Г) |
300-3200 | ||
|
|
СО(Г) |
- |
С(тв) |
O2 (Г) |
1400-2300 | ||
|
|
ZnS (тв) |
O2 (Г) |
Zn (тв) |
SО(Г) |
350-700 | ||
|
|
CaCl2 (тв) |
H2O(Г) |
CaO (тв) |
HCl (Г) |
600-1050 | ||
|
|
MnO (тв) |
H2(Г) |
Mn (тв) |
H2O(Г) |
550-1000 | ||
|
|
CO(Г) |
SO2 (Г) |
S2 (Г) |
CO2(Г) |
900-1800 | ||
|
|
H2S(Г) |
SO2 (Г) |
S2 (Г) |
H2O(Г) |
500-1500 | ||
|
|
CO2(Г) |
- |
СО(Г) |
O2 (Г) |
1100-2000 | ||
|
|
NO2(Г) |
- |
NО(Г) |
O2 (Г) |
300-1200 | ||
|
|
CuCl2 (тв) |
H2(Г) |
Cu (тв) |
HCl (Г) |
300-700 | ||
|
|
СО(Г) |
S2(Г) |
COS (Г) |
- |
900-1800 | ||
|
|
AgCl (тв) |
H2(Г) |
Ag (тв) |
HCl (Г) |
3500-800 | ||
|
|
H2O(Г) |
- |
H2(Г) |
O2 (Г) |
1600-2500 | ||
|
|
Sb2S3 (тв) |
H2(Г) |
Sb (тв) |
H2S(Г) |
350-800 | ||
|
|
HCl (Г) |
S2(Г) |
H2O(Г) |
Cl2 (Г) |
600-1500 | ||
|
№ п/п |
Исследование 2 |
Общее давление Робщ, гПа |
Температура, К | ||||||||
|
Шаг в градусах, ∆Т |
Фактический состав смеси, об, % | ||||||||||
|
Компоненты | |||||||||||
|
А |
В |
С |
D |
|
| ||||||
|
8 |
9 |
10 |
11 |
8 |
9 |
10 |
11 | ||||
|
|
50 |
- |
20 |
20 |
40 |
1013 |
800 | ||||
|
|
100 |
30 |
- |
70 |
- |
1013 |
1500 | ||||
|
|
100 |
80 |
- |
10 |
10 |
5065 |
1000 | ||||
|
|
100 |
20 |
20 |
20 |
40 |
1013 |
1800 | ||||
|
|
100 |
10 |
40 |
50 |
- |
1013 |
1500 | ||||
|
|
500 |
80 |
- |
10 |
10 |
1013 |
500 | ||||
|
|
200 |
90 |
- |
- |
10 |
1013 |
2300 | ||||
|
|
50 |
- |
40 |
- |
60 |
1013 |
690 | ||||
|
|
50 |
- |
80 |
- |
20 |
1013 |
1050 | ||||
|
|
50 |
- |
15 |
- |
85 |
1013 |
1000 | ||||
|
|
100 |
30 |
10 |
10 |
50 |
1013 |
1700 | ||||
|
|
100 |
10 |
30 |
10 |
50 |
5065 |
900 | ||||
|
|
100 |
30 |
- |
60 |
10 |
1013 |
2000 | ||||
|
|
100 |
60 |
- |
30 |
10 |
2026 |
1000 | ||||
|
|
50 |
- |
80 |
- |
20 |
3039 |
580 | ||||
|
|
100 |
60 |
20 |
20 |
- |
1013 |
1500 | ||||
|
|
50 |
- |
10 |
- |
90 |
1013 |
400 | ||||
|
|
100 |
50 |
- |
25 |
25 |
1013 |
2500 | ||||
|
|
50 |
- |
20 |
- |
80 |
1013 |
650 | ||||
|
|
50 |
30 |
30 |
30 |
10 |
1013 |
700 | ||||
|
Вариант |
Номер задания |
Исследование 1 | |||||
|
Схема реализации: аА + bВ= сС + dD |
Интервал температур Тн-Тk | ||||||
|
Компоненты | |||||||
|
а |
в |
с |
d | ||||
|
|
|
|
|
|
|
| |
|
5 |
|
СО(Г) |
SO2(Г) |
S2(Г) |
CO2(Г) |
1800-2150 | |
|
|
H2(Г) |
S2 (Г) |
- |
H2S(Г) |
1500-2000 | ||
|
|
AgCl(тв) |
H2(Г) |
Ag (тв) |
HCl (Г) |
1200-1500 | ||
|
|
ZnS(тв) |
H2O(Г) |
H2S(Г) |
ZnO(тв) |
300-1200 | ||
|
|
ZnS(тв) |
O2 (Г) |
Zn (тв) |
SO2 (Г) |
700-1800 | ||
|
|
CaCl2(тв) |
H2O(Г) |
CaO (тв) |
HCl (Г) |
1000-2000 | ||
|
|
Ag2O(тв) |
S2 (Г) |
SO2 (Г) |
Ag (тв) |
1200-1800 | ||
|
|
HgO(тв) |
H2(Г) |
Hg (Г) |
H2O(Г) |
700-950 | ||
|
|
AgCl(тв) |
O2 (Г) |
Ag2O (тв) |
Cl2 (Г) |
700-1100 | ||
|
|
PCl3 (Г) |
Cl2 (Г) |
PCl5 (Г) |
- |
600-1800 | ||
|
|
PbO (Г) |
H2(Г) |
Pb (тв) |
H2O(Г) |
600-1800 | ||
|
|
ZnS(тв) |
H2O(Г) |
H2S(Г) |
ZnO(тв) |
700-1100 | ||
|
|
Fe3C (тв) |
CO2(Г) |
Fe (тв) |
СО(Г) |
700-950 | ||
|
|
MnO (тв) |
H2(Г) |
Mn (тв) |
H2O(Г) |
1500-2000 | ||
|
|
NiS (тв) |
O2 (Г) |
Ni (тв) |
SO2 (Г) |
1500-2000 | ||
|
|
CO2(Г) |
С(тв) |
СО(Г) |
- |
900-1800 | ||
|
|
H2(Г) |
I2 (Г) |
HI (Г) |
- |
1000-2000 | ||
|
|
СО(Г) |
H2O(Г) |
CO2(Г) |
H2(Г) |
1200-1950 | ||
|
|
СО(Г) |
O2 (Г) |
CO2(Г) |
- |
2000-2500 | ||
|
|
NО(Г) |
- |
N2 (Г) |
O2 (Г) |
2500-3000 | ||
|
№ п/п |
Исследование 2 |
Общее давление Робщ, гПа |
Температура, К | ||||||
|
Шаг в градусах, ∆Т |
Фактический состав смеси, об, % | ||||||||
|
Компоненты | |||||||||
|
А |
В |
С |
D | ||||||
|
8 |
9 |
10 |
11 |
8 |
9 |
10 |
11 | ||
|
|
50 |
- |
20 |
20 |
40 |
1013 |
800 | ||
|
|
50 |
30 |
- |
70 |
- |
1013 |
1500 | ||
|
|
50 |
80 |
- |
10 |
10 |
5065 |
1000 | ||
|
|
100 |
20 |
20 |
20 |
40 |
1013 |
1800 | ||
|
|
100 |
10 |
40 |
50 |
- |
1013 |
1500 | ||
|
|
100 |
80 |
- |
10 |
10 |
1013 |
500 | ||
|
|
100 |
90 |
- |
- |
10 |
1013 |
2300 | ||
|
|
100 |
- |
40 |
- |
60 |
1013 |
690 | ||
|
|
50 |
- |
80 |
- |
20 |
1013 |
1050 | ||
|
|
100 |
- |
15 |
- |
85 |
1013 |
1000 | ||
|
|
100 |
30 |
10 |
10 |
50 |
1013 |
1700 | ||
|
|
100 |
10 |
30 |
10 |
50 |
5065 |
900 | ||
|
|
50 |
30 |
- |
10 |
10 |
1013 |
2000 | ||
|
|
100 |
60 |
- |
30 |
10 |
2026 |
1000 | ||
|
|
50 |
- |
80 |
- |
20 |
3039 |
580 | ||
|
|
100 |
60 |
20 |
20 |
- |
1013 |
1500 | ||
|
|
50 |
- |
10 |
- |
90 |
1013 |
400 | ||
|
|
100 |
50 |
- |
25 |
25 |
1013 |
2500 | ||
|
|
50 |
- |
20 |
- |
80 |
1013 |
650 | ||
|
|
50 |
30 |
30 |
30 |
10 |
1013 |
700 | ||
|
Вариант |
Номер задания |
Исследование 1 | |||||
|
Схема реализации: аА + bВ= сС + dD |
Интервал температур Тн-Тk | ||||||
|
Компоненты | |||||||
|
а |
в |
с |
d |
| |||
|
|
|
|
|
|
|
| |
|
6 |
|
AgI (тв) |
H2(Г) |
Ag (тв) |
HI(Г) |
300-450 | |
|
|
AlCl3 (тв) |
H2(Г) |
Al (тв) |
HCl (Г) |
320-600 | ||
|
|
AgBr (тв) |
H2(Г) |
Ag (тв) |
HBr(Г) |
450-700 | ||
|
|
AlBr3 (тв) |
H2(Г) |
Al (тв) |
HBr(Г) |
350-650 | ||
|
|
NbO5 (тв) |
H2(Г) |
NbO(тв) |
H2O(Г) |
1750-1950 | ||
|
|
AcO3 (тв) |
Cl2 (Г) |
AcCl3(тв) |
O2 (Г) |
1050-1500 | ||
|
|
B2O3 (тв) |
Cl2 (Г) |
BCl3 |
O2 (Г) |
650-850 | ||
|
|
BaO (тв) |
Cl2 (Г) |
BaCl3(тв) |
O2 (Г) |
550-900 | ||
|
|
BiO3 (тв) |
Cl2 (Г) |
BiCl2(тв) |
O2 (Г) |
350-850 | ||
|
|
Cr2O3 (тв) |
Cl2 (Г) |
CrCl3(тв) |
O2 (Г) |
350-750 | ||
|
|
CdO (тв) |
СО(Г) |
Cd(тв) |
CO2(Г) |
350-950 | ||
|
|
Al2O3 (тв) |
СО(Г) |
Al(тв) |
CO2(Г) |
450-900 | ||
|
|
TiC (тв) |
O2 (Г) |
TiO2 |
CO(Г) |
1650-2000 | ||
|
|
AsBr3 (тв) |
H2(Г) |
As(тв) |
HBr(Г) |
300-500 | ||
|
|
AgF (тв) |
H2(Г) |
Ag(тв) |
Hr(Г) |
450-750 | ||
|
|
BBR3 (тв) |
H2(Г) |
B(тв) |
HBr(Г) |
350-1000 | ||
|
|
BiBR3 (тв) |
H2(Г) |
Bi(тв) |
HBr(Г) |
500-1500 | ||
|
|
Ce2O3 (тв) |
Cl2 (Г) |
CeCl3(тв) |
O2 (Г) |
650-1050 | ||
|
|
La2O3 (тв) |
Cl2 (Г) |
LaCl3(тв) |
O2 (Г) |
550-1100 | ||
|
|
Re2O3 (тв) |
Cl2 (Г) |
ReCl3(тв) |
O2 (Г) |
350-450 | ||
|
№ п/п |
Исследование 2 |
Общее давление Робщ, гПа |
Температура, К | ||||
|
Шаг в градусах, ∆Т |
Фактический состав смеси, об, % | ||||||
|
Компоненты | |||||||
|
А |
В |
С |
D | ||||
|
8 |
9 |
10 |
11 |
8 |
9 |
10 |
11 |
|
|
50 |
- |
30 |
- |
70 |
1013 |
1500 |
|
|
100 |
- |
20 |
- |
80 |
1013 |
1300 |
|
|
50 |
- |
40 |
- |
60 |
2026 |
1800 |
|
|
100 |
- |
50 |
- |
50 |
2026 |
1400 |
|
|
100 |
- |
60 |
- |
40 |
3039 |
1500 |
|
|
50 |
- |
70 |
- |
30 |
3039 |
1750 |
|
|
50 |
- |
75 |
- |
25 |
1013 |
830 |
|
|
100 |
- |
25 |
- |
75 |
1013 |
800 |
|
|
80 |
- |
35 |
- |
65 |
4052 |
500 |
|
|
15 |
- |
45 |
- |
55 |
1013 |
375 |
|
|
15 |
- |
55 |
- |
45 |
3039 |
400 |
|
|
35 |
- |
65 |
- |
35 |
1013 |
550 |
|
|
100 |
- |
75 |
- |
25 |
1520 |
650 |
|
|
80 |
- |
15 |
- |
85 |
2026 |
480 |
|
|
15 |
- |
20 |
- |
80 |
4052 |
380 |
|
|
20 |
- |
45 |
- |
55 |
3039 |
900 |
|
|
50 |
- |
15 |
- |
85 |
1520 |
500 |
|
|
50 |
- |
25 |
- |
75 |
1520 |
500 |
|
|
15 |
- |
35 |
- |
65 |
1520 |
350 |
|
|
20 |
- |
65 |
- |
35 |
507 |
900 |
|
Вариант |
Номер задания |
Исследование 1 | |||||
|
Схема реализации: аА + bВ= сС + dD |
Интервал температур Тн-Тk | ||||||
|
Компоненты | |||||||
|
а |
в |
с |
d |
| |||
|
|
|
|
|
|
|
| |
|
7 |
|
Mn2O3 (тв) |
СО(Г) |
Mn3O4 (тв |
CO2(Г) |
950-1400 | |
|
|
SiC (тв) |
CO2(Г) |
Si (тв) |
СО(Г) |
1350-1700 | ||
|
|
FeO (тв) |
H2(Г) |
Fe (тв) |
H2O(Г) |
300-700 | ||
|
|
Fe3O4 (тв) |
H2(Г) |
Fe (тв) |
H2O(Г) |
350-750 | ||
|
|
С(тв) |
H2O(Г) |
CO2(Г) |
H2 (Г) |
300-1200 | ||
|
|
СО(Г) |
S2(Г) |
COS (Г) |
- |
900-1800 | ||
|
|
NO2(Г) |
N2(Г) |
O2 (Г) |
- |
1100-2000 | ||
|
|
Cl2 (Г) |
H2O(Г) |
HCl (Г) |
O2 (Г) |
600-1500 | ||
|
|
H2(Г) |
S2 (Г) |
H2S(Г) |
- |
1500-2000 | ||
|
|
N2(Г) |
O2 (Г) |
NO (Г) |
- |
1600-1800 | ||
|
|
S2(Г) |
H2O(Г) |
SO2 (Г) |
H2 (Г) |
900-1800 | ||
|
|
H2(Г) |
Cl2 (Г) |
HCl (Г) |
- |
800-1500 | ||
|
|
S2(Г) |
CO2(Г) |
SO2 (Г) |
СО(Г) |
900-1800 | ||
|
|
NH2(Г) |
H2 (Г) |
NH3 (Г) |
- |
500-1400 | ||
|
|
AgCl(тв) |
H2 (Г) |
Ag (тв) |
HCl (Г) |
350-750 | ||
|
|
ZnS(тв) |
H2O(Г) |
H2S(Г) |
ZnO(тв) |
300-1200 | ||
|
|
CO2(Г) |
С(тв) |
СО(Г) |
- |
300-1200 | ||
|
|
H2S(Г) |
O2 (Г) |
SO2(Г) |
H2O(Г) |
900-1800 | ||
|
|
N2O2 (Г) |
- |
NO2(Г) |
- |
900-1800 | ||
|
|
Fe2O3 (тв) |
H2) (Г) |
Fe (тв) |
H2O(Г) |
300-850 | ||
|
№ п/п |
Исследование 2 |
Общее давление Робщ, гПа |
Температура, К | ||||||||
|
Шаг в градусах, ∆Т |
Фактический состав смеси, об, % | ||||||||||
|
Компоненты | |||||||||||
|
А |
В |
С |
D |
|
| ||||||
|
8 |
9 |
10 |
11 |
8 |
9 |
10 |
11 | ||||
|
|
50 |
- |
25 |
- |
75 |
2026 |
1300 | ||||
|
|
50 |
- |
15 |
- |
85 |
3039 |
1600 | ||||
|
|
50 |
- |
80 |
- |
20 |
101,3 |
500 | ||||
|
|
50 |
- |
60 |
- |
40 |
1013 |
700 | ||||
|
|
100 |
40 |
10 |
40 |
10 |
10120 |
1000 | ||||
|
|
100 |
40 |
30 |
30 |
- |
5065 |
1500 | ||||
|
|
50 |
30 |
50 |
20 |
- |
10,13 |
200 | ||||
|
|
100 |
50 |
30 |
10 |
10 |
2026 |
800 | ||||
|
|
100 |
50 |
10 |
40 |
- |
5058 |
1400 | ||||
|
|
50 |
30 |
30 |
40 |
- |
3039 |
2500 | ||||
|
|
50 |
10 |
10 |
10 |
70 |
10,13 |
1700 | ||||
|
|
100 |
20 |
10 |
70 |
- |
1013 |
1500 | ||||
|
|
50 |
80 |
10 |
5 |
5 |
101,3 |
1800 | ||||
|
|
50 |
40 |
40 |
20 |
- |
10130 |
600 | ||||
|
|
100 |
- |
80 |
- |
20 |
101,30 |
400 | ||||
|
|
100 |
- |
30 |
- |
70 |
1013 |
1200 | ||||
|
|
100 |
80 |
- |
20 |
- |
1013 |
1000 | ||||
|
|
100 |
5 |
5 |
10 |
80 |
1165 |
1800 | ||||
|
|
100 |
80 |
- |
20 |
- |
10130 |
350 | ||||
|
|
100 |
- |
30 |
- |
70 |
1013 |
820 | ||||
ПРИЛОЖЕНИЕ З
ОБРАЗЕЦ ОФОРМЛЕНИЯ ТИТУЛЬНОГО ЛИСТА
Министерство образования и науки Российской Федерации
ФГБОУ ВПО «Магнитогорский государственный технический университет
им. Г.И.Носова»
Кафедра химической технологии неметаллических материалов и
физической химии
