
- •13) Структура и биологическая роль нуклеопротеинов и нуклеиновых кислот
- •14) Современное представление о механизме ферментативного катализа (на примере гидролиза ацетилхолина холинэстеразой)
- •15) Химическая природа ферментов. Функциональные участки молекул ферментов. Простые и сложные ферменты.
- •16) Зависимость скорости ферментативной реакции от температуры, рН, концентрации фермента и субстрата. Константа Михаэлиса.
14) Современное представление о механизме ферментативного катализа (на примере гидролиза ацетилхолина холинэстеразой)
Основная функция ферментов заключается в снижении энергии активации и повышении скорости химических реакций в соответствии с потребностями живого организма.
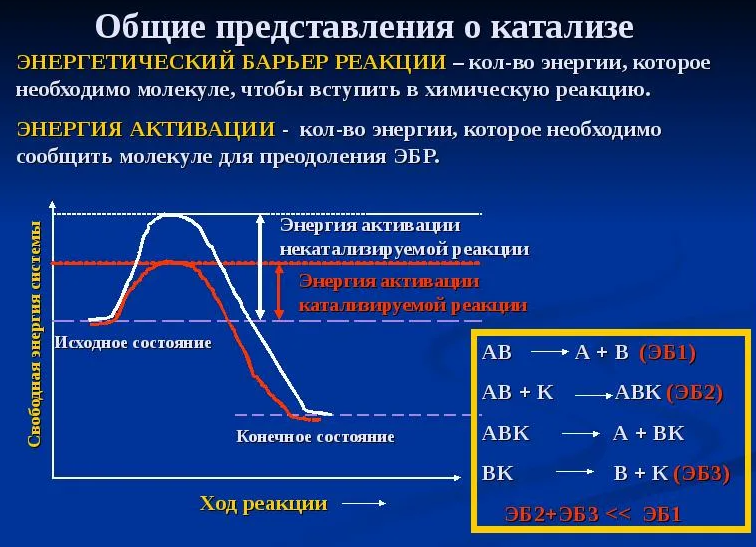
Фермент не влияет на свободную энергию исходных веществ и продуктов, но он влияет на энергетический профиль, т.е. в присутствии фермента реакция идет через низкий энергетический барьер (ферменты снижают энергию активации реакции). В результате этого скорость ферментативной реакции в десятки раз возрастает по сравнению с не ферментативной реакцией.
В основе современных представлений ферментативного катализа лежат работы Михаэлиса и Ментен, которые делят процесс ферментативного катализа на 4 стадии:

Диффузия субстрата к ферменту и образование ЕS-комплекса происходит быстро и обратимо, при этом реализуется точное пространственное соответствие между активным центром фермента и субстратом.
Преобразование первичного ES-комплекса в активированный происходит медленно, идет расшатывание связей в субстрате. При этом снижается энергия активации реакции.
Отделение продуктов реакции от активного центра фермента и диффузия их в среду. Фермент при этом не входит в состав продуктов.
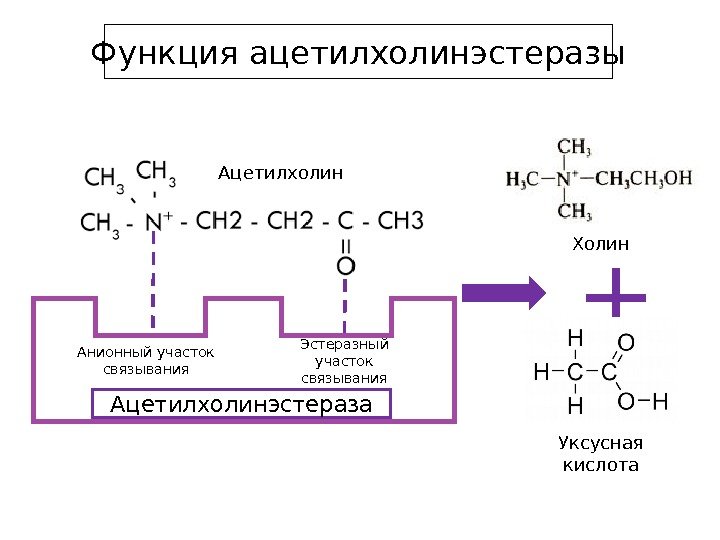
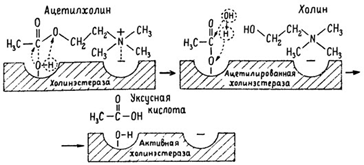
Механизм гидролиза АХ:
1.Участок поверхности холинэстеразы, непосредственно контактирующий с каждой молекулой медиатора, включает 2 центра: анионный, несущий отрицательный заряд, и эстеразный.
2.Ацетилхолин благодаря положительно заряженному атому азота ориентируется за счет электростатических сил на поверхности холинэстеразы.
3.Анионный центр притягивает к себе катионную головку ацетилхолина и тем самым способствует сближению его эфирной группировки с эстеразным центром фермента. Тут происходит снижение энергии активации реакции.
4.Затем рвется эфирная связь, ацетилхолин разделяется на 2 части: холиновую и уксусную, остаток уксусной кислоты присоединяется к эстеразному центру фермента и образуется так называемая ацетилированная холинэстераза.
5.Этот крайне непрочный комплекс мгновенно подвергается спонтанному гидролизу, что освобождает фермент от остатка медиатора и приводит к образованию уксусной кислоты.
6.С данного момента холинэстераза снова способна выполнять каталитическую функцию, а холин и уксусная кислота становятся исходными продуктами синтеза новых молекул ацетилхолина.
15) Химическая природа ферментов. Функциональные участки молекул ферментов. Простые и сложные ферменты.
Ферменты — это специфические белки, выполняющие в организме роль биологических катализаторов. Ферменты, благодаря своей белковой природе, отличаются от других катализаторов уникальными свойствами:
Высокой специфичностью
Способностью к регуляции
Доказательства белковой природы ферментов:
Денатурируют под действием химических и физических факторов
При гидролизе распадаются на аминокислоты
Обладают амфотерными свойствами
Обладают электрофоретической подвижностью
Не подвергаются диализу через полупроницаемую мембрану
Осаждаются высаливанием
Имеют большую молекулярную массу
Обладают высокой специфичностью
Прямое доказательство- синтез белков-ферментов (1969- синтез первого белка-фермента- рибонуклеазы)
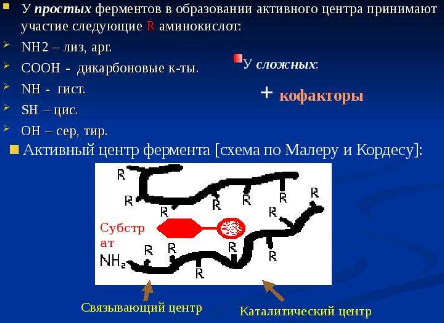
Ферменты могут быть как простыми, так и сложными белками:
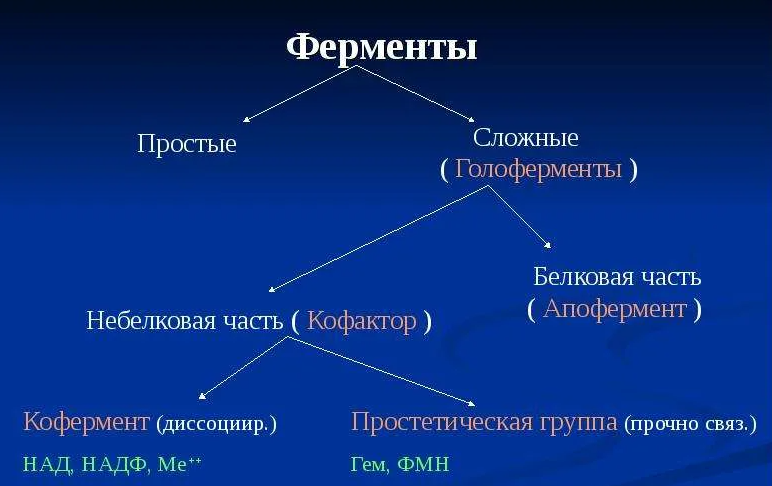
-Выделяют простые ферменты, состоящие только из полипептидной цепи: пепсин, трипсин, уреаза, рибонуклеаза, фосфатаза и др.
-Большинство природных ферментов - сложные белки. Их небелковые компоненты называются кофакторами и необходимы для выполнения ферментом его каталитической роли. Кофакторами ферментов являются витамины или соединения, построенные с их участием (коэнзим А, НАД+, ФАД); фосфорные эфиры некоторых моносахаридов, ионы металлов.
Кофермент - небелковый фактор, который легко отделяется от белковой части - апофермента при диссоциации.
Простетическая группа – ковалентно связанный с белковой цепью небелковый компонент, который не отделяется при выделении и очистке фермента.
Весь фермент вместе с простетической группой называют холоферментом. Только объединение апофермента и кофермента обеспечивает активность холофермента.
Функциональные участки ферментов
Фермент взаимодействует с субстратом лишь частью молекулы- активным центром.
Активный центр (для катализа)— это уникальная комбинация аминокислотных остатков в молекуле фермента, обеспечивающая непосредственное его взаимодействие с молекулой субстрата и прямое участие в акте катализа.
Активный центр состоит из: |
|
Контактного участка, Который узнает и связывает субстрат, обеспечивает специфичность. Его также называют якорной площадкой или связывающим центром. |
Катализирующего участка, Обеспечивающего катализ |
Активный центр формируется на третичной и четвертичной структуре фермента.
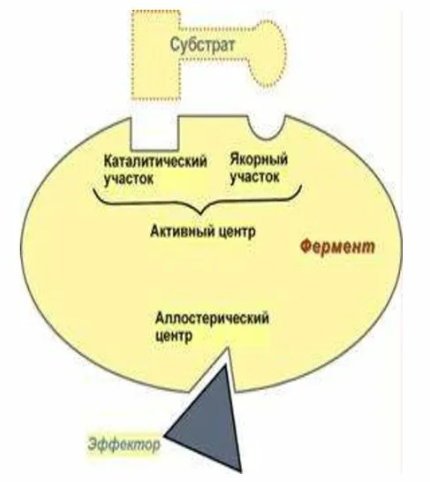
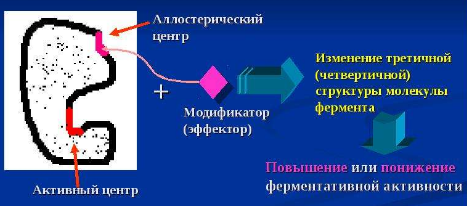
Аллостерический центр (для регуляции) — это участок молекулы фермента, с которым связывается определенные, обычно низкомолекулярные соединения- эффекторы (модификаторы), молекулы которых отличаются по строению от субстратов. В результате изменяется третичная, а часто и четвертичная структура белковой молекулы. Как следствие изменяется конфигурация активного центра и каталитическая активность фермента. Это т.н. аллостерическая регуляция активности ферментов. Ферменты, активность каталитического центра которых подвергается изменению под влиянием аллостерических эффекторов, называют аллостерическими.
Участки химической(постсинтетической) модификации (для регуляции)
Участок, обеспечивающий ориентацию фермента относительно субстрата
Участки межмолекулярного взаимодействия (для объединения в комплексы и ансамбли)
Участок иммунных взаимодействий (для взаимодействий антиген-антитело)
