
- •4. Подсчет количества эритроцитов.
- •5. Подсчет количества лейкоцитов
- •6. Определение соэ.
- •7. Определение гематокрита.
- •8. Определение скорости и времени свёртывания крови по методам Дьюка, Бюркера и Сухарева.
- •9. Определение группы крови.
- •12. Подсчёт лейкоцитарной формулы. Определение индекса ядерного сдвига.
- •13. Оценка клинического анализа крови. Состав и нормальные показатели клинического анализа периферической крови у взрослого человека Ситуационные задачи
8. Определение скорости и времени свёртывания крови по методам Дьюка, Бюркера и Сухарева.
Метод Сухарева
Материал набирается в специальный сосуд - капилляр, который наклоняется в заданном ритме то влево, то вправо под определенным углом. Секундомером засекается время, когда кровь перестает свободно перемещаться внутри сосуда, то есть начинает свертываться. Время свертываемости крови (по Сухареву) в норме составляет: начало образования фибрина от 30 до 120 секунд, окончание процесса от 3-х до 5-ти минут.
Метод Бюркера
На стекле смешиваются равные по объему капли крови и дистиллированной воды. Включается секундомер и путем помешивания образовавшейся смеси регистрируется образование нитей фибрина.
Метод Дьюка
Обработать палец спиртом или эфиром. Сделать прокол мякоти пальца на глубину 3-3,5мм. Включить секундомер и снимать капли фильтровальной бумагой каждые 30 сек. Секундомер выключается в тот момент, когда на бумаге не останется следа крови. В норме время кровотечения равно 2-4 мин.
Для определения интенсивности кровотечения число капель крови на фильтровальной бумаге делят на время кровотечения. В норме она равна 2-3.
9. Определение группы крови.
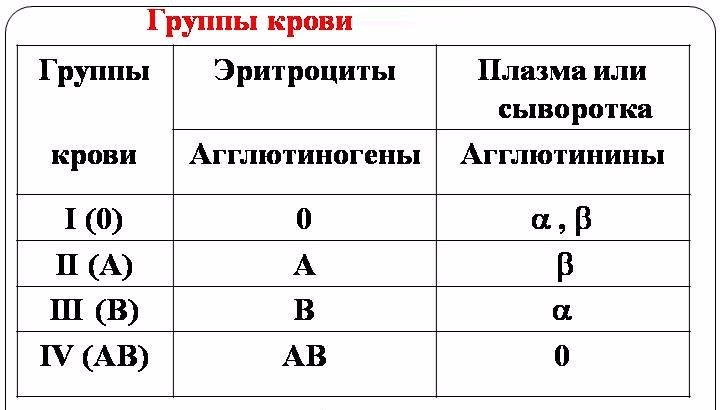
Методика: на специальные тарелки наносят (не смешивая!) по капле стандартной сыворотки 1, 2 и 3 групп, содержащей соответственно агглютинины 1 - альфа и бета; 2 - бета и 3 - альфа. Углом предметного стекла переносят небольшое количество крови, полученной из пальца, в каплю сыворотки 1 группы, затем вторым чистым углом предметного стекла такое же количество крови переносят в сыворотку 2 группы. Третью каплю переносят в сыворотку 3 группы третьим углом предметного стекла. Каждый раз тщательно размешивают кровь в капле сыворотки, пока смесь не станет равномерно розового цвета. Реакция агглютинации наступает через 1 — 5 мин. При наличии агглютинации капля становится прозрачной, а эритроциты склеиваются в виде комочков. Группа крови устанавливается в зависимости от наличия или отсутствия агглютинации.
10. Определение резус-принадлежности. В клинических условиях (в приёмном покое, хирургическом отделении, операционной), где нет специального лабораторного оборудования, используют экспресс-методы определения Rho(D) (D-фактора). Экспресс-метод определения стандартным универсальным реагентом в пробирке без подогрева
Для исследования можно использовать свежую несвернувшуюся кровь, взятую из пальца (или вены) непосредственно перед исследованием, или консервированную кровь без предварительной обработки, а также эритроциты из пробирки после формирования сгустка и отстаивания сыворотки.
Методика проведения реакции. Исследование проводят в центрифужных пробирках объёмом не менее 10 мл. На дно пробирки вносят одну каплю стандартного универсального реагента, представляющего собой антирезусную сыворотку группы АВ(IV), разведённую 33% раствором декстрана (ср. мол. масса 50 000-70 000). Затем в неё добавляют одну каплю исследуемой крови (или эритроцитов). Круговым вращением пробирки содержимое размазывают по её внутренней поверхности таким образом, чтобы содержимое растеклось по стенкам. Это значительно ускоряет агглютинацию и делает её крупнолепестковой. Агглютинация на стенках пробирки наступает, как правило, в течение первой минуты, но для образования устойчивого комплекса антиген-антитело и чёткой агглютинации наблюдать следует не менее 3 мин. Затем для исключения неспецифической агрегации эритроцитов в пробирку добавляют 2-3 мл физиологического раствора и перемешивают путём одно-двукратного перевертывания пробирки (без взбалтывания!).
Трактовка результатов. Наличие агглютинации (крупные хлопья на фоне просветлённой жидкости) указывает на резус-положительную принадлежность исследуемой крови. Отсутствие агглютинации (в пробирке гомогенно окрашенная розовая жидкость) свидетельствует о резус-отрицательной принадлежности исследуемой крови.

Вода (мл) |
0,1 |
0,2 |
0,3 |
0,4 |
0,5 |
0,55 |
0,6 |
0,62 |
0,65 |
0,7 |
1%р-р NаСl (мл) |
0,9 |
0,3 |
0,7 |
0,6 |
0,5 |
0,45 |
0,4 |
0,38 |
0,35 |
0,3 |
Полученная концентрация (%) |
0,9 |
0,8 |
0,7 |
0,6 |
0,5 |
0,45 |
0,4 |
0,33 |
0,35 |
0,3 |
Известно, что в гипотонических растворах эритроциты набухают и лопаются, в результате чего гемоглобин выходит в окружающую среду. Это явление называется гемолизом. В крови человека имеются эритроциты, обладающие различной устойчивостью к действию гипотонических растворов. Необходимо определить максимальную концентрацию хлористого натрия, при которой начинается (минимальная осмотическая стойкость) и заканчивается (максимальная осмотическая стойкость) гемолиз. С этой целью из рабочего (1%) раствора хлорида натрия готовится серия разведений по следующей схеме:
В каждую пробирку вносится по капле крови, которую тотчас же перемешивают с раствором и оставляют стоять при комнатной температуре в течение 10 мин. Для здоровых людей верхняя (минимальная) граница осмотической стойкости соответствует 0,42-0,48% NаСl. При этом разрушаются наименее устойчивые к осмотическому давлению эритроциты. Полный же гемолиз (максимальная граница стойкости) происходит при 0,30-0,34% NаСl.
