
диссертации / 32
.pdf101
На первые сутки число актов принюхивания лдостоверно увеличилось относительно исходного уровня на 41,1%. На 7 сутки наблюдалось достоверное снижение количества реакций принюхивания и составило 74,7% от исходного уровня. К 14 сутки количество принюхиваний также было достоверно ниже исходного уровня (70%).
При исследовании времени замирания при тестировании в «открытом поле» отмечено достоверное увеличение суммарного времени замирания относительно исходного уровня во всех исследуемых группах животных во всех последующих тестах (рис. 31). Исходное суммарное время замирания статистически не отличалось во всех исследуемых группах животных и составляло 1-10 с, в среднем от 1,88±0,26 с до 5,75±2,20 с для разных групп. Время замирания в группе интактных животных на 1, 7 и 14 сутки исследования увеличилось в 8,54, 10,46 и 6,61 раза соответственно (рис. 30) относительно исходной соответственно и составило 31,71± 4,26, 38,86±8,35 и 24,57±11,15 с. Можно предположить, что это связано с стрессирующим воздействием навигационного обучения в «водном лабиринте Морриса», что ухудшило эмоциональный статус животных и привело к усилению пассивнооборонительной стратегии поведения. В контрольной группе, получавшей физраствор, суммарная длительность времени замирания на 1, 7 и 14 сутки постгипоксического периода увеличилась в 10,9, 7,7 и 7,17 раза соответственно и составила 49,0±20,12 с, 34,7±10,6 с и 32,3±8,2 с. Во второй контрольной группе, получавшей инъекцию растворителя, длительности замираний увеличились в 13,5, 13,7 и 9,2 раза соответственно.
Достоверных отличий между опытными, контрольными и интактными животными в соответствующие сроки исследования не отмечено. Суммарное время замирания в группе. получавшей инъекцию Реамберина составило 29,44±10,36 с на 1-е сутки постгипоксического периода, 21,0±4,01 с на 7-е сутки и 45,86±10,78 с на 14-е сутки.

102
Рисунок 31. Влияние N-арахидоноилдофамина на изменение времени замирания мышей после моделирования ОГБГ. Полученные данные нормированы относительно исходного уровня, принятого за единицу; * - статистически значимые различия по сравнению с исходным уровнем, p < 0,05 (критерий Манна-Уитни)
В опытной группе животных, превентивно получавших N-ADA в дозе 2,5 мг/кг суммарное время замирания составило 39,86±9,12 с, 55,63±16,74 с и 61,38±17,8 с соответственно. В группе интактных животных, получавшей N- ADA 6 мг/кг также отмечено увеличение времени замирания в 4,57, 13,05 и 17,47 раза (рис. 32). В группе N-ADA 10 мг/кг суммарное времени замирания на 1-е, 7-е и 14-е сутки постгипоксического периода увеличилось в 9, 16 и 21
раз и составило 20,0±8,28, 35,2±10,48 и 46,0±12,47 с соответственно.
При исследовании собственного действия N-ADA вне гипоксии также отмечено достоверное увеличение времени замирания в течение всего периода наблюдения в 6,2 раза на 1-е сутки после введение эндоканнабиноида, 16,3 раза на 7-е сутки и 14,6 раза на 14-е сутки (рис. 31).

103
Рисунок 32. Влияние N-арахидоноилдофамина 6 мг/кг на изменение времени замирания мышей в тесте «открытое поле». Полученные данные нормированы относительно исходного уровня, принятого за единицу
Таким образом, нами было выявлено, что гипоксическое повреждение вызывает достоверное снижение двигательной активности контрольной группы животных, получавших инъекцию физиологического раствора, на первые сутки после моделирования гипоксии с последующим ее восстановлением к 14 суткам постгипоксического периода. Во 2 контрольной группе, двигательная активность 14 дню она не нормализовалась и на 14 сутки была достоверно ниже, чем у интактной группы. Превентивное внутрибрюшинное введение N-арахидоноилдофамина позволяет предотвратить вызванное гипоксией снижение двигательной активности. При введении N-ADA в дозах 2,5 и 6 мг/кг двигательная активность уже на первые сутки после гипоксии была достоверно выше по сравнению с контрольной группой, получавшей физиологический раствор и не отличалась от уровня активности интактных животных. На 14 сутки во всех опытных группах уровень двигательной активности не отличался от интактной группы. Аналогичная картина наблюдалась и у животных при введении реамберина. Было отмечено достоверное увеличение веремени замирания во всех группах животных после навигационного обучения. Снижение двигательной активности и эмоциональлного статуса вероятно связано с
104
развитием пассивно-оборонительной тактики поведения мышей в ответ на стрессорное воздействие «водного лабиринта Морриса».
Гипоксия провоцирует массовую апоптотическую гибель нервных клеток, вызванную активацией свободно-радикальных процессов и разобщением окислительного фосфорилирования, а также эксайтотоксичностью (Проблемы гипоксии... 2004). Взаимодействие N-ADA с каннабиноидными рецепторами способно не только предотвращать апоптотическую гибель клеток (Bobrov et al., 2008), но и, вероятно, сохранять функциональные связи между клетками в нейронных сетях, что предотвращает нарушение поведенческих реакций у мышей в постгипоксическом периоде.
3.2.3 Влияние N-арахидоноилдофамина на навигационное научение и долговременную память у мышей в тесте «Водный лабиринт Морриса»
Состояние долговременной памяти животных оценивалось через сутки после моделирования ОГБГ путем отсроченного тестирования в водном лабиринте Морриса. Тест состоял из одной пробы длительностью 60 секунд. При этом платформа в лабиринте отсутствовала. Были установлены основные стратегии поиска платформы. В процессе предварительного обучения у мышей наблюдалось формирование пространственной памяти. Время нахождения платформы сокращалось, поиск цели становился направленным, как правило, характеризующимся циркулярными и радиальными движениями. При проведении тестирования для оценки состояния долговременной памяти, платформу из лабиринта удаляли, и фиксировали траектория движения животного. Долговременная память оценивалась с помощью отсроченного коэффициента сохранения (оКс) – доли времени пребывания животного в секторе бассейна, где находилась платформа, по отношению в общему времени пребывания животного в
105
лабиринте. При этом считается нормой, если оКс составляет 23-30% (D'Hooge, De Deyn, 2001).
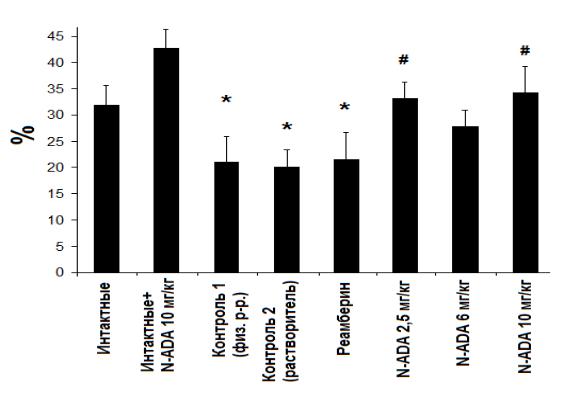
Острая гипобарическая гипоксия оказывала негативное влияние на сохранение долговременной памяти. Отсроченный коэффициент сохранения в обеих контрольных группах был заметно ниже, чем у интактных животных
(рис. 33).
Рисунок 33. Значения отсроченного коэффициента сохранения долговременной памяти у мышей после воздействия острой гипобарической гипоксии, % (М±m), *-статистически значимые различия по сравнению с интактными животными, # - статистически значимые различия по сравнению с контролем 1 и контролем 2, p < 0,05 (критерий манна-Уитни).
Коэффициент сохранения памяти снизился с 31,87±3,74 у интактных животных до 21,01±5,83 и 19,95±3,36 в контрольных группах 1 и 2 соответственно. Классический антигипоксант реамберин не оказывал влияния на сохранение долговременной памяти при ОГБГ. оКс в группе
106
мышей, превентивно получавших препарат сравнения, был достоверно ниже, чем у интактных животных (21,53±5,09).
Применение N-ADA при ОГБГ позволяло сохранить долговременную память животных после навигационного научения на уровне интактных животных. Наилучший эффект отмечен при использовании N-ADA в дозах 2,5 мг/кг и 10 мг/кг. коэффициент сохранения памяти в группе N-ADA 2,5
мг/кг составил 33,08±3,11, в группе N-ADA 6 мг/кг 25,74±3,12, в группе N- ADA 10 мг/кг 34,17±7,43 Таким образом, нами показано, что N-ADA обладает нейропротекторным действием, предотвращая мнестические нарушения у животных после гипоксического воздействия (Митрошина с соавт., 2012).
Для оценки собственного воздействия N-ADA на оКс долговременной памяти животным одной из подопытных групп был введен исследуемый эндоканнабиноид (6 мг/кг) в отсутствие гипоксического воздействия. В данной группе оКс, хотя и был несколько выше, чем у интактных животных (42,7±4,7), однако различие было статистически недостоверным.
Чтобы выявить механизм нейропротекторного действия N-ADA, было исследовано его воздействие на сохранение долговременной памяти в комбинации с антагонистами CBR-1, CBR-2 и TRPV1 (Таблица 4). Блокада CBR-2 и TRPV1 не препятствовала нейропротекторному действию N-ADA, а блокада CBR-1 вызвала тенденцию к его снижению (оКс составил 22,38±3,57). Следовательно, одним из важных механизмом в реализации нейропротекторного эффекта N-ADA является активация каннабиноидных рецепторов 1 типа, однако существенную роль при системном действии N- ADA in vivo играют и другие рецепторы, в том числе CBR-2 и TRPV1, которые также вносят вклад в запуск адаптационных механизмов, позволяющих организму переносить гипоксическое повреждение и блокада одного из них не является критическим фактором.
107
Таблица 4. Значение отсроченного коэффициента сохранения долговременной
памяти у мышей после моделирования ОГБГ
|
|
Группа животных |
оКс, усл.ед. |
|
|
|
|
Интактные |
|
31,87±3,74 |
|
|
|
|
|
Контроль 1 |
(с физ.раствором) |
21,01±5,83 * |
|
|
|
|
|
Контроль 2 |
(растворитель) |
19,95±3,36* |
|
|
|
|
|
N-ADA 6 |
мг/кг + SR1 1 мг/кг |
22,38±3,57 |
|
|
|
|
|
N-ADA 6 |
мг/кг + SR2 1мг/кг |
30,06±5,86 |
|
|
|
|
|
N-ADA 6 |
мг/кг + cpz 1 мг/кг |
25,32±5,50 |
|
|
|
||
* - статистически значимые различия по сравнению |
с интактными |
||
|
|
животными, p < 0,05, критерий Манна-Уитни |
|
Возможно, свой вклад в нейропротекторное действие N-ADA вносит также либо нерецепторный путь воздействия эндоканнабиноида (Castillo et al., 2012), либо активация других типов рецепторов, к которым аффинны некоторые канабиноиды, например, GPR55 орфанового рецептора (Ryberg et al., 2007; Szabo, 2008). Однако литературные данные, является ли N-ADA лигандом GPR55 рецептора на сегодняшний день отсутствуют.
С целью изучения влияния ОГБГ на процессы воспроизведения памяти, нами было изучено изменение стратегии поиска платформы при отсроченном тестировании, оцениваемой по изменению траектории животных при помощи графиков посещаемости секторов лабиринта Морриса. С помощью пакета программ Matlab лабиринт был условно разделен на секторы, оценивалось число посещений каждого сектора до того момента, когда мышь нашла бы платформу, если бы она была в лабиринте. Выявлено 3 основных стратегии поиска цели (рис. 34): первая стратегия – 1) прямое достижение цели – животное непосредственно направлялось к месту расположения платформы (время трека до достижения места латентного нахождения платформы 3-10сек); 2) активный поиск с учетом предыдущего опыта, время

108
нахождения платформы невелико (10-20сек); 3) хаотический поиск – отсутствие выраженной стратегии достижения цели (более 20 сек). Также в некоторых группах присутствовали животные, которые не достигли бы платформы за все время проведения тестирования (отрицательный результат).
Рисунок 34. Основные стратегии поиска цели при тестировании долговременной памяти в лабиринте Морриса: А- прямой поиск, Б - активный поиск, В - хаотический поиск, Г - отрицательный результат
Воздействие острой гипобарической гипоксии негативно сказывалось на сохранении стратегии поиска цели животным в лабиринте Морриса. В интактной группе, не подвергавшейся действию ОГБГ, не было животных с отрицательным результатом поиска цели. Большая часть животных (55,5%) непосредственно находилась к месту расположения цели. Поиск с учетом предыдущего поиска и хаотический поиск представлены одинаково и встречались у 22,2% животных (рис. 35).
После воздействия острой гипобарической гипоксии распределение животных по стратегиям поиска существенно нарушалось. В обеих контрольных группах (животные, которым вводили либо физиологический, либо инъекционный раствор) появлялись мыши, которые не нашли платформу за все время тестирования. Доля животных, показавших отрицательный результат, в обеих контрольных группах составила 43% (т.е. была наиболее велика), а тех, которые искали платформу хаотически, без учета прошлого опыта, составила в первой контрольной группе 28,5%, а во второй – 14,3%.

109
Рисунок 35. Распределение стратегий поиска цели в группах животных при отсроченном тестировании в водном лабиринте Морриса после воздействия ОГБГ
Доля животных, которые твердо помнили расположение платформы и сразу направлялись к цели, в 1 контрольной группе была наименьшей и составила 14,4%, а во 2 такая стратегия поиска полностью отсутствовала.
Таким образом, острая гипобарическая гипоксия вызывает грубые нарушения мнестических функций ЦНС у мышей, проявляющиеся в ухудшении долговременной памяти и изменении стратегии поиска цели при тестировании в «водном лабиринте» Морриса. Большая часть особей при
110
проведении тестирования демонстрировала циркулярные движения вдоль стенок бассейна, что можно объяснить врожденной программой поведения – тигмотаксисом, т.е. демонстрировали поведение, характерное для необученных животных.
Превентивное введение N-ADA нивелировало негативные последствия гипоксического повреждения головного мозга. Во всех трех опытных группах, получавших N-ADA перед подъемом на высоту, животные, которые не смогли бы найти платформу, отсутствовали. В группах, получавших N- ADA в дозах 2,5 мг/кг и 10 мг/кг, наибольшую долю составляют животные, использующие стратегию поиска с учетом научения (55,5 и 60%, соответственно). Животные, направлявшиеся непосредственно к цели составляли 33,33 и 20%, соответственно. В группе, получавшей N-ADA в дозе 6 мг/кг, стратегии поиска распределились следующим образом: непосредственно к цели направлялось 37,5% животных, искали цель активно с учетом опыта 25% и искали цель хаотически 37,5%.
Тестирование животных в «водном лабиринте» Морриса показало, что N-ADA существенно улучшает мнестические функции после гипоксического повреждения, сохраняя долговременную пространственную память и стратегию поиска цели. Максимальное нейропротекторное действие отмечено при использовании концентраций 2,5 и 10 мг/кг.
Предварительными результатами в наших исследованиях было показано, что антагонисты CBR-1, CBR-2 и TRPV1 в отсутствие гипоксии не влияли на поведение животных как в открытом поле, так и при исследовании локомоторной памяти в тесте «лабиринт Морриса». При блокаде CBR-1 и TRPV1 во время гипоксии выявляются мыши, показывающие отрицательный результат (12,5% и 16,6 %, соответственно). Больше всего животных применяло стратегию активного поиска (37,5% и 33,3% соответственно). При блокаде CBR-1 во время гипоксии 25% животных использовало стратегию хаотичного поиска, 25% направлялись к месту нахождения цели. При блокаде TRPV1 во время гипоксии к цели направлялось 33,3% животных.
