
SRCWFBHKn8
.pdfемах гумусовые кислоты не были обнаружены. Так, например, в реке Дон
ив водах из Кадамовского пруда (Ростовская область). Фульвокислоты значительно преобладают в природных водах над содержанием гумусовых кислот (в 10–100 и более раз). Так, количество фульвокислот в тех же северных реках колебалось от 1 510 до 2 010 мкгС/л со средним 1 995 мкгС/л. Содержание фульвокислот в Кадамовском пруду составило 1 138 мкгС/л и р. Дон – в среднем 514 мкгС/л (Генералова, 1974).
Гумус создается частично автохтонно как побочный продукт микробиологических трансформаций разнообразных биохимических соединений, образующихся из мертвых клеток и внеклеточных продуктов жизнедеятельности различных водных организмов. Некоторые водные гумусовые вещества продуцируются автохтонно из белков, углеводов и липидов водорослей. В морском гумусе содержатся также фенолы, которые образуются как внеклеточные продукты метаболизма морских водорослей. Другая часть гумуса может попадать в природные воды и донные отложения с суши с поверхностными и подземными водами, поступающими в озера и океаны. В связи с этим большая часть аллохтонных гумусовых веществ встречается в некоторых внутренних водах и прибрежных районах озер и океанов. Основная часть гумуса наземного происхождения состоит из расщепленного лигнина волокнистых растений. Эти гумусовые вещества образуют комплексы с различными негумусовыми органическими соединениями, включая аминокислоты, углеводы, жирные кислоты, фенолы
ипорфирины (Секи, 1986).
Гумус может оказывать неблагоприятное воздействие на водные экосистемы. Причинами низкой продуктивности некоторых богатых гумусом экосистем могут быть иммобилизация микроэлементов, поглощение света, повышенная кислотность и возможное присутствие антибиотиков, таких, как фенолы. Однако положительное влияние водного гумуса, безусловно, больше. К одной из его полезных функций относится способность связывать металлы и обеспечивать катионный обмен. Удаляя тяжелые металлы и другие растворенные токсичные вещества, гумус способствует их детоксикации. Гумус также делает доступными для водорослей катионы питательных веществ, таких, как Fe3+, усиливая интенсивность дыхания и питания микробных клеток, выполняет определенные функции в физиологических процессах микроорганизмов и стимулирует их рост. Металлические гуматы играют важную роль в процессах связывания и освобождения фосфатов. Однако наиболее благоприятное воздействие водного гумуса, очевидно, проявляется в том, что он способствует поддержанию стабильности водных экосистем, поскольку гумус имеет большое значение для функционирования биотической компоненты (Секи, 1986).
10
1.3.Выделения водорослей и макрофитов
иих биологическое значение
Еще Пюттер (Pütter, 1924) полагал, что растворенное органическое вещество в водоемах в определенной части формируется за счет прижизненных выделений фитопланктона в процессе роста. Последующие многочисленные исследования, проведенные на водорослях, показали, что состав выделений их весьма разнообразен, а количества веществ настолько значительны, что могут оказывать влияние на свойства среды обитания, стимулируя или подавляя жизнедеятельность других обитателей той же среды. Внешними метаболитами водорослей могут быть, кроме аминокислот и углеводов, полипептиды, амины, сахароспирты (глицерол, маннитол), фенолы, эфирные масла, индолы и другие соединения. Кроме того, внеклеточными продуктами водорослей могут быть обнаруженные в морской воде элементы первичной структуры нуклеиновых кислот: аденин, гуанин, нуклеотиды, в частности аденозинфосфаты, и нуклеозиды.
При фиксации углекислого газа морскими водорослями в ходе фотосинтеза 5–35% продуктов метаболизма может высвобождаться в виде растворимого органического углерода (Израэль, Цыбань, 1989). Естественные популяции морского фитопланктона интенсивно выделяют во внешнюю среду до 20% (Хайлов, 1971), а по другим данным до 35–40% (Antia, 1963) ассимилируемого углерода. По новейшим сообщениям итальянских ученых для Средиземного моря аналогичные величины составляют 44,4–66,3% в летний период, а осенью экскретирующая активность массовых видов фитопланктона (диатомовые, динофлагелляты) снижается при-
мерно в два раза (Vichi et al., 1998).
Для морских макрофитов показано, что выделения у Laminaria digitata и Fucus vesiculosus составляют 30–35% (до 40%) синтезирован-
ных соединений (Sieburth, 1969; Sieburth, Jensen, 1969). Концентрация РОВ в последнем случае в зарослях макрофитов может достигать
7–15 г/м3. Некоторые авторы (Holm-Hansen et al., 1968) считают, что со-
держание в океанической воде таких соединений, как ДНК, полностью определяется метаболической активностью микроводорослей и может быть использовано как показатель биомассы фитопланктона (Цит. по Пер-
люк, 1994).
У пресноводных организмов колебания в выделении экстраклеточных продуктов более значительны и составляют 7–50% от общего углерода, фиксированного в фотической зоне (Fogg, 1958; Fogg et al., 1965). Для культур зеленых пресноводных водорослей Chlorella pyrenoidosa, в частности, эта величина может достигать 20%, как и упомянутого выше морского фитопланктона (Максимова, Горская, 1980).
11
В конечном счете в формировании состава и количества растворенного органического вещества водорослевых сообществ принимают участие три процесса: прижизненные выделения, автолиз клеток и потребление органического вещества самими клетками водорослей. Прижизненные экзометаболиты водорослей являются одним из основных источников автохтонного растворенного вещества водоемов. Их вклад может составлять 50–80% всех внеклеточных органических веществ природного фитопланктона и несколько ниже – 30–50% – в условиях лабораторных культур (Бульон, 1977; Плеханов, Максимова, 1997). Остальная часть веществ, поступающих в водные экосистемы в результате жизнедеятельности водорослей, является продуктами автолиза и выхода содержимого клеток в окружающую среду.
Считают (Fogg, 1965), что клетки водорослей выделяют два основных типа продуктов. Промежуточные продукты относительно низкого молекулярного веса могут выделяться в море до превращения их в более устойчивые продукты метаболизма; при соответствующих условиях они могут частично вновь поглощаться из среды (например, гликолевая кислота). Так в опытах на Chlorella было показано, что гликолевая кислота, выделяемая водорослями в логарифмическую фазу роста, сокращает ее длительность, а затем вновь потребляется водорослями (Sen, Fogg, 1966, цит. по Максимовой и др., 1968). Вещества с более высоким молекулярным весом (полисахариды, полипептиды и др.) выделяются в среду в основном в зависимости от количества усвоенных клеткой веществ, т.е. в зависимости от скорости роста. Их обратное поглощение из среды незначительно.
Обобщенные Дж. Раймонтом (1983) данные по экскреции органического вещества планктонными водорослями из различных районов Мирового океана позволили выявить некоторые основные тенденции. С увеличением глубины общее количество выделяемых органических веществ уменьшается. Максимальные количества органических веществ в пределах эвфотической зоны выделяются в самых продуктивных водах, а минимальные – в олиготрофных. Однако в физиологическом плане, в пересчете на клетку, картина меняется в противоположную сторону (табл. 2).
Экскреция, рассчитанная в процентах от общей продукции, составляла 1% для высокопродуктивных (эвтрофных) вод и увеличивалась до 49% в поверхностных олиготрофных, а также с глубиной. Различия экскреции в олиготрофных и эвтрофных водоемах во многом связаны с плотностью клеток и так называемой функцией «концентрации среды» (рис. 1). Соответствующие эксперименты на культурах водорослей показали обратную зависимость между плотностью и количеством выделенных (прижизненно) органических веществ (рис. 2) (Зимина, Сазыкина, 1987; Плеханов, Максимова, 1997).
12
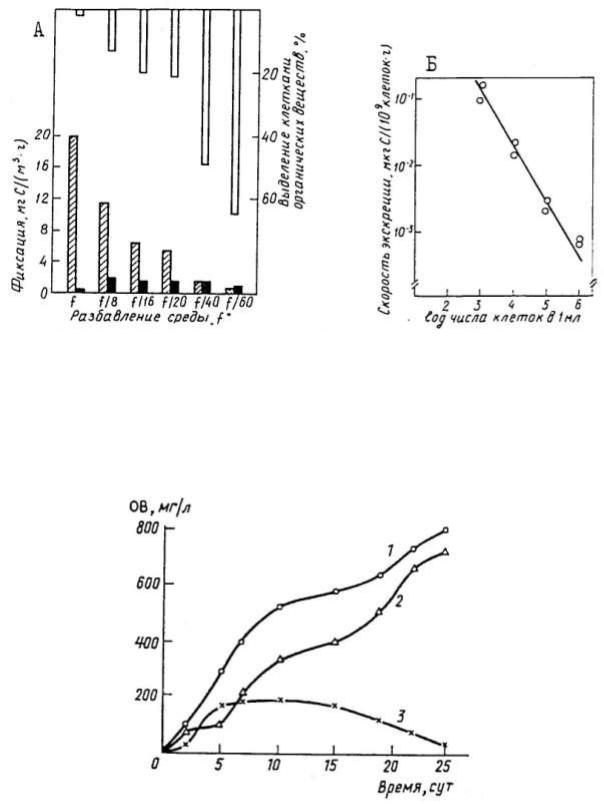
Рис. 1. A – зависимость скорости фиксации (светлая штриховка) и выделения из клеток растворенных органических веществ (закрашено) от концентрации среды / в культурах диатомеи Skeletonema. Скорость выделения органических веществ показана также в процентах от фиксации (верхние столбики. Б – зависимость абсолютных количеств выделяемых веществ на клетку от концентрации клеток Skeletonema (Раймонт,
1983).
Рис. 2. Внеклеточное органическое вещество (ОВ) культуры водорослей Chlorella pyrenoidosa на этапах развития от лаг-фазы до выхода на стационарное состояние: 1 – общее внеклеточное ОВ, 2 – ОВ автолитического происхождения, 3 – прижизненные выделения (Плеханов, Максимова, 1997).
13
Таблица 2
Экскреция фитопланктона в различных районах Мирового океана (Из Раймонта, 1983)
Район исследований |
Количество выделенных из клетки |
|
веществ, % от общей продукции |
||
|
||
Северное море |
7 |
|
Прибрежная антарктическая зона (эвтрофная) |
1–2 |
|
Прибрежная зона Индийского океана |
|
|
(олиготрофная) |
1–20 |
|
Южная часть Индийского океана |
5–32 |
|
Прибрежная зона Тихого океана: |
|
|
Эвтрофные поверхностные воды |
Более 1 |
|
Олиготрофные поверхностные воды |
35–40 |
|
Тропическая прибрежная зона (олиготрофная) |
В среднем 6,6 |
|
Эвтрофный эстуарий |
Менее 7 |
|
Атлантические прибрежные |
|
|
Поверхностные воды |
Менее 13 |
|
Подповерхностные воды |
Менее 21 |
|
Западная часть Саргассова моря (олиготрофная) |
Менее 44 |
|
Перуанская зона: |
|
|
Поверхностные прибрежные воды |
1–3 |
|
Прибрежные в столбе воды |
4–12 |
|
Удаленные от берега, в толще |
45 |
|
Океанические тропические воды Тихого океана |
30 |
В прибрежной зоне антарктических морей было обнаружено лишь незначительное количество углерода – приблизительно 1%, выделяемого клетками на глубине максимального фотосинтеза, но при меньших или больших интенсивностях света эта величина имела тенденцию к увеличению (Horne et al., 1969, цит. по Раймонту, 1983). Кроме того, при очень высоких интенсивностях света и соответствующем ингибировании фотосинтеза выделение могло достигать 38%. Отмечено, что фактором, увеличивающим экскрецию метаболитов клетками морского фитопланктона, может быть как низкая (у границы эвфотической зоны), так и высокая интенсивность света. При неких оптимальных условиях существования фитопланктона продуцирование экзометаболитов клетками водорослей минимально (Раймонт, 1983).
Среди органических метаболитов, выделяемых в среду различными водорослями, преобладают неспециализированные в отношении биохимических функций соединения, в основном продукты углеводного и азотного обмена. Основные идентифицированные органические вещества, экскретируемые фитопланктоном, могут быть представлены в виде семи основных классов (табл. 3). Кроме них выделяются и высокоспециализированные соединения: растительные гормоны, липиды, витамины, антибиотики, обладающие высокой биологической активностью (Тамбиев, Кирикова, 1992).
14

Таблица 3
Качественный состав экзометаболитов водорослей: в скобках приведены соединения, образуемые в результате гидролиза биополимеров (Из Лапина, Едигаровой, 1990)
Экзометаболиты |
Культуры водорослей |
|||||
Углеводы |
Anabaena cylindrica, Anabaena flos- |
|||||
Полисахариды (глюкоза, галактоза, араби- |
aquae, Nostoc sp.; Chlorella vulgarus, Ch. |
|||||
ноза, глюкуроновая и уроновая кислоты, |
pyrenoidosa, Ch. ellipsoidea, Scenedesmus |
|||||
ксилоза и др.) |
quadricauda, |
Chlamydomonas |
curyales; |
|||
|
Palmella mucosa |
|
|
|
||
Органические кислоты |
Oscillatoria aplendida, Microcystis aeru- |
|||||
Муравьиная, уксусная, яблочная, пропионо- |
ginosa, Anabaena variabilis, Phormidium |
|||||
вая, щавелевая, винная, лимонная, гликоле- |
uncinatum; Chlorella pyrenoidosa |
|||||
вая, молочная, пировиноградная, оксипиро- |
|
|
|
|
|
|
виноградная, -кетоглутаровая, ацетоуксус- |
|
|
|
|
|
|
ная, глиоксиловая, янтарная, виннокамен- |
|
|
|
|
|
|
ная, гаяловая |
|
|
|
|
|
|
Липиды |
Anabaena |
|
cylindrica, |
|
Anabaena |
|
Жирные кислоты – пальмитиновая, линоле- |
oscillatorioides, Microcystis |
aeruginosa; |
||||
вая, линоленовая |
Stepha-nodiscus hantzschii, Melosira |
|||||
|
varians; Euglenophyta |
|
|
|||
Полипептиды |
Anabaena cylindrica, Anabaena flos- |
|||||
Циклопептид (из семи аминокислотных ос- |
aquae, |
Synechococcus |
leopoliensus, |
|||
татков: аспарагиновой, глутаминовой, сери- |
Microcystis aeruginosa; Scenedesmus sp., |
|||||
на, валина, орнитина, аланина, лейцина) |
Pseudomonas sp. |
|
|
|
||
Гидроксамовые кислоты |
|
|
|
|
|
|
Белковоподобные вещества |
Anacystis |
nidulans, |
Anabaena |
cylindrica, |
||
Гистидин, аргинин, лейцин, изолейцин, |
Tolypothrix tenuis, Nostoc linckia f., |
|||||
цистин, серин, треонин, валин, глицин, про- |
Muscorum; |
Chlorella |
ellipsoidea, |
|||
лин, тирозин, триптофан, метионин, фени- |
Scenedesmus acuminatus; Euglenophyta |
|||||
лаланин, аспарагин, лизин, цистеин |
|
|
|
|
|
|
Свободные аминокислоты |
Lyngbya |
aestuarii, |
Anacystis |
nidulans, |
||
Лизин, треонин, аргинин, серин, гистидин, |
Microcystis |
aeruginosa, |
Phormidium |
|||
аспарагиновая и глутаминовая кислоты и др. |
uncinatum; Scenedesmus acuminatus |
|||||
Фенольные соединения |
Microcystis |
pulverea, |
|
Anabaena |
||
Полифенолы, флавоноиды |
variabilis; Scenedesmus acutus, Chlorella |
|||||
|
sp.; Ascophyllum |
nodosum, Fucus |
||||
|
vesiculosus |
|
|
|
|
|
Основными «поставщиками» РОВ в окружающую воду являются синезеленые водоросли, фотосинтез которых в начале «цветения» значительно превышает деструкцию. Изучение аминокислотного состава белков, экскретируемых синезелеными водорослями, свидетельствует о преимущественном положении некоторых аминокислот (Биохимия синезеленых.., 1978). По мере старения культур водорослей увеличивается содержание свободных аминокислот – цистина, лизина, серина, аспарагиновой и глутаминовой кислот. Аналогичное явление наблюдается и у диатомовых во-
15
дорослей (Кораблева, 1978; Лапин, Едигарова, 1990). Характерным отличием морских культур от пресноводных является более высокое содержание ароматических аминокислот в составе белковоподобных веществ.
Выделяемые синезелеными водорослями вещества значительно ослабляли ингибирующее действие на рост водорослей полимиксина В. Полимиксины – антибиотики полипептидной природы естественного происхождения, образуемые некоторыми штаммами Bacillus polymyxa. Если учесть, что в местах массового скопления синезеленых водорослей широко распространен B. polymyxa, очевидна экологическая роль выделений водорослей. Эти защитные вещества представляют полипептиды с максимумом абсорбции 280–290 нм и со сходным аминокислотным составом. В значительных количествах были обнаружены аланин, серин и глицин. Синезеленая водоросль Oscillatoria splendida также выделяет в окружающую среду аминокислоты и пептиды. Оказалось, что состав полипептидов сходен у Anabaena cylindrica, A. variabilis, Anacystis nidulans, Calothrix sp., Chlorogloea fritschii, Cylindrospermum sp., Mastigocladus laminosus, Microcoleus vaginatus, Nostoc sp., N. commune, Pseudoanаbaena sp., Synechocystis salina, Microcystis aeruginosa и Oscillatoria planktonica. Общее количество выделяемых водо-
рослями полипептидов достигало примерно 50% сухого вещества. Перидинеи, как и другие водоросли, выделяют в среду азотсодержа-
щие метаболиты. Так, в воде восточной части Мексиканского залива, которая «цвела» Gymnodimium breve, после гидролиза извлеченных органических соединений обнаружили много аспарагиновой и глутаминовой кислот, а также лейцина и изолейцина. Количество органического азота в воде было высоким – до 20 мкг/л, и состоял он в основном из аминокислот.
20-дневная культура красной водоросли Porphyra cruentum около 15% органического вещества выделяла в среду в виде слизи. Оказалось, что выделяется кислый белково-полиозный комплекс, содержавший 6–7% белка и сходный с веществом клеточных стенок водорослей. Углеводная часть комплекса представляла собой агароподобный полисахарид с 10% связанного сульфата (Барашков, 1972).
Экзогенные фенольные соединения водорослей представлены, главным образом, полифенольными соединениями и, в частности, флавоноидами. Летучие фенолы, среди которых идентифицированы фенол и о-крезол, находятся в незначительном количестве. Максимальные концентрации фенольных соединений приходятся на периоды «цветения» водорослей (Козицкая, 1973; Лапин, Едигарова, 1990). Показано (in vitro), что фенольные соединения способны ускорять или подавлять рост организмов, оказывать воздействие на процессы развития, морфогенеза и репродукции, проявлять антимутагенную активность и даже регулировать синтез белка (Лукнер, 1979).
Среди разнообразных экзометаболитов водорослей важное значение имеют амины. Они обладают высокой биологической активностью, а также играют значительную роль в формировании запаха и вкуса воды (Саке-
16
вич, 1985; Сиренко, Козицкая, 1988; Клоченко, 1994). Предполагают, что существуют два пути попадания аминов в окружающую воду: прямое выделение из клеток водорослей и вследствие трансформации аминокислот. Последние, как уже говорилось, в большом количестве выделяются водорослями в среду, а затем декарбоксилируются бактериями. Зеленые водоросли характеризуются достаточно разнообразным набором экзогенных аминов. Среди внеклеточных метаболитов Ankistrodesmus fusiformis и Scenedesmus acuminatus обнаружены соответственно 32 и 30 летучих азотсодержащих оснований (Клоченко и др., 1990). Установлено также, что качественный состав и количество попадающих в воду аминов определяются видовыми особенностями водорослей и их физиологическим состоянием.
Представлены амины и в культуральных средах других видов зеленых водорослей. Так, например, концентрация 1-аминопропана в среде в начале стационарной фазы роста Ankistrodesmus braunii составляла 300 мкг/л (Herrmann, Juttner, 1977). Указанные авторы обнаружили также бутаноламин в воде р. Рур при массовом развитии Chlamydomonas sp. В среде, где культивировали Chlorella vulgaris были идентифицированы первичные, вторичные и третичные амины: изопентиламин, ди-н-бутил- метиламин, триметиламин, н-пропил-н-пентиламин и другие (Клоченко, 1994). Амины в значительном количестве высвобождаются из клеток и попадают в воду при анаэробном распаде водорослей. В частности, при разложении Scenedesmus acutus в среде обнаружено 18 аминов.
Красные и диатомовые водоросли также выделяют азотсодержащие основания. Так, 3-метилбутиламин найден в среде, где культивировали
Polysiphonia urceolata (Rhodophyta), а в культуральной среде Nitzschia actinastroides (Diatomeae) выявлены метиламин (50 мкг/л) и пропиламин
(66 мкг/л) (Клоченко, 1994).
Образование летучих аминов зафиксировано у активно вегетирующих культур синезеленых водорослей. В частности, концентрация 1-ами- нопропана в среде, где культивировали Microcystis aeruginosa достигала 240 мкг/л (Herrmann, Juttner, 1977). Всего в среде с микроцистисом удалось идентифицировать 22 летучих амина (Клоченко и др., 1990; Клоченко, 1994). Однако приведенные выше данные представляют, образно говоря, надводную часть айсберга, основная же часть азотсодержащих оснований (около 60 наименований), как впрочем и других органических соединений, попадают в окружающую воду при отмирании и распаде клеток водорослей в период их массового развития – «цветения».
В культуральной среде зеленых и синезеленых водорослей обычно накапливаются полисахариды. По некоторым данным (Moor, Tischer, 1964)
вкультуральной жидкости Anabaena flos-aquae количество полисахаридов
в3–10 раз больше, чем в их клетках (Цит. по Телитченко, 1974).
Вещества углеводной природы, выделяемые зелеными водорослями, могут составлять до 30% от всех внеклеточных органических веществ. К
17
8–10 суткам содержание углеводов в среде может достигать 40–50 мг/л. В логарифмическую фазу роста Scenedesmus quadricauda количество углеводов в среде составляло приблизительно 15–20% от всего количества углеводов, образованных культурой. Основную массу углеводов составляли полисахариды: до 66–99% от всех углеводов у Scenedesmus quadricauda и около 70% у Sc. оbliquus (Максимова и др., 1968).
Согласно данным С.В. Горюновой (1950), Аллена (Allen, 1956), И.В. Максимовой и М.Н. Пименовой (1969), других авторов в культуральных средах развивающегося фитопланктона в значительных количествах могут накапливаться органические кислоты, причем по мере старения клеток этот процесс становится более интенсивным. Содержание органических кислот
вкультуральных средах зеленых водорослей составляет 20–25% от всего количества экзометаболитов (Лапин, Едигарова, 1990) и, по мнению некоторых авторов (Максимова, Пименова, 1969), данные вещества экскретируются в водную среду клетками водорослей, а не являются продуктами распада других метаболитов. В фильтратах Scenedesmus и Chlorella были обнаружены такие кислоты, как гликолевая, молочная, уксусная и муравьиная. Причем нелетучие кислоты (гликолевая, молочная) обнаруживались
всреде лишь в первые сутки развития культуры водорослей и в очень малом количестве. Содержание летучих кислот в фильтратах было более значительным (23 мг/л), при этом количество уксусной кислоты – примерно в три раза больше муравьиной (17,2 против 5,6 мг/л) (Максимова и др., 1968). Известны также факты обратного потребления органических кислот
впроцессе жизнедеятельности водорослей (Минеева, 1961; Максимова и др., 1968; Пискунова, Пименова, 1970; Fogg, 1964). Замечено в частности, что уксусная кислота, как и гликолевая, способна поглощаться обратно клетками водорослей, в то время как содержание муравьиной кислоты увеличивается по мере роста плотности культуры (Максимова и др., 1968).
Среди выделяемых зелеными водорослями Chlorella vulgaris и Сh. protothecoides веществ при росте в миксотрофных условиях на глюкозе отмечают также глюконовую, яблочную и лимонную кислоты. В составе летучих веществ, выделяемых Ch. vulgaris и ее мутантами в присутствии сахара в среде обнаружили муравьиную кислоту – до 11% от сухого вещества клеток. В автотрофных условиях эти водоросли выделяли гликолевую кислоту. Максимальное выделение гликолата клетками Ch. pyrenoidosa наблюдалось при большей освещенности и недостатке СО2 (Барашков, 1972). У зеленых водорослей максимум выделения гликолевой кислоты наблюдали при концентрации 0,005–0,05 м/л НСО3- в среде (Merrett, Lord, 1973). Кислород стимулирует выделение гликолата водорослями (Максимова, Камаева, 1978; Bowes, Berry, 1971–1972). Величина рН влияет на выделение так же, как и на рост культуры: при рН 8,3 культура росла хуже, и выделение гликолата было меньше, чем при рН 6,4 (Барашков, 1972).
18
Среди внеклеточных продуктов зеленых водорослей гликолевая кислота обычна. В некоторых условиях ее выделение во внешнюю среду может составлять до 50% от общего ассимилированного углерода (Максимова, Горская, 1980; Fogg, 1971). Было обнаружено, что максимальное количество гликолата в среде накапливается при использовании 2–3-суточных культур водорослей, находящихся в стадии начала экспоненциального роста. На более поздних стадиях развития культур наблюдалось резкое снижение способности клеток выделять гликолевую кислоту. Сходные результаты были получены на водорослях рода Chlorella (Максимова, Даль, 1975; Watt, Fogg, 1966; Hellebust, 1974). Выделение клетками Scenedesmus quadricauda гликолата также максимально в начале экспоненциальной фазы роста культуры, а процесс накопления его в среде сопоставим с таковым у Chlorella (Максимова и др., 1999).
Наличие гликолевой кислоты в среде необходимо для роста Nannochloris oculata. В нейтральной среде водоросли росли лишь после лаг-периода, во время которого появлялись небольшие количества этой кислоты. Видимо, она требуется для связывания СО2 в процессе фотосинтеза. Гликолат не использовался 39 видами водорослей ни на свету, ни в темноте в нейтральной или слабощелочной природной воде. Однако на свету 4 мг/л гликолевой кислоты более, чем в 1,5 раза стимулировали рост Ch. pyrenoidosa. Очевидно, на свету гликолат через глиоксилат превращается в глицин. Увеличение концентрации гликолевой кислоты в среде задерживало рост водорослей. При выяснении причин выделения гликолата
всреду обнаружили, что в 5 штаммах Chlorella и Scenedesmus нет глико- лат-оксидазы, а серин образовывался не из гликолата, как у высших растений, а из 3-фосфоглицерата. Таким образом, неполный метаболизм гликолата в водорослях приводит к его выделению в среду (Барашков, 1972).
Всоставе внеклеточных органических веществ микроводорослей на долю липидов приходится 3–10% (Hellebust, 1974). Исследования О.А. Сидоровой и И.В. Максимовой (1985) показали, что зеленая водоросль Westella botryoides способна выделять липиды в среду, причем интенсивность этого процесса заметно меняется с ростом культуры. В экспоненциальную фазу роста водорослей количество внеклеточных липидов было незначительным, в стационарную фазу оно резко увеличивалось. Это может быть связано с усиленным поступлением их в среду за счет перестройки метаболизма при замедлении роста культуры, а также, начинающимся в стационарную фазу, разрушением клеток.
Для диатомовой водоросли Nitzschia ovalis описана следующая колебательная динамика выделения липидов: их содержание увеличивалось в начале логарифмической фазы роста, затем в середине этой фазы количество липидов в среде уменьшалось и вновь возрастало, достигая максимума в стационарную фазу роста. При этом процентное содержание липидов
всоставе растворенного органического вещества среды заметно менялось,
19
