
ОХТ (1)
.pdf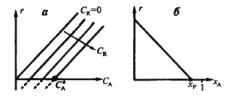
Общая химическая технология
КОНТРОЛЬНЫЕ ЗАДАНИЯ
Теоретические вопросы
10. Определение константы скорости реакции интегральным методом для обратимых реакций I порядка
Обратимая реакция типа А = R представлена кинетическим уравнением
первого порядка в обоих направлениях:
r = k1СА – kCR.
Поскольку скорость реакции зависит от концентраций двух компонентов, то зависимость r(СА) будет представлена серией кривых, полученных при разных значениях CR (рис. 1, а).
Рис. 1. Зависимость скорости обратимой реакции r от концентрации исходного компонента СА при различных значениях концентрации продукта CR (а) и от степени превращения хА (б)
Равновесие в обратимой реакции, когда r = 0, будет при определенном соотношении CR/CА = Кр. Точка СА* пересечения кривой r(СА) с осью абсцисс при каждом значении CR на рис. 1, а отвечает равновесию при этих концентрациях – СА* и CR. Если СА < СА* , то скорость становится отрицательной (пунктир на рис. 1, а) - реакция протекает в обратном направлении.
Закон действующих масс записывается следующим образом:
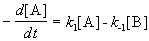 .
.
Если начальные концентрации веществ A и B обозначить, соответственно, a и b и ввести степень превращения x ([A] = a - x, [B] = b + x), то кинетическое уравнение приобретает вид:

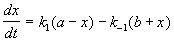 .
.
Решение этого уравнения можно выразить через степень превращения, соответствующую достижению равновесия:
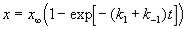 или
или 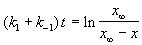 , (5.1)
, (5.1)
где x определяется условием равенства скоростей прямой и обратной реакций:
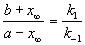 , откуда следует:
, откуда следует: 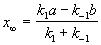 . (5.2)
. (5.2)
При t  наступает равновесие, которое характеризуется константой:
наступает равновесие, которое характеризуется константой:
Константа скорости прямой реакции
k |
|
|
X |
A |
* |
ln(1 |
X |
A |
) |
||
|
|
|
|
|
|||||||
пр |
|
|
X |
|
|
* |
|||||
|
|
|
|
|
|
|
|||||
|
|
|
|
|
A |
|
|||||
|
|
|
|
|
|
|
|
|
|
||
Равновесная степень превращения
X |
|
* |
k * |
|
A |
k * |
|||
|
1 |
|||
|
|
k* – константа равновесия, обозначается также как К
Уравнения кинетические для обратимой реакции первого порядка имеют такой же вид, как и для необратимой реакции, с той разницей, что вместо начальной концентрации фигурирует равновесная, а константу скорости необратимой реакции заменяет сумма констант для прямой и обратной реакций.
После преобразования получим
Второй член в фигурных скобках равен 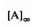 Следовательно,
Следовательно,
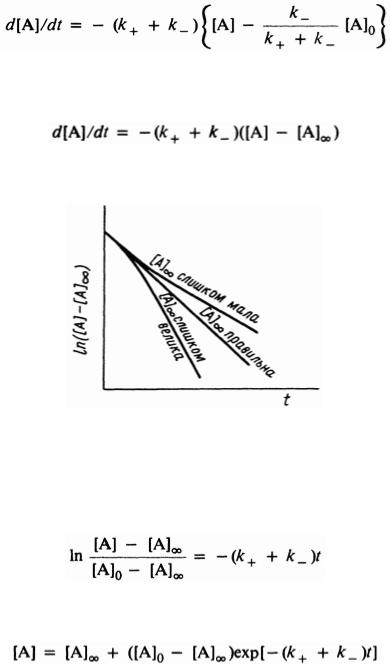
Рис. 2. График полулогарифмической зависимости для обратимой реакции первого порядка в случае, когда равновесная концентрация точно не известна.
Это уравнение легко проинтегрировать:
или
График зависимости, представленный на рис.2, дает прямую с угловым коэффициентом, равным (k1 k2 ) ( (k k ) ). В случае медленных реакций
бывает трудно точно определить равновесную концентрацию, и доступной оказывается только концентрация в интервале [ A] [ A] . Тогда
эффективную константу скорости можно найти с помощью касательной к кривым ln([ A] ([ A] [ A] )) и ln([ A] ([ A] [ A] )) в точках, соответствующих
t=0(рис. 3).
Следует особо отметить, что, хотя измеряют уменьшение [ A] получают сумму констант скоростей прямого и обратного процессов. Разделение этих констант достигается с помощью константы равновесия.
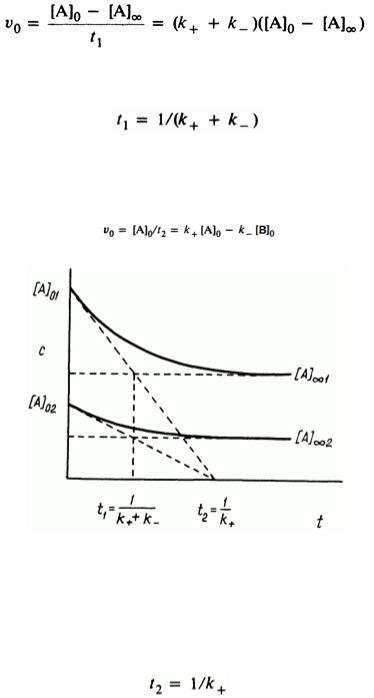
Теперь рассмотрим начальные скорости. Значение абсциссы для точки пересечения касательных в начальном и конечном участках кривой находят по выражению
откуда
Касательная к начальному участку кривой при t=0 пересекает абсциссу в точке t2
Рис. 3. Касательные к кривым зависимости с - t для обратимой реакции первого порядка.
Поскольку в начале реакции присутствует только А, второе произведение равно нулю и
Очевидно, ни t1 ни t2 не зависят от начальной концентрации; это хорошо видно из рис. 3. В особом случае, когда константы k равны, [ A] [ A]0 / 2
отсюда t1 1/ 2k и t2 1/ k .
На рис. 4 показана зависимость скорости от концентрации для различных начальных концентраций. Угловые коэффициенты прямых, проходящих через абсциссу, равны сумме k k . Линия, соединяющая точки начальных
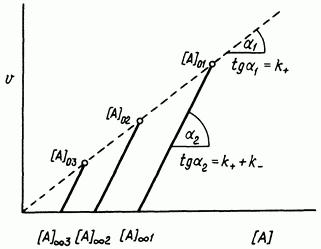
скоростей, представляет собой проходящую через начало координат прямую с угловым коэффициентом k .
Рис. 4. Зависимость скорости от концентрации для обратимой реакции первого порядка.
Список литературы:
1.Шмид Р., Сапунов В. Н. Неформальная кинетика. В поисках путей химических реакций: Пер. с англ. – М.: Мир, 1985. – 264 с., ил
2.Бесков В.С., Сафронов В.С. Общая химическая технология и основы промышленной экологии: Учебник для вузов. – М.: Химия, 1999, 472 с.: ил.
3.Основы физической химии. Теория и задачи: учеб. пособие для вузов / В.В. Еремин, С.И. Каргов, И.А. Успенская, Н.Е. Кузьменко, В.В. Лунин.
— М.: Издательство «Экзамен», 2005. — 480 с. (Серия «Классический университетский учебник»)
КОНТРОЛЬНЫЕ ЗАДАНИЯ
Контрольные задачи
Задача 1. Определить расход воздуха для сжигания 100 м3 газа, если
известен коэффициент избытка воздуха . Определить |
содержание водяного |
|||
пара в продуктах сгорания в массных и мольных концентрациях, |
если |
|||
соотношение кислорода и азота в воздухе составляет: О2 : N2 |
= 1: 3,76. |
|||
|
|
|
|
|
Вариант |
Сжигаемый газ |
|
Коэффициент |
|
|
избытка воздуха |
|||
|
|
|
||
|
|
|
|
|
10 |
Бутан |
|
1,4 |
|
|
|
|
|
|

Решение
Реакция горения
С Н |
6,5(О |
3,76N |
) 4CO |
5H |
O 6,5 3,76N |
2 |
|
4 |
10 |
2 |
2 |
2 |
2 |
|
|
Молярная масса
МС4 Н10 58 г / моль
МH2O 18 г / моль
М |
О |
32 г / моль |
|
2 |
|
М |
N |
|
2 |
28 г / моль
М |
CО |
44 |
г / моль |
|
2 |
|
|
Количество вещества (по уравнению)
n |
|
Н |
1 |
|
|
|
С |
|
|
|
|||
|
4 |
|
10 |
|
|
|
n |
H |
O |
5 |
|
|
|
|
2 |
|
|
|
|
|
n |
|
|
6,5 |
|
|
|
О |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
n |
N |
24, 440 |
|
|
||
|
2 |
|
|
|
|
|
n |
|
|
|
4 |
|
|
CО |
|
|
|
|
||
|
|
2 |
|
|
|
|
В |
|
|
100 м3 бутана |
при нормальных |
условиях содержится |
|
100:22,4 = 4,4643 кмоль бутана, что составляет 58×4,4643 = 258,9294 кг. Для сжигания этого количества бутана необходимо 6,5×32×4,4643 =928,5744 кг кислорода, а с учетом коэффициента избытка воздуха (пусть α= 1,4) количество кислорода будет 928,5744×1,4 =1300,00416 кг. При этом в систему поступит 1300,00416× 3,76 =4888,0156 кг азота (так как соотношение кислорода и азота в воздухе составляет 1:3,76).
Тогда расход воздуха составит 1300,00416+4888,0156 = 6188,0198 кг. При горении бутана образуется 18 ×5× 4,4643= 401,7870 кг водяного пара и 44 ×4× ×4,4643= 7642,8848 кг углекислого газа. Содержание водяного пара в продуктах сгорания с учетом азота составит:
в массных долях:
Х |
H |
O |
|
2 |
|
|
401,7870 |
0,0311 |
|
401,7870 |
|||
4888,0156 |
7642,8848 |
в мольных долях:
Х H O |
|
|
401, 7870 |
/18 |
0, 0602 |
|
|
|
|||
|
401, 7870 |
/18 7642,8848 / 44 |
|||
2 |
4888, 0156 / 28 |
|
|||

Задача 2. Составить материальный баланс на 1 т продукта и определить тепловой эффект реакции (целевой продукт подчеркнут).
Вариант |
|
Тип реакции |
6-10 |
H2SO4 2NH3 |
(NH4 )2 SO4 H |
Значения теплот образования веществ:
HNaCl= 410,9 кДж/моль;
HNa2SO4= 1384 кДж/моль;
H NH3=46,2 кДж/моль;
HH2SO4= 811,3 кДж/моль;
HHCl= 92,3 кДж/моль;
H(NH4 )2 SO4= 132 кДж/моль.
Решение Запишем реакцию
H SO 2NH |
3 |
(NH |
) |
SO |
H |
|
2 |
4 |
4 |
2 |
4 |
|
|
Количество вещества (по уравнению)
nH2 SO4 1 nNH3 2
n( NH4 )2 SO4 1
Выпишем значения молекулярных масс
М |
H SO |
98 г / моль |
|
|
2 |
4 |
|
М |
NH |
|
3 |
17 г / моль
М |
( NH |
4 |
) |
SO |
132 г / моль |
|
|
2 |
4 |
|
Найдем количество вещества
n( NH4 )2 SO4 1 106 /132 7575.7576 моль
Массы исходных веществ

|
|
|
m |
|
SO |
98 7575.7576 742424.2448 г 742.4242 кг |
|
|
|||||||||||||||||
|
|
|
|
H |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m |
|
|
17 7575.7576 2 257575.78584 г 257.5758 кг |
|
|
|||||||||||||||||
|
|
|
|
NH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Материальный баланс (получение 1000 кг сульфата аммония) |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
Расход |
|
|
|
|
|
|
|
|
|
|
Приход |
|
|
|||||||||
|
|
|
Вещество |
|
|
|
|
|
Масса, кг |
|
|
Вещество |
Масса, кг |
|
|||||||||||
|
|
|
|
2 |
|
|
4 |
|
|
|
|
|
|
742,4242 |
|
|
|
4 |
|
2 |
4 |
1000 |
|
||
|
|
|
H |
SO |
|
|
|
|
|
|
|
|
|
|
|
(NH |
|
) |
|
SO |
|
|
|||
|
|
|
NH |
3 |
|
|
|
|
|
|
|
257,5758 |
|
|
Всего |
|
|
1000 |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
Всего |
|
|
|
|
|
|
1000 |
|
|
|
|
|
|
|
|
|
|
|||||
Тепловой эффект реакции. По следствию из закона Гесса |
|
|
|||||||||||||||||||||||
|
|
|
|
0 |
|
|
|
|
|
|
0 |
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
r H298 |
H f прод. H f исх. |
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
H |
0 |
|
H |
0 |
|
|
( H |
0 |
|
|
2 H |
0 |
|
) (132) (46.2 2 811.3) = 771.700 кДж / моль 771700 Дж / мол |
||||||||||
298 |
f ,(NH |
) |
SO |
f ,NH |
|
f ,H SO |
|||||||||||||||||||
r |
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
4 |
2 |
4 |
|
|
|
|
2 |
4 |
|
|
|
|
|
|
|
|
|
Количество выделяющейся теплоты на 1 т целевого продукта составляет
771,7×7575,7576=5846212,1400 кДж≈5846,2121 МДж
Задача 3. Определить константу скорости реакции в случае 0, 1, 2-го порядков, если через время после начала реакции достигнута степень
превращения исходного веществавещества СА0 . ХА , а начальная концентрация исходного
Вариант |
Х |
А |
СА0, кмоль/м3 |
, мин |
|
|
|
||
10 |
0,70 |
0,30 |
20 |
|
Решение Воспользуемся известными соотношениями
Для n=0 (нулевой порядок)
k |
C |
A0 |
X |
A |
|
|
|||
|
|
|
||
|
|
|
|
|
Подставим значения в формулу
k |
0.3 0.7 |
0.0105 кмоль / (м |
3 |
мин) 0.0105 моль / ( л мин) |
|
||||
20 |
|
|||
|
|
|
|
|
0.000175 моль / (л с) 0.6300 моль / (л ч) 15,12 моль / (л сут) |
||||
Для n=1 (первый порядок)
k |
|
1 |
ln |
1 |
|
|
|
1 X |
A |
||||
|
|
|||||
|
|
|
|
|
||
Подставим значения в формулу
k |
1 |
ln |
1 |
0.0602 мин |
1 |
0.0001003 с |
1 |
3, |
612 ч |
1 |
86, 688 сут |
1 |
|
|
|||||||||||
20 |
1 0.7 |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
Для n=2 (второй порядок)
k |
1 |
|
|
X |
A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
A0 |
(1 X |
A |
) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Подставим значения в формулу |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
k |
1 |
|
|
0.7 |
|
|
|
|
|
3 |
) |
1 |
мин |
1 |
0.3889 |
(моль / л) |
1 |
мин |
1 |
|
||||||||
|
|
|
|
|
|
|
|
0.3889 (кмоль / м |
|
|
|
|
|
|
||||||||||||||
|
20 |
0.3 (1 0.7) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
0.00648 (моль / л) |
1 |
с |
1 |
23,334 (моль / |
л) |
1 |
ч |
1 |
560,016 (моль / л) |
1 |
сут |
1 |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
(1 мин=60 с, 1 ч=60 мин, 1 сут=24 ч)
Задача 4. Определить константу скорости реакции первого порядка при температуре t3, если при температуре t1 за время 1 достигнута степень превращения XA1 , а при температуре t2 за время 2 достигнута
степень превращения XA2 .
Вариант |
XA1 |
XA2 |
t1 , С |
t2 , С |
t3 , С |
1, |
2 , |
|
|
|
|
|
|
мин |
мин |
10 |
0,70 |
0,80 |
38 |
58 |
98 |
24 |
12 |
Решение Реакция первого порядка, константа скорости для первого порядка
k |
1 |
ln |
1 |
|
|
X |
|
||
|
1 |
A |
||
|
|
|
|
Найдем значения констант при двух температурах
k |
|
|
1 |
ln |
1 |
0.0502 |
мин |
1 |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|||||||
1 |
|
24 |
|
1 0.7 |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
k |
|
|
1 |
ln |
1 |
0.1341 мин |
1 |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
||||||||
2 |
12 |
1 0.8 |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Уравнение Аррениуса: |
|
|
|
|
|
|
|
|
|||||||
В интегральной форме уравнение |
k Aexp( |
E |
) |
||||||||||||
a |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
RT |
|
|
В логарифмической форме |
ln k ln A |
E |
|
|
|||||||||||
a |
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
RT |
|
|
|
Аналитический расчет энергии активации

|
R ln |
k |
( |
T T |
|
|
|
|||
E |
|
1 |
1 |
2 |
) |
|
|
|||
a |
|
k |
|
|
|
T T |
|
|
|
|
|
|
2 |
|
|
|
|
|
|||
|
|
|
|
|
1 |
2 |
|
|
||
T 38 273 311 K |
|
|
|
|
||||||
1 |
|
|
|
|
|
|
|
|
|
|
T |
58 273 331 K |
|
|
|
|
|||||
2 |
|
|
|
|
|
|
|
|
|
|
T 98 273 371 K |
|
|
|
|
||||||
3 |
|
|
|
|
|
|
|
|
|
|
E |
8.314 ln |
0.0502 |
( |
311 331 |
) 42046.732 Дж / моль 42.0467 кДж / моль |
|||||
|
|
|
|
|||||||
a |
|
|
|
|
0.1341 |
|
311 331 |
|||
|
|
|
|
|
|
|||||
Затем рассчитываем значение константы при температуре t3
ln |
0.0502 |
2.6299 |
|
|
||||||
|
|
k |
|
|
|
|
||||
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0.0502 |
exp( 2.6299) |
0.0721 |
||||||||
|
|
k |
|
|
|
|||||
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k |
|
|
0.0502 |
0.6963 мин |
1 |
|||||
|
|
|
|
|
||||||
3 |
0.0721 |
|
||||||||
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
||||
Исходное значение константы скорости при температуре t3 равно
0,6963 мин-1.
Задача 5. Сравнить объемы Рив и Рис Н для достижения одной и той же степени превращения X’A, равной 0,1; 0,5; 0,9 при проведении реакции A P , если за время в Рис П была достигнута степень превращения XA .
Вариант |
, с |
XA |
10 |
140 |
0,60 |
Решение По результатам проведения реакции в реакторе периодического действия
определим константу скорости реакции. Реакция первого порядка
|
1 |
|
1 |
|
|
|
||
k |
|
ln |
X |
|
|
|
||
|
|
1 |
A |
|
|
|||
|
|
|
|
|
|
|
|
|
k |
|
1 |
ln |
1 |
0.006545 с |
1 |
||
|
|
|
|
|||||
140 |
0.6 |
|
||||||
|
|
1 |
|
|
||||
Используя полученное значение константы, рассчитаем время пребывания реагентов в Рис Н и Рив для каждой заданной степени
превращения |
X’A (0,1; 0,5 и 0,9). |
|||||||||
Рис |
|
|
|
X A |
|
|||||
|
k |
(1 X A ) |
||||||||
|
|
|
|
|||||||
|
|
|
1 |
ln |
|
1 |
|
|
||
Рив |
k |
1 X A |
||||||||
|
|
|
|
|||||||
|
|
|
|
|
||||||
