ОХТ (1)
.pdf
Для Рис Н:
Рис1
Рис 2
Рис3
|
0.1 |
16.9765 с |
|
0.006545 (1 |
|||
|
0.1) |
||
|
0.1 |
152.7884 с |
|
0.006545 (1 |
|||
|
0.5) |
||
|
0.9 |
1375.09549 с |
|
0.006545 (1 |
|||
|
0.9) |
Для Рив:
Рив1 |
|
1 |
ln |
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
0.006545 |
1 |
0.1 |
||||||||||
|
|
|
||||||||||
Рив1 |
|
1 |
ln |
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
0.006545 |
1 |
0.5 |
||||||||||
|
|
|
||||||||||
Рив3 |
|
1 |
ln |
|
|
1 |
|
|
|
|||
|
|
|
|
|
|
|
||||||
0.006545 |
|
0.9 |
||||||||||
|
|
|
1 |
|||||||||
Объем реактора |
V |
p |
|
0 |
||||||||
|
|
|
|
|||||||||
16.09786 с
105.9048 с
351.8083 с
Пусть 0 1 м |
/с , тогда |
|
|
|
|
||
|
|
3 |
|
|
|
|
|
Объем реактора Рис Н: |
|
|
|
|
|||
V |
|
16.9765 1 16.9765 м |
3 |
|
|
|
|
p Рис1 |
|
|
|
|
|||
|
|
|
|
|
|
|
|
V |
|
152.7884 1 152.7884 м |
3 |
|
|||
p Рис 2 |
|
|
|
||||
|
|
|
|
|
|
|
|
V |
|
1375.09549 1 1375.09549 м |
3 |
||||
p Рис3 |
|
||||||
|
|
|
|
|
|
|
|
Объем реактора Рив: |
|
|
|
|
|||
V |
|
16.09786 1 16.09786 м |
3 |
|
|||
p Рив1 |
|
|
|
||||
|
|
|
|
|
|
|
|
V |
|
105.9048 1 105.9048 м |
3 |
|
|||
p Рив 2 |
|
|
|
||||
|
|
|
|
|
|
|
|
V |
|
351.8083 1 351.8083 м |
3 |
|
|||
p Рив3 |
|
|
|||||
|
|
|
|
|
|
|
|
Объем реактора Рис Н больше, чем объем реактора Рив:
V |
|
16.9765 16.09786 0,87864 м |
3 |
0,8786 м |
3 |
|
|||
p1 |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
V |
|
152.7884 105.9048 46,8836 м |
3 |
|
|
|
|
||
p 2 |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
V |
|
1375.09549 351.8083 1023, 28719 м |
3 |
1023, 2872 м |
3 |
||||
p3 |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
Задача 6. В какой последовательности установить реакторы Рив и Рис Н для проведения реакции второго порядка, если известны значения
k и CA . |
|
|
0 |
|
|
Выбор последовательности установки реакторов необходимо |
||
обосновать (т. е. задача требует развернутого ответа). |
|
|
Вариант |
k |
СА0, кмоль/м3 |
10 |
6,0 |
2,0 |
Решение Для определения последовательности комбинированной модели, состоящей
из Рив и Рис, необходимо определить величину концентрации САк на выходе из системы реакторов. Для этого рассчитывают комбинацию Рив+Рис и Рис+Рив. Предпочтение отдается той системе, где концентрация САк меньше. Для реакции второго порядка:
С |
|
|
1 |
1 4 k C |
A0 |
|||
|
|
|
|
|
|
|||
|
А |
|
|
|
|
2 k |
|
|
|
Рис |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
С |
|
|
|
|
C |
A0 |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
А |
|
1 |
k |
C |
|
|
|
|
Рив |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A0 |
|
Подставляем значения
Комбинация Рив+Рис:
С |
|
|
|
2 |
0.1538 кмоль / м |
3 |
|
|
|
|
|
|
|
|
|||||
А |
|
|
|
|
|
||||
|
1 6 2 |
|
|
|
|
||||
|
Рив |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
С |
|
С |
|
|
1 |
1 4 6 0.1538 |
0.09716 кмоль / м |
3 |
|
|
|
|
|
|
|||||
А |
А |
|
2 6 |
|
|
||||
|
K |
|
Рис |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Комбинация Рис+Рив
СА |
1 |
1 4 6 2 |
0.5000 кмоль / м3 |
||
Рис |
|
|
2 6 |
|
|
|
|
|
|
|
|
СА |
СА |
|
2 |
|
0.500 кмоль / м3 |
|
|
||||
|
|
||||
K |
Рив |
|
1 6 0.5000 |
||
|
|
|
|
||
САк меньше для комбинации Рив+Рис
Комбинация Рив+Рис наиболее выгодна.
Задача 6. Построить графическую зависимость XA = f (T) в Рис Н и Рив для необратимой реакции первого порядка за время τ, если в Рис П за время τ’= 600 с при температуре t1, равной 25 °С, достигнута степень превращения XA1 , а при температуре t2, равной 35 °С, достигнута степень превращения XA2 . Для построения зависимости XA=f (T) необходимо задаваться температурой в диапазоне от 5 до 85 °С с интервалом в 10 °С
Вариант |
, с |
X |
A1 |
X |
A2 |
|
|
|
|||
10 |
680 |
0,60 |
0,80 |
||
|
|
|
|
|
|
Решение
Сначала рассчитаем значения константы скорости реакции при 25 и 35°С и определим энергию активации реакции.

Реакция первого порядка (Рис П)
|
k |
|
1 |
|
ln |
|
|
|
1 |
|
|
|
0.001347 c 1 |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
1 |
|
680 |
|
|
|
|
1 0.6 |
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
k2 |
|
|
1 |
|
|
ln |
|
1 |
|
|
|
0.002367 c 1 |
|
|
|
|
||||||||
|
|
|
|
|
|
|
0.8 |
|
|
|
|
||||||||||||||
|
|
|
680 |
|
|
|
1 |
|
|
|
|
|
|
|
|
||||||||||
Уравнение Аррениуса: |
|
|
|
|
|
||||||||||||||||||||
В интегральной форме уравнение |
k Aexp( |
E |
) |
||||||||||||||||||||||
a |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
RT |
|
|
В логарифмической форме ln k ln A |
E |
|
|
||||||||||||||||||||||
a |
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
RT |
|
|
|
Аналитический расчет энергии активации |
|
|
|||||||||||||||||||||||
|
R ln |
k |
( |
T T |
|
|
|
|
|
|
|
|
|
|
|
||||||||||
E |
|
1 |
1 |
2 |
) |
|
|
|
|
|
|
|
|
||||||||||||
a |
|
|
|
|
k |
|
|
|
T T |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
1 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|||||
T 25 273 298 K |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T 35 273 308 K |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E |
8.314 ln |
0.001347 |
( |
298 308 |
) 43018,8203 Дж / моль |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
a |
|
|
|
|
|
|
|
|
0.002367 |
|
298 308 |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
Определим предэкспоненциальный множитель.
Аналитический способ
A k exp( |
E |
a |
) |
|
|
||||
RT |
||||
|
|
|||
A 0.001347 exp( |
43018,8203 |
) 46789,886 c |
1 |
|||||
|
|
|||||||
|
|
|
|
|||||
1 |
|
|
8.314 |
298 |
|
|
|
|
|
|
|
|
|
|
|
||
A 0.002367 exp( |
43018,8203 |
) 46789,886 c |
1 |
|||||
|
|
|
||||||
|
|
|
|
|||||
2 |
|
|
8.314 308 |
|
|
|
|
|
|
|
|
|
|
|
|
||
A |
46789,886 c |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
cp |
|
|
|
|
|
|
|
|
Затем по уравнению k Aexp( RTEa ) рассчитываем значение константы при температурах от 5 до 85°С с интервалом в 10°С
k 46789,886 exp( |
43018,8203 |
) |
||||
8.314 T |
||||||
|
|
|
|
|||
|
|
|
|
|
|
|
t, °C |
T,K |
|
k,c |
|
|
|
5 |
278 |
0.0003862 |
|
|
||
|
|
|
|
|||
|
|
|
|
|
||
15 |
288 |
0.0007371 |
|
|
||
|
|
|
|
|||
|
|
|
|
|
|
|

25 |
298 |
0.0013470 |
|
||
|
|
|
35 |
308 |
0.0023670 |
|
||
|
|
|
45 |
318 |
0.0040145 |
|
||
|
|
|
55 |
328 |
0.0065929 |
|
||
|
|
|
65 |
338 |
0.0105140 |
|
||
|
|
|
75 |
348 |
0.0163235 |
|
||
|
|
|
85 |
358 |
0.0247278 |
|
||
|
|
|
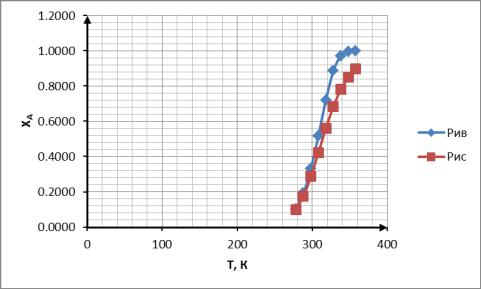
Далее, используя значения константы скорости реакции, рассчитываем соответствующее каждой температуре значение степени превращения ХА в Рив и Рис
X X
AРив
AРис
1 exp( k ) |
||
|
k |
|
k |
||
1 |
||
t, °C |
T,K |
k,c |
XAРив |
XAРис |
5 |
278 |
0.0003862 |
0.1018 |
0.0970 |
|
|
|
||
|
|
|
|
|
15 |
288 |
0.0007371 |
0.191269 |
0.1751 |
|
|
|
||
|
|
|
|
|
25 |
298 |
0.0013470 |
0.3306 |
0.2864 |
|
|
|
||
|
|
|
|
|
35 |
308 |
0.0023670 |
0.5176 |
0.4216 |
|
|
|
||
|
|
|
|
|
45 |
318 |
0.0040145 |
0.7210 |
0.5608 |
|
|
|
||
|
|
|
|
|
55 |
328 |
0.0065929 |
0.8850 |
0.6838 |
|
|
|
||
|
|
|
|
|
65 |
338 |
0.0105140 |
0.9714 |
0.7804 |
|
|
|
||
|
|
|
|
|
75 |
348 |
0.0163235 |
0.9966 |
0.8503 |
|
|
|
||
|
|
|
|
|
85 |
358 |
0.0247278 |
0.99986 |
0.8985 |
|
|
|
||
|
|
|
|
|
Построим график XA=f (T)