
- •Порядок проведения экзамена
- •Можно (и нужно) на экзамене пользоваться:
- •Строение атома
- •Химическая термодинамика, равновесие.
- •Определим энтальпию и энтропию реакции по следствию из 2-го закона Гесса
- •Рассчитать энергию Гиббса реакции двумя способами, считая, что Н0
- •Возможно ли при стандартных состояниях всех веществ и температуре Т самопроизвольное протекание процесса
- •Оцените возможность протекания процесса
- •Значение парциального давления Вг, ниже которого
- •Температура, выше которой процесс при стандартных состояниях компонентов невозможен.
- •Химическое равновесие
- •Химическое равновесие Напишите выражение для констант равновесия КР и КС заданной
- •Химическая кинетика.
- •Химическая кинетика.
- •Растворы электролитов
- •Растворы электролитов, гидролиз
- •Электрохимические процессы, ГЭ
- •Предполагаемый ход поляризационных кривых для электродов заданного ГЭ.
- •Пример 41.
- •Электрохимические процессы, электролиз.
- •Потенциалы предполагаемых процессов с учетом значения рН электролита, при расчете соответствующих равновесных потенциалов
- •Уравнения реакций, протекающих на никелевых электродах при электролизе с учетом определенных потенциалов
- •Приблизительный ход поляризационных кривых при электролизе.
- •Рассчитайте массу или объем веществ, которые выделятся на катоде и аноде, если электролиз
- •Энергия

Электрохимические процессы, ГЭ
Повторить разбор задачи 1 расчетного задания №4
Напишите уравнения катодного и анодного процессов и токообразующей реакции гальванического элемента, у которого один из электродов – стандартный водородный (может быть задан рН), а другой – стандартный металлический (может быть задана активность потенциалопределяющих ионов). Рассчитайте стандартную ЭДС элемента при 25 °С двумя способами. Рассчитайте величину максимальной электрической работы, которая может быть выработана при увеличении (уменьшении) массы катода (анода) на заданное число граммов.
А: отдача электронов
K: присоединение электронов
ТОР:
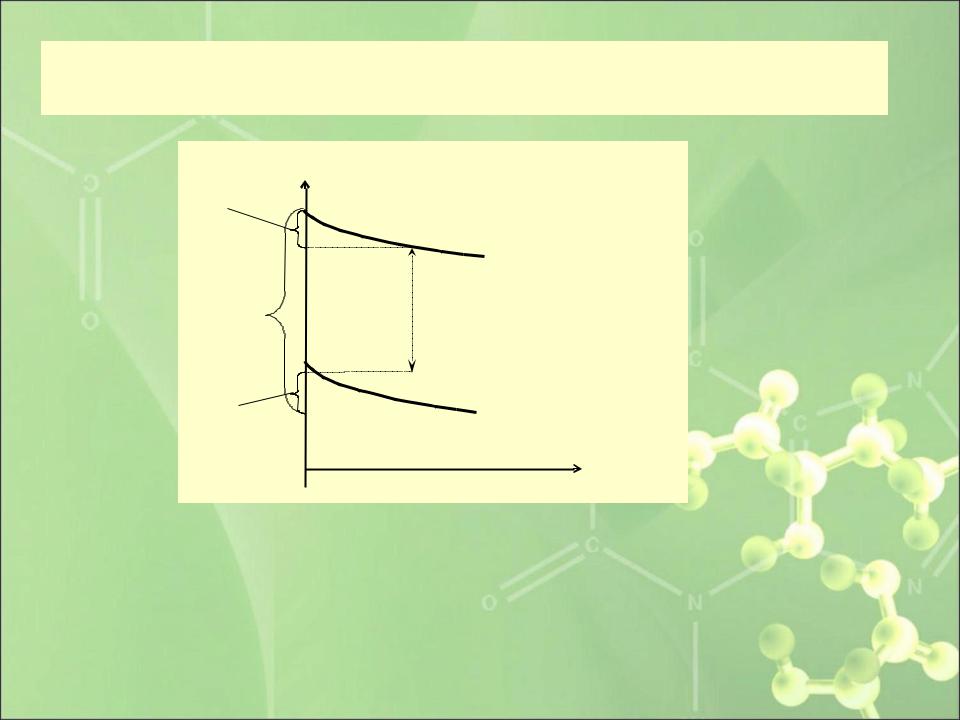
Предполагаемый ход поляризационных кривых для электродов заданного ГЭ.
EК EрК |
E, B |
EiК |
|
EрЭ |
U+IR |
|
EiА
EА EpА
i, мА/см2

Пример 41. |
Рассчитать ЭДС гальванического элемента: |
|||
H |
,Pt HNO |
HCOOH H ,Pt, если p |
= 1 и |
|
|
2 |
3 |
2 |
H2− |
концентрация каждого электролита с0= 0,1 моль/л.
Уравнения электродных реакций: Решение К : 2Н+ (р) + 2е Н2
А : Н2 2Н+ (р) + 2е
EHp /H2 0,0295 lg pH2 0,059 pH
определим pH электролитов и рассчитаем равновесные потенциалы
а) HCOOH H++COOH-
KД(НСООН) / c0 |
|
1,8 10 4 / 0,1 0,0424 |
сН+ = ·с0 = 0,0424·0,1= 4,24·10-3
EHp /H2 -0,059 pH = 0,059 lgcH = 0,059 lg(4,24 10 3 ) = -0,14 В
23

б) HNO3 → H+ + NO3- |
|
Iр-ра = 0,5 (сi z2i ) = 0,5(0,1 + 0,1) = 0,1 |
H+ = 0,84 |
a = H+ с H+ = 0,84 0,1 = 0,084
EHp /H2 -0,059 pH = 0,059 lgaH = 0,059 lg0,084 = -0,0635 В
Катод –электрод, погруженный в раствор HNO3, (-0,0635 B) Анод – электрод, погруженный в раствор HCOOH (-0,14 B)
EЭ = EК – EА = -0,0653 + 0,14 = 0,0747 B
24

Электрохимические процессы, электролиз.
Повторить разбор задачи 2 расчетного задания №4
Напишите уравнения реакций, идущих на Ni (могут быть инертные электроды) при электролизе раствора NiCl2 (любого сильного
электролита). Покажите графически предполагаемый ход поляризационных кривых в процессе электролиза.
Ионный состав и значение водородного показателя (рН) для водного раствора электролита NiCl2.
|
Ионный состав раствора электролита: |
NiCl2 → Ni2+ + 2Cl- |
||||
|
|
|
|
|
H2O H+ |
+ OH- |
|
NiCl2 – соль, образованная |
сильной кислотой (HCl) и слабым основанием. |
||||
|
Гидролиз протекает по катиону. |
Среда кислотная |
рН 5 |
|||
− К |
Ni2+ , H+ |
|
|
|
|
|
+ A |
- |
- |
Т.к. Ni не относится к инертным материалам, необходимо учитывать |
|||
Cl |
, OH |
материал электрода в анодном процессе, |
|
|||
|
|
|
|
|||

Потенциалы предполагаемых процессов с учетом значения рН электролита, при расчете соответствующих равновесных потенциалов
Потенциалы предполагаемых процессов с учетом значения рН электролита. На катоде:
E0Ni2+/Ni = - 0,25 B |
Потенциалы предполагаемых |
|
|
|
процессов близки. Сначала будет |
EP + |
= – 0,059· pH = – 0,295 B |
осаждаться никель, затем |
H /H2 |
выделяться водород. |
|
На аноде: |
|
E0Ni2+/Ni = - 0,25 B |
Потенциал окисления никеля |
EPO /OH- = +1,23 – 0,059· pH = +0,935 B |
будет наименьший, потенциалы |
остальных предполагаемых |
|
2 |
процессов отличаются больше |
|
|
E0Cl2/Cl- = +1,36 B |
чем на 1 В. Следовательно на |
аноде будет протекать один |
|
|
процесс растворения никеля |

Уравнения реакций, протекающих на никелевых электродах при электролизе с учетом определенных потенциалов
Вероятные процессы на электродах:
– Катод H+, Ni2+
Ni2+ + 2e → Ni
2Н+(р) + 2е Н2
+Анод Ni
Ni → Ni2+ + 2e

Приблизительный ход поляризационных кривых при электролизе.
|
|
Е, В |
|
|
|
Анодный процесс |
|
|
|
Ni → Ni2+ + 2e |
|
Е0Ni2+/ Ni = -0,25 В |
Вi Ni = 100% |
i, мА/см2 |
|
|
|||
Ер + |
= -0,295 В |
|
|
Н /Н2 |
|
|
|


























 2Н+ + 2е → Н2↑
2Н+ + 2е → Н2↑
Вi Ni< Вi Н2 |
|
Ni2++ 2е → Ni |
|
Вi Ni >Вi Н |
|
||
|
2 |
|
|
Катодные процессы |
Вi Н = Вi Ni= 50% |
||
2 |
|||
|
|
||

Рассчитайте массу или объем веществ, которые выделятся на катоде и аноде, если электролиз вести при силе тока I = 15 А, в течение времени τ = 0,5 час c катодным выходом металла по току 15%.
На аноде один процесс, все количество электричества тратится на растворение Ni. По закону Фарадея масса растворившегося Ni на аноде:
m |
M Ni I |
m |
59 15 0,5 |
8,26 г |
n F |
2 26,8 |
Масса выделившегося Ni на катоде, с учетом значения катодного выхода металла по току ВМ = 0,15 (15%):
m |
M Ni I |
ВNi |
m |
59 15 0,5 |
0,15 1,24 г |
||
n F |
2 |
26,8 |
|||||
|
|
|
|
||||
Объем Н2, выделившегося на катоде с учетом выхода водорода по току 0,85 (85%):
V VМ I |
B |
V 22,4 15 0,5 0,85 2,66 л |
|
Н2 |
n F |
H2 |
2 26,8 |
|
|
||

Энергия
ABDC
Ea, экз. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
AB+DC |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ea, энд. |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Ннач |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
rН |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
AD+BC |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Нкон |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ход реакции
Энергетический профиль химической реакции
