
МИНОБРНАУКИ РОССИИ
Федеральное государственное образовательное учреждение высшего профессионального образования
«НОВОСИБИРСКИЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
Институт медицины и психологии В. Зельмана
Реферат по курсу «Препаративная органическая химия» на тему:
ЭЛЕКТРОФИЛЬНОЕ ГАЛОГЕНИРОВАНИЕ АРОМАТИЧЕСКИХ СУБСТРАТОВ
Выполнил:
Бочаров Алексей Антонович
Преподаватель:
Финке Анастасия Олеговна
Новосибирск
2022
ОГЛАВЛЕНИЕ
ВВЕДЕНИЕ……………………………………………………………………………………...3
ОПИСАНИЕ ЭЛЕКТРОФИЛЬНОГО ГАЛОГЕНИРОВАНИЯ………………………….4
Бромирование и хлорирование………………………………………………………………4
Иодирование……………………………………………………………………………………6
Фторирование…………………………………………………………………………………..7
ПРИМЕНЕНИЕ…………………………………………………………………………………9
СПИСОК ЛИТЕРАТУРЫ……………………………………………………………………10
2
Введение
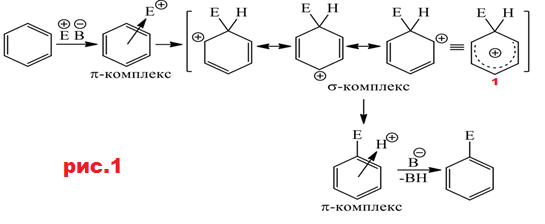
Электрофильное ароматическое галогенирование является видом электрофильного ароматического замещения (ЭАЗ). Этот механизм обозначается как SEAr, по ИЮПАК – AE+DE[1]. В электрофильном замещении субстрат атакуется электрофилом – частицей, имеющей положительный заряд или дефицит электронов. Все электрофилы являются кислотами Льюиса по определению. Уходящая частица называется электрофугом. В общих чертах механизм ЭАЗ (рис.1) описывается так: 1. Стадия образования электрофила (будет рассмотрена ниже для каждого типа реакций). 2. Стадия образования π-комплекса с электрофилом. 3. Стадия превращения π-комплекса в аренониевый ион (σ-комплекс,) сопровождающаяся разрушением ароматической π-системы. 4. Стадия образования π-комплекса с протоном. 5. Стадия отщепления протона под действием основания с образованием продукта.
В большинстве случаев лимитирующей является стадия 3, поскольку на разрыв сопряжения в ароматической π-системе необходимо затратить значительную энергию. В механизме с участием аренониевого иона электрофильные частицы можно получить различными способами, но когда Н замещает Х, превращение ароматического кольца в аренониевый ион во всех случаях одно и то же[2]. Электрофил может быть положительно заряженным ионом (Х+) или положительным диполем. Если это положительно заряженный ион, он атакует кольцо (отнимая от секстета пару электронов), что приводит к карбокатиону. Этот интермедиат представляет собой резонансный гибрид, изображенный ниже в виде структуры 1 на рис.1. Карбокатионы могут взаимодействовать по-разному, наиболее вероятным путем взаимодействия для этого типа ионов является потеря Х+ или Н+. На второй стадии реакция протекает с потерей протона и ароматический секстет восстанавливается в конечном продукте. Вторая стадия почти всегда идет быстрее, чем первая, поэтому скоростьопределяющей является первая стадия, и реакция имеет второй порядок (кроме тех случаев, когда образование атакующих частиц происходит еще медленнее и концентрация ароматического соединения вообще не входит в выражение для скорости) [3]. В случае, когда атакующая частица представляет собой диполь (рис.2), а не ион, продукт должен быть нейтральным, если только в ходе процесса часть диполя не отщепилась со своей парой электронов, как в превращении 1-2. Заметим, что, когда ароматическое кольцо атакует Х, Z может oтрываться напрямую с образованием 2, после чего Z, выступая в роли основания, присоединяет к себе электрофуг H.3
3
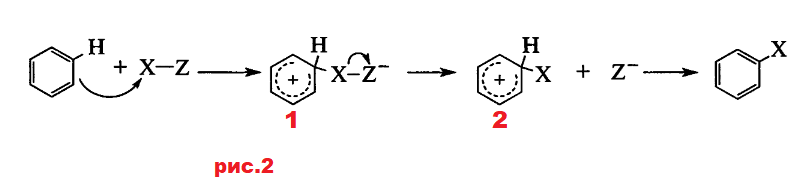
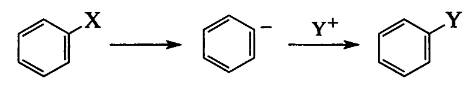
Было описано мономолекулярное электрофильное замещение: SE1, по ИЮПАК DE+AE (схема ниже).
Оно возможно в случае, если уходящий
атом – атом водорода, для проведения
реакции требуется сильное основание
по Льюису. Реакция идет в две стадии
через образование карбаниона. В такие
реакции, например, вступают галогены,
и такие реакции называются электрофильным
галогенированием[4].
Описание электрофильного галогенирования бромирование и хлорирование
Наиболее часто в литературе встречаются реакции бромирования или хлорирования и в реакциях, описанных ниже, могут использоваться оба галогена.
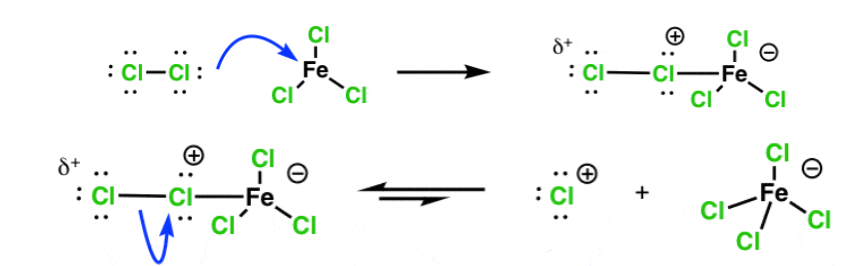
Эти реакции проводят с соответствующими галогенами и катализаторами, в роли которых выступают кислоты Льюиса (FeHal3, AlHal3), которые используются для генерации электрофильных частиц in situ, механизм образования электрофила показан ниже.
4
Ряд активности часто используемых катализаторов[5]:
![]()
Механизм электрофильного галогенирования:
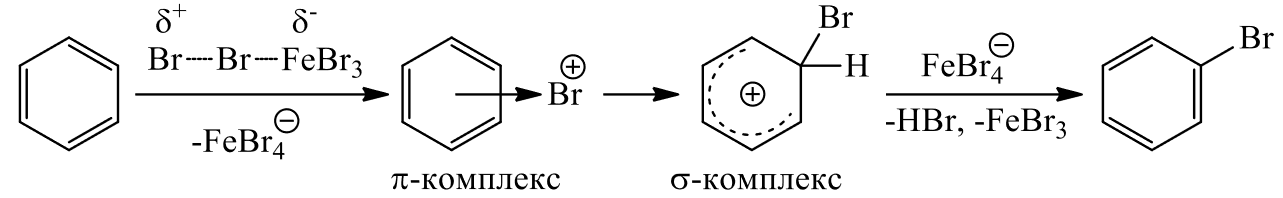
Кислоты Льюиса нужны для образования лучшей уходящей группы вида FeHal4- или то же, но с алюминием. Также использется, например, ацетат таллия(III), благодаря чему удается провести реакцию с высокой региоселективностью в орто/пара положение по отношению к активирующему заместителю[6]. Интересно, что удавалось провести бескатализное бромирование ароматики с помощью NBS при облучении ультрафиолетом при температуре 30 ± 2 °С[7] (рис.3).
Если нужно галогенировать соединения, вступающиe в катионную полимеризацию в присутствии кислот Льюиса, то в контексте ароматических субстратов это могут быть, например, гетероциклические соединения, то можно подобрать альтернативную систему. Так, в системе брома и диоксана удалось получить 2-бромфуран[8].
Помимо углеродной ароматики, существуют и гетероциклические ароматические соединения, например, пиридин и его производные. Их удается селективно бромировать, например, бром-броматной смесью с хорошими выходами (в зависимости от субстрата)[9]:
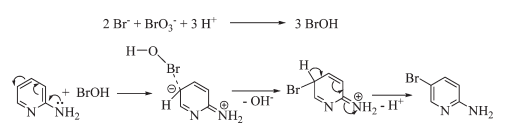
5
