
Органическая химия. Ответы к зачету
.pdf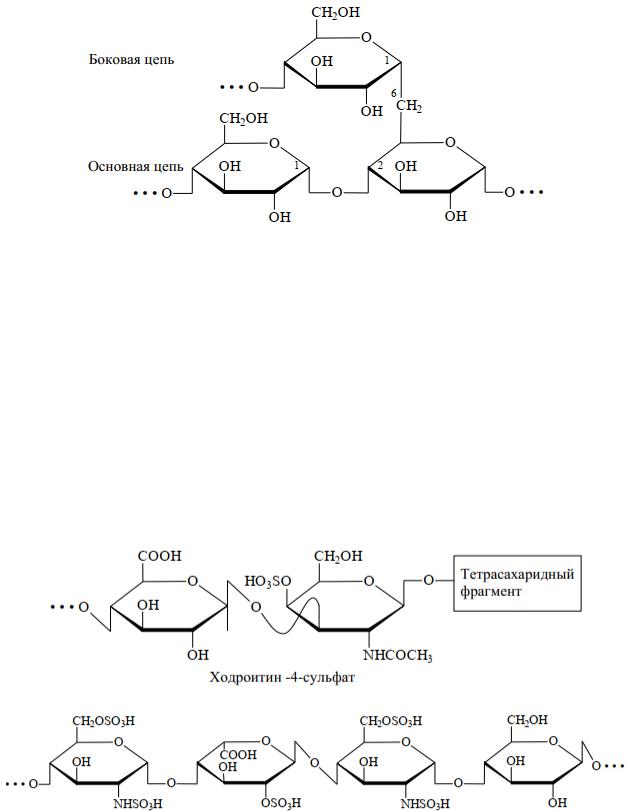
В организме крахмал подвергается гидролизу:
α-D-Глюкоза поглощается ворсинками кишечника, попадает в кровеносное русло и используется как источник энергии. Избыток глюкозы полимеризуется в гликоген и откладывается в печени про запас.
Проблема ожирения возникает потому, что количество гликогена в тканях ограничено. После синтеза 50-60г гликогена на 1кг ткани из глюкозы начинает вырабатываться жир.
Гликоген (животный крахмал) имеет сходное строение с амилопектином, однако разветвленность его больше, чем амилопектина. Разветвленность имеет значение для расщепления гликогена при помощи ферментовтаким образом увеличивается количество реакционных центров и увеличивается скорость реакции.
Гетерополисахариды.
Гетерополисахариды – это углеводы, при гидролизе которых образуются молекулы различных моносахаридов и их производных. К последним относятся гепарин, гиалуроновая кислота, хондроитинсерная кислота.
Все гетерополисахариды построены по одному принципу. Дисахаридная единица состоит из уроновой кислоты и аминосахара в сульфированной и ацилированной форме, соединенных -глико- зидной связью:
Фрагмент цепи гепарина:
Соединительная ткань распределена по всему организму (кожа, хрящи, сухожилия, суставная жидкость, роговица, стенки крупных кровеносных сосудов, кости) и обусловливает прочность и упругость органов, эластичность их соединения, стойкость к проникновению инфекции. Полисахариды соединительной ткани связаны с белками.
Полисахариды соединительной ткани иногда называют кислыми мукополисахаридами, так как они содержат уроновые кислоты, остатки серной и уксусной кислот.
Функции углеводов.
1)энергетическая;
2)строительная;
3)наследственная;
81
4)защитная;
5)поддержание постоянного осмотического давления и свертываемости крови;
6)лекарственные препараты и компоненты к ним.
Энергетическая функция.
Потребность человеческого организма удовлетворяется за счет углеводов.
При нормальной трудовой деятельности энергетические затраты человека покрываются за счет углеводов на 55-60%, жиров на 20-25%, белков на 15-20%.
Калорийность углеводов, то есть энергия, выделяемая в процессе их диссимиляции с образованием СО2 и Н2О, составляет 16-17 кДж/г. Источником глюкозы является гликоген и крахмал, поступающий с пищей. Глюкоза – обязательный компонент крови (3,3 –3,5 ммоль/л цельной крови).
Особенно чувствительны к снабжению глюкозой нервные клетки. При недостатке глюкозы возникают судороги, потеря сознания. Постоянная концентрация глюкозы зависит от двух гормонов адреналина (гормон надпочечников), регулирующего расщепление глюкозы, и инсулина (гормон поджелудочной железы), регулирующего синтез гликогена из глюкозы.
26. Пятичленные гетероциклы с одним гетероатомом: пиррол. Его электронное строение и ароматичность. Химические свойства: кислотно-основные (солеобразование), реакции электрофильного замещения (нитрование, сульфирование и бромирование), реакции восстановления и окисления. Биологически важные производные пиррола.
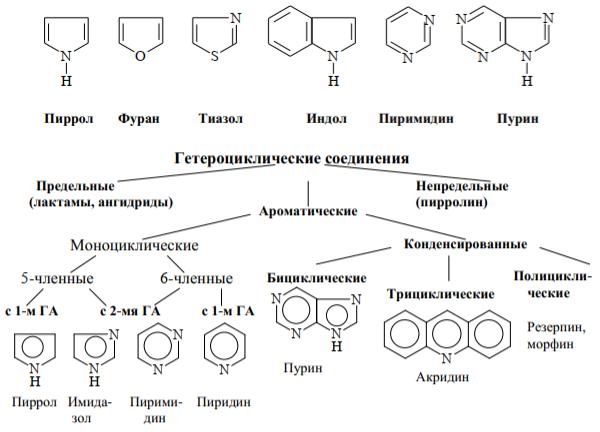
Гетероциклическими соединениями называются молекулы, в цикл которых, кроме атомов углерода, входит один или несколько гетероатомов, чаще всего это N, О, S.
Гетероциклические соединения классифицируются следующим образом:
Химия гетероциклических соединений является одним из важных разделов органической химии. Многие жизненно важные соединения содержат гетероциклы. Например, ферменты (дегидрогеназа, декарбоксилаза и др.), витамины (В1, В6, В12 и др.), гормоны, алкалоиды, антибиотики (пенициллин). Гетероциклические соединения входят в состав нуклеиновых кислот (НК): аденин, гуанин, тимин, цитозин, урацил – азотистые основания – материальные носители наследственности. Четыре пиррольных кольца, соединенные метиленовыми мостиками (-СН=) образуют порфириновую
82
структуру, которая в сочетании с Fe+2 образует основу гемоглобина, с Мg+2 – хлорофилла, с Со+2 – витамина В12.
Гетероциклы составляют основу многих химиотерапевтических препаратов: фурацилин, фурагин – содержат ядро фурана; 5-НОК, энтеросептол – ядро хинолина; антипирин, амидопирин – ядро пиразола, оратат калия – ядро пиримидина; рибоксин – ядро пурина.
Номенклатура гетероциклических соединений сложна. Поэтому широко используются тривиальные и полутривиальные названия. Некоторые закономерности можно отметить лишь для N-со- держащих гетероциклов.
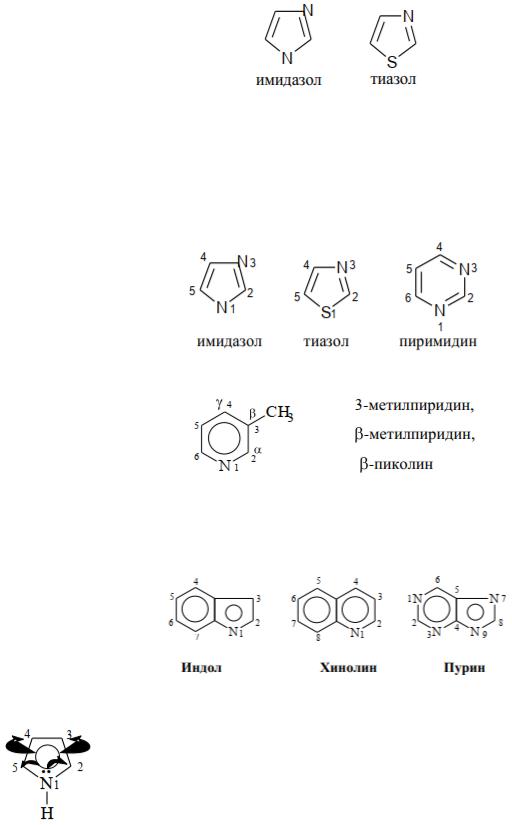
5-членные гетероциклы с двумя гетероатомами, содержащие атом N, называются азолами. Вид второго гетероатома обозначается приставкой. Например,
Шестичленные гетероциклы с атомом N имеют окончание -ИН. Например, пиридИН, пирими-
дИН.
Производные гетероциклов называются и по международной, и по рациональной номенклату-
рам.
Нумерацию кольца (для указания положения заместителя и т.д.) начинают с гетероатома и ведут таким образом, чтобы заместитель получил наименьший номер. Если в цикле несколько гетероатомов, то начинают нумерацию с наиболее электроотрицательного и ведут так, чтобы гетероатомы получили наименьшие номера.
По рациональной номенклатуре атомы, стоящие рядом с гетероатомом, обозначаются буквами греческого алфавита (α, β, γ, δ, и т.д.) и строится название
При нумерации конденсированных гетероциклов важно определить главный цикл и атомы, участвующие в конденсации, т.к. они, как правило, не нумеруются. В конденсированных циклах с бензолом главным является гетероцикл (индол, хинолин). В других конденсированных гетероциклах главным является гетероцикл с большим числом гетероатомов, либо больший гетероцикл, если они одинаковы, то главным будет цикл, содержащий азот:
1. Пятичленные гетероциклы с одним гетероатомом Пиррол
Все атомы в пирроле находятся в sp2 – гибридном состоянии, негибридизованные р –орбитали этих атомов образуют единое облако, делокализованное по всей молекуле. Причем атомы углерода поставляют для образования этого облака по одному электрону, а атом азота свою электронную пару. Образуется ароматический секстет (на пять атомов цикла в сопряжении участвует шесть
83
электронов). Таким образом, пиррол – электронноизбыточная ароматическая система (выполняетяся правило Хюккеля: 4n + 2 = 6, n = 1).
Пиррол является ацидофобным соединением, легко вступает в реакции электрофильного замещения с мягкими электрофильными агентами.
Химические свойства:
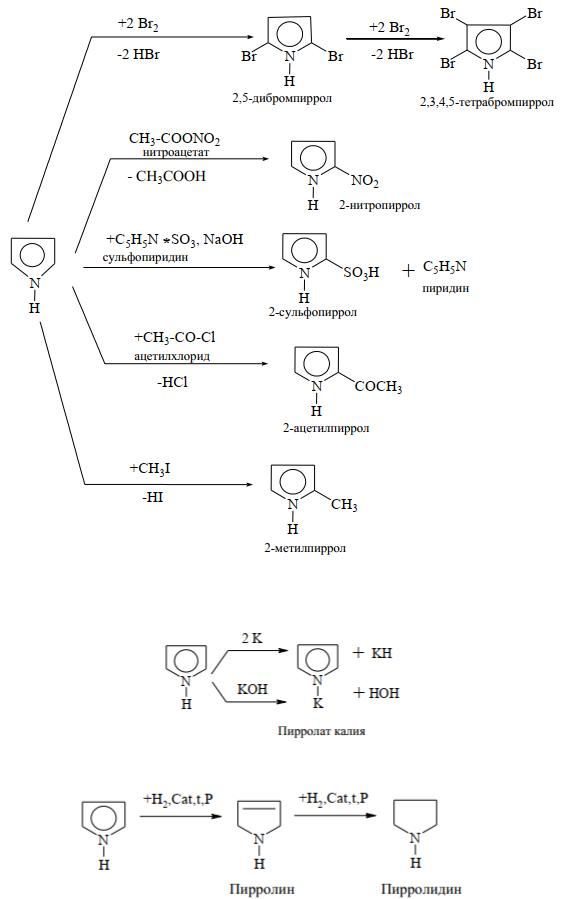
1) Реакции SE идут, в первую очередь, в положения α (2 и 5), а затем β (3 и 4). Это реакции галоидирования, нитрования, сульфирования, ацилирования, алкилирования:
2)Реакции SN не характерны, т. к. пиррол электронноизбыточная система.
3)Кислотно - основные свойства: пиролл проявляет слабые кислотные свойства - образует соли только с сильными основаниями (с металлическим калием и 30 % р-ром КОН):
4)Окислительно - восстановительные свойства: пиррол стоек к действию окислителей. При восстановлении (гидрировании) пиррола образуются продукты частичного или полного восстановления:

Пирролидин входит в состав аминокислот (пролин, оксипролин).
Винилпирролидин полимеризуется и образует полимер перистон – заменитель плазмы крови.
27. Шестичленные гетероциклы с одним гетероатомом: пиридин. Его электронное строение и ароматичность. Химические свойства: основные (солеобразование), реакции электрофильного замещения (нитрование, сульфирование и бромирование), реакции нуклеофильного замещения (образование амино – и оксипиридинов), реакции восстановления и окисления. Биологически важные производные пиридина.
Пиридин
Атом азота в пиридине находится в sp2 – гибридном состоянии. Однако, в отличие от пиролла, атом азота в пиридине вносит в π – систему один электрон, образующий с пятью р – электронами атомов углерода ароматический секстет (π, π - сопряжение) и выступает в роли электроноакцептора. Одна из sp2–гибридных орбиталей азота занята неподеленной парой электронов и не участвует в сопряжении.
Пиридин не ацидофобен. Реакции электрофильного замещения SE протекают по - положению (электронная плотность
повышена), реакции нуклеофильного замещения SN протекают в α и γ– положения (электронная плотность понижена).
Химические свойства
1) Реакции SЕ (нитрование, сульфирование, галоидирование):
2) Реакции SN:
3) Кислотно - основные свойства: пиридин не проявляет кислотных свойств. Для него характерны основные свойства (водный раствор пиридина имеет щелочную реакцию среды). С кислотами образует соли пиридиния:
85
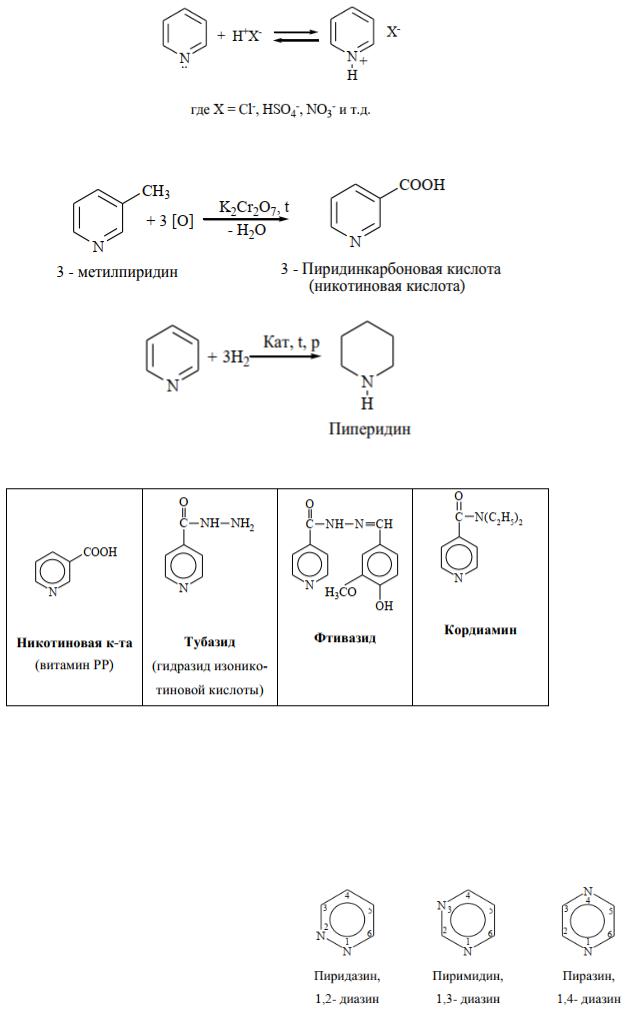
4) Окислительно-восстановительные свойства:
Наличие сопряженной системы делает пиридин стойким к действию окислителей. Однако гомологи окисляются легко, образуя кислоты:
Реакция восстановления, как и для бензола, протекает в жестких условиях:
Пиперидин входит в состав анестетика промедола. Производные пиридина: алкалоиды, витамины В1, РР, ферменты, лекарственные противотуберкулезные и др. препараты:
28. Шестичленные гетероциклы с двумя гетероатомами. пиримидин. Его электронное строение и ароматичность. Основные свойства (солеобразование). Биологически важные производные пиримидина: урацил, тимин, цитозин – компоненты нуклеозидов (их лактим-лактамная таутомерия); барбитуровая кислота (ее кислотные свойства, лактим-лактамная и кето - енольная таутомерия). Производные барбитуровой кислоты: барбитал, фенобарбитал.
Из этой группы гетероциклических соединений наиболее важными являются гетероциклы, содержащие два атома азота. Они имеют общее название диазины и различаются взаимным расположением атомов азота:
86
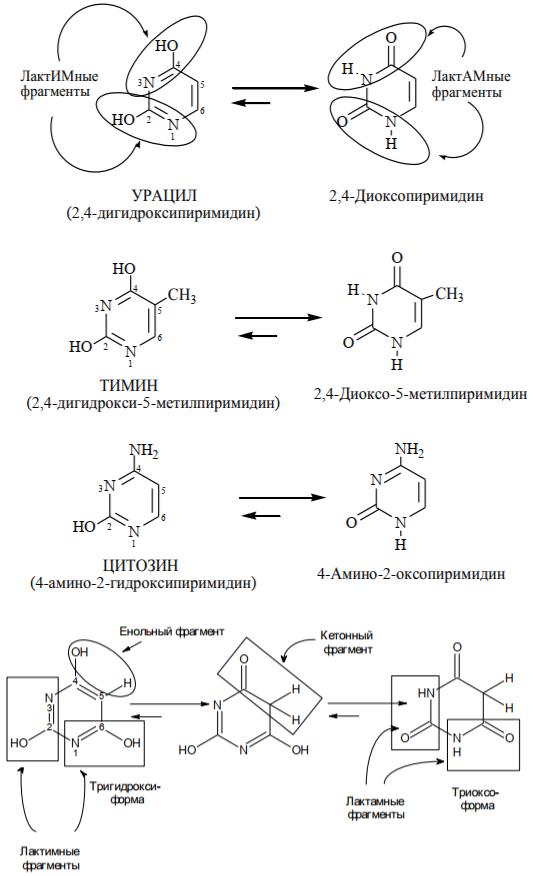
Все эти изомеры являются ароматическими соединениями, трудно вступают в реакции электрофильного замещения SE и, напротив, легко в реакции нуклеофильного замещения SN по сравнению с пиридином. Обладают очень слабыми основными свойствами. Среди производных диазинов, имеющих биологическое значение и применяемых в медицине, наиболее важными являются гидрокси- и аминопроизводные пиримидина. К ним, в первую очередь, относятся нуклеиновые основания и барбитуровая кислота.
Производные пиримидина – урацил, тимин и цитозин – называются нуклеиновыми основаниями, т.к. являются компонентами нуклеиновых кислот. Эти производные существуют в лактимной и лактамной таутомерных формах, причем в равновесной системе преобладают лактамные формы:
Для барбитуровой кислоты характерны кето – енольная и лактим – лактамная виды таутамерии:

Барбитуровая кислота по кислотным свойствам более сильная, чем уксусная. Производные барбитуровой кислоты, содержащие заместители у пятого атома углерода С–5, называются барбитуратами и применяются в качестве снотворных средств:
Для барбитуратов невозможна кето - енольная таутомерия, т.к. в молекуле отсутствуют атомы водорода при С–5. Барбитураты проявляют более слабые кислотные свойства, чем свободная барбитуровая кислота, и со щелочами образуют растворимые в воде соли.
29. Конденсированные гетероциклы: пурин его электронное строение и ароматичность. Амфотерные свойства. Биологически важные производные пурина: ксантин, мочевая кислота, аденин, гуанин (их лактим-лактамная таутомерия). Кислотные свойства мочевой кислоты, ее соли (ураты). Метилированные ксантины: кофеин, теофиллин, теобромин.
Конденсированными гетероциклами называются соединения, молекулы которых состоят из двух и более циклов, имеющих как минимум два общих атома углерода.
Важнейшая конденсированная система - пурин (состоит из сконденсированных циклов имидазола и пиримидина). Пурин является ароматическим соединением (замкнутый плоский цикл, содержит сопряженную π- электронную систему, что отвечает правилу Хюккеля (4n+2=10, n=2)).
Пурин амфотерен благодаря циклу имидазола и образует соли с сильными кислотами за счет пиридиновых атомов азота и с основаниями за счет –
NH кислотного центра имидазола. Пуриновая система входит в состав многих биологически важных соединений: HK, витаминов, алкалоидов, лекарственных средств. К наиболее значимым производным пурина относятся гидрокси- и –аминопурины.
Пуриновые нуклеиновые основания
В состав НК входят нуклеиновые основания аденин и гуанин. Из двух таутомерных форм гуанина (лактимная и лактамная) более устойчивой является лактамная, в виде которой гуанин входит в состав НК.
Следует отметить, что в отличие от самого пурина атом водорода в аденине и гуанине зафиксирован в положении 9. В такой форме эти основания связаны с остатком углевода в нуклеозидах и НК.
Гидроксипроизводные пурина
К ним относятся гипоксантин, ксантин и мочевая кислота – продукты превращения в организме
НК.
88
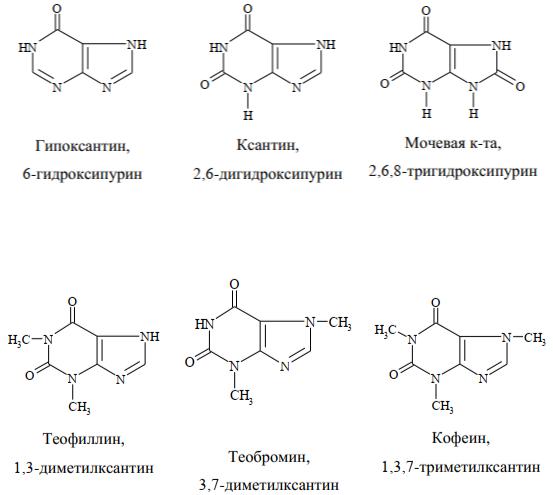
Мочевая кислота плохо растворима в воде и содержится в моче человека и млекопитающих в незначительных количествах. При некоторых нарушениях обмена веществ мочевая кислота и ее соли (ураты) откладываются в виде так называемых камней.
В медицине находят применение N – метилированные ксантины, т.е. производные, содержащие две или три метильные группы у атомов азота: теофиллин, теобромин и кофеин:
Теофиллин и теобромин обладают мочегонным действием, кофеин стимулирует центральную нервную систему.
89

Аминокислоты. Белки.
30. α-Аминокислоты. Классификация α-аминокислот, входящих в состав белков. Химические свойства как гетерофункциональных соединений ( амфотерные свойства, реакции по амино – и карбоксильной группам; специфические реакции α- аминокислот: дезаминирование, декарбоксилирование – путь к образованию биогенных аминов и биорегуляторов). Качественные реакции на α-аминокислоты, входящие в состав белков.
31. Реакции нагревания α-, β- и γ-аминокислот алифатического ряда.
Аминокислоты — это гетерофункциональные соединения, содержащие амино- и карбоксильную группы:
Номенклатура аминокислот
Биологически важные аминокислоты имеют тривиальные названия.
По рациональной номенклатуре их названия составляются путем прибавления к тривиальному названию приставки амино- и буквы греческого алфавита, указывающей положения – NH2 группы по отношению к – СООН.
Международная номенклатура в названии аминокислот используется редко.
Изомерия аминокислот
Для аминокислот характерны структурная изомерия (изомерия цепи и положения), стереоизомерия (конформационая и оптическая).
1. Изомерия цепи:
2. Изомерия положения гр. – NH2:
90
