
кислотность
.docКислотность и основность органических соединений
В настоящее время существует около десяти теорий кислот и оснований. В органической химии наиболее приемлиемой является протонная теория Бренстеда и Лоури (1923), которая рассматривает взаимодействие между кислотой и основанием как процесс передачи протона от одного вещества (кислоты) к другому (основанию).
![]()


Кислота – частица (молекула или ион), способная отдать протон, донор протона (протон Н+ - это ядро атома водорода +1Н1s1 – 1е → +1Н1s0).
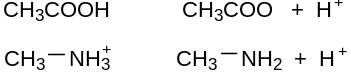

Кислоты
Сопряжённые
основания
О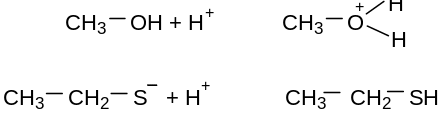 снование
– частица
(молекула или ион), способная
присоединять протон и образовывать
с ним ковалентную связь за счет своей
пары электронов, акцептор протона
снование
– частица
(молекула или ион), способная
присоединять протон и образовывать
с ним ковалентную связь за счет своей
пары электронов, акцептор протона
Сопряжённые
кислоты
Основания![]()
Кислотные свойства соединения обнаруживаются лишь в присутствии основания, которому можно отдать протон, а основные свойства – лишь в присутствии кислоты. В водных растворах основанием чаще всего является вода.
Кислотность – способность частицы отдавать протон
К![]()
![]() оличественно
силу слабой кислоты можно оценить с
помощью константы кислотности Ка
оличественно
силу слабой кислоты можно оценить с
помощью константы кислотности Ка

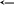
Чем больше величина Ка, тем сильнее кислота. А также с помощью показателя кислотности рКа (рКа = -lgКа). Чем он меньше, тем кислота сильнее.
К
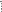 ислотный
центр - это атом и связанный с ним атом
водорода, способный оторваться в виде
протона.
А ••
Н
ислотный
центр - это атом и связанный с ним атом
водорода, способный оторваться в виде
протона.
А ••
Н
Типы кислот
С![]()
![]() Н-кислоты
Н-кислоты
![]() OH-кислоты
OH-кислоты
N![]() H-кислоты
SH-кислоты
H-кислоты
SH-кислоты
Большинство органических соединений обладает низкой кислотностью. Из всех потенциальных кислот только карбоновые кислоты изменяют окраску индикатора, т.е. являются наиболее сильными.
Для прогнозирования силы кислоты используют качественный подход.
Кислота тем сильнее, чем более поляна связь в кислотном центре и легче отрывается протон.
Более важным фактором, влияющим на силу кислоты, является устойчивость сопряженного основания (аниона), образовавшегося после отрыва протона. Стабильность аниона тем выше, чем лучше в нем делокализован (рассредоточен) отрицательный заряд.

Кислота тем сильнее, чем стабильнее ее анион, т.е. чем эффективнее в нем делокализован отрицательный заряд.
По этой причине сопряженные основания в виде молекул всегда устойчивее анионов и соответствующие им кислоты (ониевые ионы) легче отдают протон.
![]()
![]()
Кислоты
Сопряжённые
основания
Факторы, влияющие на силу кислоты
природа атома в кислотном центре
В периоде слева направо, где радиус атомов почти одинаков, кислотность возрастает с увеличением электроотрицательности атома, т.к. растет способность атома удерживать отрицательный заряд в анионе.
![]()
Увеличение силы
кислоты
По этой же причине возрастает сила СН-кислот с изменением состояния гибридизации атома углерода и увеличения его электроотрицательности.
Csp3 Csp2 Csp
Увеличение
электроотрицательности
O |
F |
S |
Cl |
|
Br |
|
J |
 группе сверху вниз кислотность возрастает,
хотя электроотрицательность атома при
этом уменьшается.Причиной является
более эффективная делокализация
отрицательного заряда в большем
объеме (в трехкомнатной квартире легче
спрятаться, чем в одной комнате).
группе сверху вниз кислотность возрастает,
хотя электроотрицательность атома при
этом уменьшается.Причиной является
более эффективная делокализация
отрицательного заряда в большем
объеме (в трехкомнатной квартире легче
спрятаться, чем в одной комнате).
Поэтому тиолы реагируют не только с щелочными металлами, как спирты, но и со щелочами
![]()

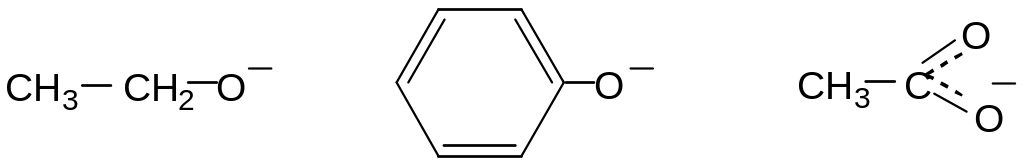
Наличие сопряжения, способствующего стабилизации аниона. Из всех органических ОН-кислот наиболее сильными являются карбоновые кислоты.

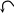
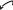
рКа = 16 рКа =
10 рКа = 4,7
Это связано с особой устойчивостью ацилат-аниона RCOO− , в котором за счет р-π сопряжения отрицательный заряд делокализуется с участием двух атомов кислорода, поэтому менее концентрирован, чем в алкоксид-ионе RO−
Увеличение
устойчивости аниона
Наличие электроноакцепторного заместителя в радикале, связанным с кислотным центром. При одинаковых кислотных центрах наличие электроноакцепторных заместителей в радикале способствует делокализации отрицательного заряда в анионе, независимо от вида эффекта заместителя (индуктивного или мезомерного).
Чем ближе ЭА-заместитель к кислотному центру, тем выше кислотность органического соедиения.
![]()
рКа = 4,7 рКа
= 3,8 рКа = 2,9 рКа = 0,7
Увеличение
кислотности
Задание
В сильнокислой среде все ионогенные группы α-аминокислот и белков протонированы (являются донорами протонов). Используя закономерности сравнительной силы кислот, определите, какая группа первой отдаст протон основанию при добавлении к белку небольших количеств щелочи. Изобразите вид этого белка при рН = 7
NaOH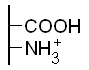

Основность – способность частицы принимать протон
Для присоединения протона, т.е. образования с ним ковалентной связи, основание должно предоставлять либо неподеленную пару электронов (п (пэ)-основание), либо электроны π-связи. Чем больше электронная плотность в основном центре и основание меньше удерживает свои электроны, тем основание сильнее.
п-основания – анионы являются более сильными основаниями, чем нейтральные молекулы (спирты, вода, амины, аммиак, тиолы).
>>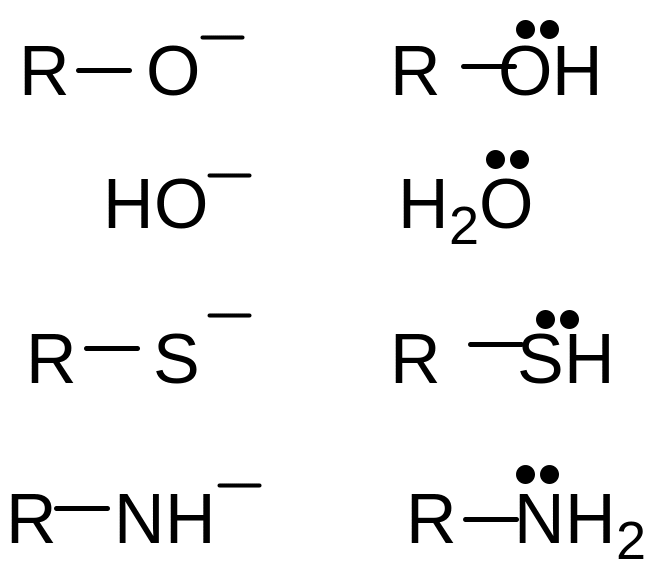
>>
>>
>>
π-основания (алкены, алкадиены, арены) являются очень слабыми основаниями, т.к. протонируемые электронные пары несвободны.

H+
+ H+


π-
комплекс
Для количественной характеристики силы основания можно использовать константу основности (Кb) или ее показатель рКb. Однако чаще всего используют значение показателя константы кислотности кислоты, сопряженной этому основанию Кbн+
рКbн+
= 14 - рКb![]()
Основание
Сопряжённая
кислота

Чем больше значение Кbн+, тем сильнее основание.
Факторы, влияющие на основность те же, но противоположны их действию на кислотность
а) Для оснований с одинаковыми радикалами основность в периоде увеличивается с уменьшением электроотрицательности атома в основном центре.
Увеличение
основности
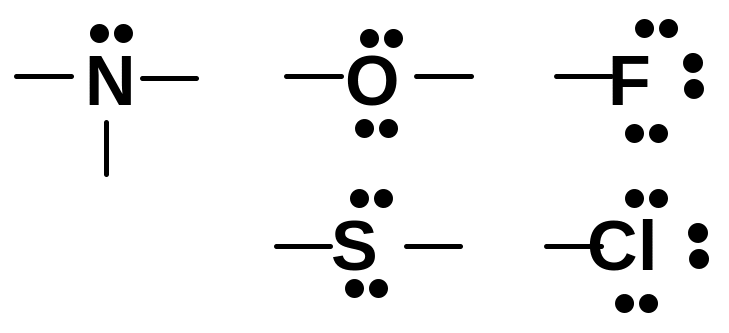


Алифатические амины являются наиболее сильными из органических оснований, с разбавленными кислотами образуют соли аммония.
![]()

б )
электронодонорные заместители повышают
основность органического соединения,
электроноакцепторы – уменьшают.
)
электронодонорные заместители повышают
основность органического соединения,
электроноакцепторы – уменьшают.
>
>

рКb
= 10,6
рКb
= 9,2 рКb
= 4,6
Задание
В сильнощелочной среде все ионогенные группы α-аминокислот и белков являются акцепторами протонов. Используя закономерности сравнительной силы оснований, определите, какая группа будет протонироваться первой при добавлении к белку небольших количеств кислоты и приведите вид образующегося белка
+ HCl

