
- •Изменения белков и других азотистых веществ в технологических процессах производства продуктов общественного питания
- •Строение белков
- •1.2. Классификация белков
- •1.3. Гидратация и дегидратация белков
- •1.4. Денатурация и свёртывание белков
- •Лабораторная работа № 1 Работа 1. Влияние температуры на изменение растворимости мышечных белков мяса и рыбы
- •Работа 2. Коагуляция глобулярных белков
- •Техника выполнения работы
- •Работа 3. Влияние углеводов на температуру коагуляцию белков
- •Работа 4. Влияние тепловой обработки на деформацию соединительной ткани
- •Контрольные вопросы
- •2. Изменения липидов в технологических процессах производства продуктов общественного питания
- •2.1. Технологические свойства жиров
- •2.2. Гидролиз жиров
- •2.3. Изменение жиров при варке
- •2.4. Изменение жиров при жарке
- •2.5. Изменение жиров при фритюрной жарке
- •2.6. Изменение цвета, вкуса и запаха жира в процессе жарки продукта во фритюре
- •2.7. Впитывание и адсорбция продуктами жира и его потери при жарке
- •Контрольные вопросы и задания
- •3. Изменения углеводов в технологических процессах производства продуктов общественного питания
- •3.1. Кислотный гидролиз сахарозы
- •3.2. Карамелизация сахаров
- •3.3. Меланоидинообразование
- •3.4. Ферментативный гидролиз
- •3.5. Изменение крахмала при гидротермической обработке
- •3.6. Состояние крахмальных клейстеров в крахмалосодержащей кулинарной продукции
- •Модификация крахмала
- •3.7. Декстринизация крахмала
- •Работа 2. Изменение вязкости крахмального клейстера
- •Контрольные вопросы и задания
- •Библиографический список
1.3. Гидратация и дегидратация белков
Гидратацией называют способность белков связывать воду. При этом основная часть воды связывается с белками адсорбционно. Различают два вида адсорбции − ионную и молекулярную.
Ионная адсорбция – связывание воды ионизированными свободными полярными группами (-NH3+,-COO-). Величина ионной адсорбции зависит от pH среды. Сдвиг pH среды в ту или иную сторону от изоэлектрической точки приводит к усилению диссоциации основных (NH2) или кислотных (COOH) групп белка, к увеличению заряда белковых молекул и усилению гидратации белка. В изоэлектрической точке (когда заряд белковой молекулы близок к нулю) способность белка связывать воду наименьшая.
Молекулярная адсорбция − присоединение молекул воды засчёт связанных полярных групп (пептидных групп полипептидных цепей –NH-CO-, гидроксильных, сульфогидрильных и т.д.)Величина молекулярной адсорбции постоянна для каждого вида белка.
В растворах с малой концентрацией (молоко, жидкое тесто) белки полностью гидратированы и больше связывать воду не могут. Способность белков к дополнительной гидратации имеет большое значение в кулинарной практике. Дополнительная гидратация имеет место при добавлении воды к рубленому мясу (котлеты, биточки, бифштексы, фрикадельки, фарш для пельменей и т.д.), при добавлении молока к яйцам (изготовление омлетов), при изготовлении теста, при замачивании бобовых и т.д.
Для увеличения водосвязывающей способности белков в ряде случаев увеличивают заряд белковой молекулы путем сдвига рН от изоэлектрической точки (маринование мяса, рыбы и т.д.). От степени гидратации во многом зависят органолептические показатели качества готовой продукции − сочность, консистенция, вкус.
Дегидратация – потеря белками связанной воды при сушке продуктов, замораживания и размораживания мяса и рыбы, при тепловой обработке полуфабрикатов и т.д. От степени дегидратации зависит такой важный показатель, как выход готовых изделий.
1.4. Денатурация и свёртывание белков
Белки природных продуктов называют нативными (натуральными). Под действием различных факторов (физических, химических, биологических) происходит изменение природных свойств белков. Денатурация − нарушение нативной пространственной структуры белковой молекулы под влиянием внешних воздействий.
К числу таких воздействий можно отнести нагревание (тепловая денатурация), встряхивание, взбивание или другие резко механические воздействия (поверхностная денатурация), высокую концентрацию водородных или гидроксильных ионов (кислотная, щелочная денатурация). При кулинарной обработке денатурацию белков вызывает чаще всего нагревание.
При денатурации белков наиболее важную роль играет вода, добавленная извне или содержащаяся в составе самих пищевых продуктов. Известно, что такие продукты, как мясо, рыба, овощи и другие, содержат значительное количество влаги.
Роль и значение воды для денатурации белков легко объяснимы. При повышении температуры молекулы воды приобретают кинетическую энергию и в определённый момент эта энергия станет больше энергии связей, удерживающих белковую молекулу в нативном состоянии.
Агрегаты воды, имеющие при высокой температуре меньшие размеры и большую скорость диффузии, чем молекула белка, проникают во внутрь последних и постоянно ударяются о полипептидные цепи. При этом складки полипептидных цепей глобулярных белков начинают отходить друг от друга. Кроме того, молекулы белков постоянно испытывают движение, в результате чего разрываются солевые мостики, водородные, эфирные, ионные связи и гидрофобные взаимодействия. В результате разрыва этих связей, поддерживающих белковую молекулу в свёрнутом состоянии, полипептидная цепь разворачивается с потерей глобулярной формы, то есть денатурирует. Схема свёртывания денатурированного белка показана на рисунке 1.
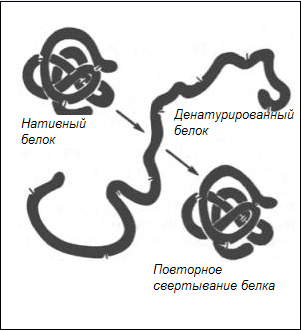
Рисунок 1 − Схема свёртывания денатурированного белка
В процессе разворачивания цепи разорванные внутренние водородные связи во вторичной и третичной структурах нативного белка заменяются внешними водородными связями с водой, что обусловливает разрыхление структуры денатурированных белков глобул.
В «мягких» условиях денатурированный белок может обратно восстанавливать своё нативное состояние. Однако в условиях кулинарной обработки продуктов, в связи с проведением её в «жёстких» условиях, это явление исключено.
В зависимости от свойств нативных белков денатурация наступает при температуре 50 − 600С и ускоряется с повышением температуры.
При тепловой кулинарной обработке фибриллярные белки подвергаются денатурации. Однако характер денатурации зависит от особенностей их нативного строения. Например, в горячей воде эластин только набухает, а с коллагеном происходят более глубокие изменения, результатом которых является образование студня. И для денатурации фибриллярных белков решающую роль также играет вода. Однако при глубокой денатурации коллагена (кроме воды) важным фактором является продолжительность воздействия тепла.
В коллагеновой молекуле под действием горячей воды происходит разрыв связей как внутри цепочек, так и между ними. Обычно выделяют три стадии глубокой денатурации коллагена. В первой стадии разрываются водородные связи внутри полипептидных цепочек коллагена, во второй происходит разрыв боковых связей, удерживающих полипептидные цепи молекулы коллагена в компактном состоянии, а в третьей – разрыв водородных связей между карбоксильными группами пептидных цепей и молекулами воды. Разделение процесса денатурации на стадии условное, т.к. в первую очередь должны разрываться слабые водородные связи.
Имеются данные, что в результате разрыва внутри- и межцепочечных связей из тройной спирали коллагена образуется двойная и одинарная спирали. При этом последняя приобретает форму клубка. Затем переходят в клубок полипептидные цепочки двойной спирали.
Сокращение коллагеновых волокон при тепловой обработке обусловлено, вероятно, переходом тройной спирали молекулы коллагена в клубок.
Превращение ассоциированных длинных полипептидных цепочек молекулы коллагена в клубок заканчивается при температуре 62 − 650С, так как в этом интервале температур коллагеновые волокна сокращаются по длине в 3 − 4 раза и при дальнейшем нагревании существенных изменений не претерпевают.
При денатурации коллагена возможен разрыв и поперечных межмолекулярных ковалентных связей, если учесть, что при длительной гидротермической обработке коллаген распадется с образованием водорастворимых полимеров (глютинов) за счёт гидролиза лабильных пептидных связей в первичной структуре белка. Денатурация коллагена также необратима, как и глобулярных белков.
Если исходить из общего понятия денатурации, то более глубокие изменения коллагена с образованием водорастворимых глютинов также можно рассматривать как результат его денатурации. Отдельные приёмы первичной обработки также могут вызывать денатурацию белков пищевых продуктов. Изменение нативного состояния претерпевают белки при механическом способе замешивания, перемешивании измельчённых богатых белком продуктов и взбивании белковых веществ.
Белки зерномучных продуктов находятся в высохшем состоянии, при добавлении воды они сильно гидратируются за счёт образования водородных связей между молекулами белка и воды.
При перемешивании теста белок клейковины сильно вытягивается, что приводит к разрыву водородных, гидрофобных связей и солевых мостиков.
Следовательно, белковые вещества муки при замесе теста в результате механического вытягивания и разрыва нативных связей претерпевают денатурационные изменения.
Отдельные водорастворимые белки при взбивании способны образовывать на поверхности пузырьков воздуха мономолекулярные тонкие плёнки. Пептидные цепи молекулярного белка при механическом воздействии развёртываются и как бы обволакивают пузырьки воздуха , образуя на их поверхности тонкую плёнку, и пребывают в развёрнутом состоянии. Такой вид денатурации в литературе принято называть поверхностной.
Одним из немаловажных факторов денатурации является изменение рН среды. В процессе приготовления пищи используют в основном направленное изменение рН в сторону снижения кислотности.
В глобулярных белках при нагревании усиливается тепловое движение полипептидных цепей внутри глобулы; водородные связи, фиксирующие складчатость полипептидных цепей разрываются, при этом полипептидные цепи в глобуле развёртываются, а затем сворачиваются по новому типу. На поверхности белковой глобулы уменьшается количество полярных групп, способных связывать молекулы воды. Более активными становятся гидрофобные радикалы(в первую очередь сульфагидрильные группы цистеина –SH и дисульфидные цистина –S –S), которые либо находились внутри молекул, либо были экранированы за счёт влияния соседних групп. По содержанию –SH групп нередко судят о глубине денатурации белка. Для денатурации белка необходимо присутствие хотя бы небольшого количества воды. Развертывание полипептидных цепей не может происходить, если вода не проникает в пространство между их складками. Абсолютно сухой белок не подвергается денатурации даже при длительном нагревании.
Денатурация сопровождается изменением важнейших свойств белка:
- потерей биологической активности (инактивация ферментов);
-потерей индивидуальных свойств(например, изменение окраски мяса);
-потерей способности к гидратации(растворению, набуханию);
-улучшением атакуемости протеолитическими ферментами;
-повышением реакционной способности белков;
-агрегированием белковых молекул, т.е. их укрупнением, приводящим к свертыванию.
В зависимости от коллоидного состояния белка и его концентрации различают три типа свёртывания.
- Если концентрация белка в золе была низкой (до 1%), то свернувшийся белок образует хлопья (пена на поверхности бульонов, хлопья денатурированного лактоальбумина при кипячении молока).
-Если концентрация белка была высокой (концентрированный золь), то при свёртывании образуется студень (гель), удерживающий всю воду (варка яиц например).
-Если белок в нативном состоянии находится уже в виде студня, то он при нагревании уплотняется с выпресовыванием части жидкости (получение творога из простокваши; выделение сока пр нагревании мяса и рыбы).
Свёртывание в изоэлектрической точке проходит быстрее, при более низкой температуре и сопровождается максимальной дегидратацией белка. Смещение рН в ту или другую сторону от ИЭТ приводит к ослаблению денатурационных процессов. Этим широко пользуются в кулинарной практике для улучшения качества блюд и кулинарных изделий (маринование мяса и рыбы перед обжаркой; тушение мяса с добавлением томата и т.д.).
При снижении кислотности многие малоконцентрированные белковые золи в изоэлектрической точке образуют нежные гели за счёт уравновешивания положительных, отрицательных зарядов, обусловленных диссоциацией ионных групп (-COO- и NH3+) белков. При этом разрываются связи белков с растворителем и белковые молекулы начинают беспорядочно оседать, образуя сетчатую структуру и заключая в неё жидкость.
При величинах рН, лежащих значительно ниже изоэлектрической точки, белковые вещества продуктов также испытывают денатурацию, но отличную от денатурации в изоэлектрической точке, что наблюдается при мариновании жёстких частей туши мяса.
В процессе денатурации белка в сильно кислой среде важную роль играют электростатические силы отталкивания между одноименными зарядами полярных групп(-NH3+). Обычным следствием отталкивания зарядов является набухание и увеличение объёма белковой молекулы в результате разрыва нативных связей. При этом происходит перестройка полипептидной цепи глобулярных и нарушение нативной структуры глобулярных белков. В связи с этим белки пищевых продуктов, пребывающих в кислой среде, денатурируются при низких температурах. Это особенно важно для мясопродуктов, содержащих значительное количество соединительно-тканных белков.
Перевариваемость денатурированных глобулярных белков по сравнению с нативными значительно повышается. Причина улучшения перевариваемости денатурированных белков, по-видимому, заключается в том, что ферменты разрывают пептидные связи избирательно: так, фермент химотрипсин гидролизует только пептидные связи, возникшие с участием лизина и аргинина. Другие карбоминные связи они не гидролизуют, поэтому недоступные в нативных белках ферментам пептидные связи находящиеся внутри глобулы, не разрываются. При денатурации глобула белка разворачивается и пептидные связи становятся доступными к действию ферментов, поэтому скорость атаки ферментами денатурированных глобулярных белков повышается почти в 100 раз, чем нативных.
В свою очередь, на гидролизующую активность ферментов влияют их ингибиторы белкового происхождения, которые являются постоянными компонентами многих, особенно растительных продуктов. Они широко распространены в семенах бобовых, злаковых культур, картофеле, яйце.
Ингибиторы снижают активность в основном трипсина и химотрипсина. Однако они как белковые вещества под действием тепла денатурируются с потерей отрицательного влияния на активность протеолитических ферментов. В то же время ингибиторы таких продуктов, как соя, свою антиферментную активность сохраняют даже при 1000С, что соответствует условиям варки продуктов. При денатурации коллагена под действием горячей воды разрываются внутри- и межмолекулярные нековалентные связи. Возможен также разрыв поперечных ковалентных пептидных связей в первичной структуре белка.
Результатом более глубокой денатурации коллагеновых волокон является образование водорастворимых низкомолекулярных полимеров. Последние называются глютинами. Расщипляемость глютина пищеварительными ферментами намного выше, чем коллагена.
Глютины как белковые вещества на своей поверхности имеют гидрофильные свободные функциональные группы(-NH2, -COOH)(-CO NH- , -SH, -OH и др.). При варке мясопродуктов глютины переходят в бульон. Концентрация их в бульоне при температуре кипения является функцией времени. В процессе кипения бульона глютины вместе с молекулами воды находятся в постоянном хаотическом движении. При охлаждении бульона до температуры 400С и ниже глютины при концентрации 1% и более образуют плотные гели.
При охлаждении бульонов прекращается движение молекул воды и глютиновые полимеры переходят в состояние покоя. При этом между молекулами глютина за счёт свободных функциональных групп возникают межмолекулярная ориентация и взаимное притяжение, в результате чего глютиновые полимеры образуют сетку.
В ячейках сетки остаётся вода, и бульон загустевает. Стойкость каркаса образованной сетки обеспечивается за счёт появления водородных связей между гидрофильными участками молекул глютина и воды, оставшейся в ячейках. Чем более полярными являются молекулы глютина, тем сильнее они притягиваются друг к другу и тем сильнее ориентационное взаимодействие.
На скорость образования и консистенцию студней положительное влияние оказывает повышение концентрации глютинов в бульоне, так как уменьшается расстояние между их молекулами. Добавление соли также ускоряет образование студней. При низкой температуре получаются более плотные студни.
При нагревании студни обратно переходят в жидкое состояние. Это объясняется тем, что под действием тепла молекулы воды приобретают кинетическую энергию, которая значительно выше энергии водородных связей и взаимных притяжений. Поэтому за счёт движения молекул воды в ячейках молекулы глютина отходят друг от друга, а вода выходит наружу.
