
588_Gulaja_E._V._Fiziko-khimija_nanomaterialov_
.pdf
ЛАБОРАТОРНАЯ РАБОТА № 4 ОПРЕДЕЛЕНИЕ ПОВЕРХНОСТНОГО НАТЯЖЕНИЯ ЖИДКОСТЕЙ
Цель работы: научиться определять поверхностное натяжение жидкостей сталагмометрическим методом; изучить изменение поверхностного натяжения жидкостей в зависимости от ее химического состава.
Теоретические сведения. Наиболее характерным свойством жидкости, отличающим ее от газа, является то, что на границе с газом жидкость образует свободную поверхность, наличие которой приводит к возникновению явлений особого рода, называемых поверхностными. Своим возникновением они обязаны особым физическим условиям, в которых находятся молекулы вблизи свободной поверхности.
На каждую молекулу жидкости действуют силы притяжения со стороны окружающих ее молекул, расположенных от нее на расстоянии порядка 10' м (радиус молекулярного действия). На молекулу М1, расположенную внутри жидкости (рис. 4.1), действуют силы со стороны таких же молекул, и равнодействующая этих сил близка к нулю.
Рис. 4.1. Межмолекулярные силы, действующие на молекулу в поверхностном слое и в объеме жидкости
Для молекул М2 равнодействующие сил отличны от нуля и направлены внутрь жидкости, перпендикулярно к ее поверхности. Таким образом, все молекулы жидкости, находящиеся в поверхностном слое, втягиваются внутрь жидкости. Но пространство внутри жидкости занято другими молекулами, по-
этому поверхностный слой создает давление на жидкость (молекулярное дав-
ление). Чтобы переместить молекулу М3, расположенную непосредственно под поверхностным слоем, на поверхность, необходимо совершить работу против сил молекулярного давления. Следовательно, молекулы поверхностного слоя жидкости обладают дополнительной потенциальной энергией по сравнению с молекулами внутри жидкости. Эту энергию называют поверхностной энергией Гиббса cucmeмы (∆Gs, Дж). Очевидно, что величина поверхностной энергии тем больше, чем больше площадь свободной поверхности. Пусть площадь сво-
21

бодной поверхности изменилась на ∆S, при этом поверхностная энергия изменилась на
Gs S, |
(4.1) |
где ϭ – коэффициент пропорциональности, называемый для подвижных границ раздела поверхностным натяжением.
Из химической термодинамики известно, что самопроизвольно протекают только те процессы, которые приводят к уменьшению свободной энергии системы. Поэтому жидкость обнаруживает стремление к сокращению свободной поверхности. Поверхностный слой жидкости ведет себя подобно растянутой резиновой пленке: все время стремится сократить площадь своей поверхности до минимальных размеров, возможных при данном объеме. Например, капля жидкости в состоянии невесомости имеет сферическую форму, поскольку именно сферические частицы имеют самую маленькую удельную поверхность. Так как для этого изменения необходимо совершить работу:
A Gs , |
(4.2) |
то |
|
A S , |
(4.3) |
отсюда
A (4.4)
S .
Таким образом, поверхностное натяжение – величина, численно равная работе, которую необходимо совершить молекулярным силам при изменении площади свободной поверхности жидкости на единицу площади раздела фаз при постоянной температуре. Единицей поверхностного натяжения в СИ является [Дж/м2], а в СГС – [дин/см]. В настоящей работе σ определяется методом отрыва капель.
Величина поверхностного натяжения зависит от химического состава жидкости, среды, с которой она граничит, температуры. С ростом температуры σ уменьшается и при критической температуре обращается в нуль.
Поверхностное натяжение является причиной капиллярных явлений, смачивания – несмачивания поверхности, слипания твердых частиц дисперсной фазы (коагуляция), слипания капель в эмульсиях (коалесценция), роста кристаллов и т. д.
Методы определения поверхностного натяжения
Методы определения поверхностного натяжения на границе раздела жидкость – газ делятся на две группы: динамические (кинетические) и статические. К динамическим методам относятся: метод наибольшего давления пузырька газа (метод Ребиндера); метод счета капель (сталагмометрический метод); метод отрыва кольца; метод пластинки Вильгельми и др. Из статических методов наиболее известным является метод поднятия жидкости в капилляре.
22
Метод наибольшего давления пузырька газа (метод Ребиндера)
Метод основан на измерении давления, при котором происходит отрыв пузырька газа (воздуха), выдуваемого в жидкость через капилляр. При медленном продавливании пузырька из капилляра в жидкость в нем возникает избыточное внутреннее давление р, которое рассчитывается по закону Лапласа.
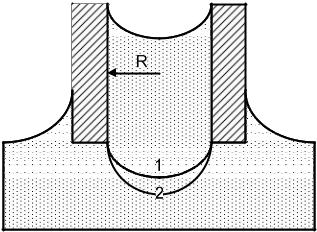
Радиус кривизны r изменяется по мере продавливания пузырька в жидкость. В начальный момент времени (рис. 4.2) пузырек имеет большой радиус кривизны и поверхность его почти плоская (r R ). Со временем радиус кривизны уменьшается, пузырек становится все более выпуклым и при r R избыточное давление внутри пузырька достигает максимального значения рmax. Это давление соответствует внешнему давлению в капилляре. Для дальнейшего увеличения размера пузырька не требуется повышения внешнего давления, поскольку с ростом пузырька внутреннее давление в нем в соответствии с уравнением Лапласа уменьшается. В результате воздух, находящийся в трубке, устремляется к сформировавшемуся пузырьку и приводит к его отрыву от капилляра.
Рис. 4.2. Изменение радиуса кривизны поверхности пузырька газа: 1 – r>>R; 2 – r= R
Чтобы избежать трудностей, связанных с измерением радиуса кривизны r, поверхностное натяжение определяют относительным способом: находят наибольшее давление пузырька газа в воде:
H2O |
|
r pH |
2O |
(4.5) |
|||||
|
2 |
|
|
|
|
||||
и в исследуемом растворе ПАВ: |
|
|
|
|
|
|
|
||
|
r pX |
|
|
(4.6) |
|||||
X |
|
|
, |
||||||
|
|
|
|||||||
|
|
|
|
|
|||||
откуда |
|
|
|
2 |
|
|
|
|
|
|
|
|
|
pX |
(4.7) |
||||
X H2O |
|
||||||||
|
|
, |
|||||||
|
|
|
|||||||
pH2O
H2O при данной температуре находят по справочнику.
23

Сталагмометрический метод (метод счета капель)
При вытекании жидкости из капилляра сталагмометра вес образующейся капли (Р) в момент отрыва капли равен силе (F), стремящейся удержать каплю.
Сила, стремящаяся удержать каплю, пропорциональна поверхностному
натяжению вытекающей из капилляра жидкости: |
|
|||||
F |
|
|
R |
|
, |
(4.8) |
|
2 |
|
|
|||
где R – радиус капилляра.
Вес, образующейся капли связан с числом капель уравнением:
P |
V g |
|
|
(4.9) |
||
|
|
|
|
|
||
|
|
n |
, |
|
|
|
где – плотность жидкости; |
|
|
|
|
||
g – ускорение свободного падания, равное 9,81 м/с2; |
|
|||||
V – объем сталагмометра; n – число капель; |
|
|||||
V g – вес жидкости в сталагмометре. |
|
|||||
Тогда |
|
|
|
(4.10) |
||
2 R |
V g |
|
||||
|
|
|||||
|
|
|
n . |
|
||
Отсюда, поверхностное натяжение жидкости будет равно:
|
V g |
|
|
|
(4.11) |
||
|
|
|
. |
|
|
||
|
|
|
|
||||
|
2 R |
n |
V g |
|
|||
Для каждого сталогмометра величина |
const, плотность жидкости |
||||||
|
|||||||
2 R
определяют из параллельного опыта.
Чтобы исключить характеристики сталагмометра, подсчитывают число капель исследуемой (nХ) и стандартной жидкостей (nH2O ). В качестве стан-
дартной жидкости обычно используют воду, поверхностное натяжение которой известно. Тогда
X H2O |
nH O X |
(4.12) |
|||
|
2 |
|
. |
|
|
nX |
|
H O |
|
||
|
|
|
2 |
|
|
Метод капиллярного поднятия жидкости
Высоту капиллярного поднятия (опускания) жидкости в капилляре рассчитывают по уравнению Жюрена.
На практике краевой угол смачивания часто не известен. В этом случае принимают, что жидкость полностью смачивает стенки капилляра (полное смачивание), следовательно, θ = 00, cosθ = 1, тогда уравнение Жюрена приобретает вид:
|
(4.13) |
2
h g R .
24

В таком виде уравнение Жюрена используют в практических расчетах для вычисления поверхностного натяжения жидкостей методом поднятия жидкости в капилляре. Отсюда поверхностное натяжение будет равно:
h g R . (4.14)
2
Экспериментальная часть
1. Для определения значения ϭ0 в условиях эксперимента постройте график зависимости поверхностного натяжения воды от температуры по данным табл. 4.1.
Табл. 4.1. Поверхностное натяжение воды, дин/см
T0C |
σ |
T0C |
σ |
T0C |
σ |
T0C |
σ |
0 |
75,49 |
20 |
72,53 |
40 |
69,54 |
70 |
64,2 |
5 |
74,75 |
25 |
71,78 |
45 |
68,60 |
80 |
62,3 |
10 |
74,01 |
30 |
71,03 |
50 |
67,80 |
|
|
15 |
73,26 |
35 |
70,29 |
60 |
66,06 |
|
|
2.Наберите в шприц сталагмометра 4 мл дистиллированной воды вращением ручки микрометра против часовой стрелки. Запишите начальное показание микрометра (на вертикальной шкале указаны целые числа, на круговой – целые и сотые доли).
3.Поставьте под капилляр емкость для вытекания воды. Вращением ручки микрометра по часовой стрелке выдавите 50 капель воды. Важным является процесс формирования капли. Если жидкость будет вытекать слишком быстро, то сила инерции поступающей жидкости оторвет каплю раньше времени. Слишком медленно формировать каплю нерационально, т. к. время измерения будет очень большим. Поэтому рекомендуется отрегулировать скорость формирования капли таким образом, чтобы одна капля обрывалась один раз за 2–3 сек. После окончания процедуры запишите показания микрометра.
4.По разнице конечного и начального показания микрометра определите объем 50 капель воды. Одна единица шкалы соответствует 0,2 мл жидкости. Массу вытекшей воды рассчитайте по формуле:
P0 V p . |
(4.15) |
5. Наберите в шприц сталагмометра 4 мл спиртового раствора и проведите эксперимент по определению объема 50 капель. Вычислите их массу. Рассчитайте поверхностное натяжение раствора спирта, пользуясь формулой:
X |
0 |
PX |
, |
(4.16) |
|
||||
|
|
P |
|
|
|
|
0 |
|
|
где ϭ0 – 72·10' Н·м – поверхностное натяжение воды при температуре 250С; Рх и Р0 – вес 50 капель исследуемой жидкости и воды соответственно.
25
6.Промойте шприц водой.
7.По описанной методике определите поверхностное натяжение растворов сахара и соли.
8.Для получения точных результатов рекомендуется каждый опыт по-
вторить три раза и вычислить среднее значение σх. 9. Запишите результаты измерений в табл. 4.2.
Табл. 4.2. Результаты измерений
Исследуемая |
V1 |
V2 |
V3 |
<V> |
<σ> |
Справочное |
δ,% |
жидкость |
значение σ |
||||||
|
|
|
|
|
|
|
|
δ – ошибка измерения в %.
Запишите вывод, указав физический смысл измеренной величины, и объясните, почему результат, полученный в работе, отличается от табличной величины.
Техническое обслуживание. Перед началом работы шприц промывают горячей дистиллированной водой и затем спиртом. Из капиллярного кончика оставшуюся жидкость удаляют путем легкого прикосновения капилляром к фильтровальной бумаге.
Затем определяют поверхностное натяжение воды и трех жидких растворов (спирта, сахара и соли) при комнатной температуре. Перед тем как заполнять шприц новой жидкостью, его следует ополоснуть чистой водой и промокнуть кончик капилляра. Каждый раз после окончания работы с устройством необходимо: устройство вымыть и насухо вытереть; шприц промыть горячей водой и высушить спиртом.
Вопросы и задания для самоконтроля
1.Чем отличается строение жидкости от строения твердых тел?
2.Как следует понимать выражение «ближний порядок» в жидкостях?
3.Что такое поверхностный слой в жидкости? Почему он обладает свойствами, отличными от свойств остальной массы жидкости?
4.Что такое поверхностное натяжение? Как направлены силы поверхностного натяжения?
5.Почему поверхностное натяжение зависит от рода жидкости?
6.Почему и как поверхностное натяжение зависит от температуры?
7.В двух одинаковых пробирках находится одинаковое количество капель воды. В одной пробирке вода чистая, а другой – с добавкой мыла. Одинаковы ли объемы отмеренных капель? Ответ обоснуйте.
26
ЛАБОРАТОРНАЯ РАБОТА № 5 АДСОРБЦИЯ И ДЕСОРБЦИЯ. ИЗБИРАТЕЛЬНОСТЬ АДСОРБЦИИ
Цель работы: Качественно проследить адсорбцию нескольких окрашенных растворов и возможность обратного процесса десорбции и избирательной адсорбции.
Теоретические сведения. Явление концентрирования газов на границе твердое тело–газ было открыто в конце XVIII в. независимо шведским химиком и фармацевтом К. Шееле (1742–1786) и итальянским профессором Ф. Фонтана (1730–1805). Фонтана обнаружил, что свежепрокаленный древесный уголь обладает способностью поглощать различные газы в объемах, значительно превосходящих его собственный объем. Шееле установил, что в ряде случаев этот процесс обратим: при изменении условий поглощенный газ может выделяться.
Самопроизвольное поглощение каким-либо твердым материалом других веществ называется сорбцией. Если процесс сорбции характеризуется увеличением концентрации вещества на границе раздела фаз, то говорят об адсорбции вещества. Если поглощаемое вещество диффундирует вглубь поглотителя и распределяется по всему объему, то это явление называется абсорбцией. Вещество, на поверхности которого происходит адсорбция, называется адсорбентом (рис. 4.2). Поглощаемое вещество, еще находящееся в объеме фазы, называют адсорбтивом, поглощенное – адсорбатом. Процесс, обратный адсорбции, когда часть молекул с поверхности переходит обратно в объем, называется десорбцией. При равенстве скоростей адсорбционного и десорбционного процессов наступает состояние равновесия (равновесная адсорбция).
В качестве адсорбентов могут выступать разнообразные материалы с высокой удельной поверхностью: пористый углерод (наиболее распространенная форма – активированный уголь), силикагели, цеолиты, а также некоторые другие группы природных минералов и синтетических веществ. Адсорбционные свойства углей в основном определяются микропорами, составляющими до 90 % всей поверхности активного угля. На ней и протекают процессы адсорбции, в основе которых лежит взаимодействие энергетически ненасыщенных атомов углерода с молекулами сортируемых веществ. В большем количестве сорбируются вещества в молекулярной форме, в меньшем – в ионной.
Причиной адсорбции являются неспецифические (т. е. не зависящие от природы вещества) Ван-дер-Ваальсовые силы: ориентационные, индукционные, дисперсионные. Адсорбция, осложненная химическим взаимодействием между адсорбентом и адсорбатом, является особым случаем. Явления такого рода называют хемосорбцией (или химической адсорбцией). «Обычную» адсорбцию в случае, когда требуется подчеркнуть природу сил взаимодействия, называют физической адсорбцией. При любой адсорбции происходит уменьшение энергии системы, т. е. выделяется теплота (∆Надс < 0, процесс экзотермический). Процесс хемосорбции характеризуется большими величинами энтальпии (∆Надс = 25...450 кДж/моль) по сравнению с физической адсорбцией
(∆Надс = 10...25 кДж/моль).
27
Табл. 5.1. Отличительные особенности химической и физической адсорбции
Виды |
Взаимодействия |
Взаимодействия |
взаимодействий |
только на поверхности |
по всему объему |
Физические |
Адсорбция |
Абсорбция |
Химические |
Хемосорбция |
Гетерогенная реакция |
Адсорбция углем органических веществ из раствора была открыта в 1785 г. Т.Е. Ловитцем (Россия). В зависимости от типа адсорбирующихся частиц различают молекулярную и ионную адсорбцию.
Молекулярная адсорбция осуществляется из растворов неэлектролитов. П.А. Ребиндер (Россия) предложил правило выравнивания полярностей,
согласно которому на полярных адсорбентах лучше всего адсорбируются полярные адсорбаты из неполярных растворителей, а на неполярных адсорбентах
– неполярные адсорбаты из полярных растворителей.
Экспериментальная часть
Опыт 1. Адсорбция и десорбция
В пробирки наливают по 3 мл окрашенных растворов фуксина, эозина, метиленового синего, берлинской лазури. В каждую пробирку вносят по одной таблетке растертого активированного угля и взбалтывают в течение 3–5 мин. Затем каждую смесь фильтруют через бумажные фильтры, помещенные в воронку. Получают бесцветные фильтраты (если растворы не были слишком концентрированными), что свидетельствует об адсорбции каждого из красителей активированным углем.
Фильтр с воронкой, через который отфильтровывалась смесь угля с фуксином, аккуратно переносят в пустую пробирку и пропускают через него 2–3 мл этилового спирта. Спирт окрасился. Таким образом, фуксин сохранился на поверхности угля, откуда и был извлечен подходящим растворителем; произошла десорбция фуксина. Для каждой концентрации адсорбата (при данной температуре) существует адсорбционное равновесие: адсорбция десорбция.
Опыт 2. Избирательная адсорбция
А. В две пробирки наливают соответственно по 3 мл метиленового синего. В первую пробирку вводят 10 капель 2Н раствора НС1, а во вторую – 10 капель 2Н раствора NaOH. В пробирки вносят по таблетке активированного угля (0,25 г). Содержимое пробирок взбалтывают в течение 3–5 мин. Смеси фильтруют через бумажный фильтр. Метиленовый синий сорбируется в щелочной среде и не сорбируется в кислой.
Б. Избирательность адсорбции можно проследить на адсорбции кислых и основных красок каолином (белой глиной). Для этого в пробирки соответственно наливают по 3 мл разбавленных растворов эозина и метиленового синего. В каждую пробирку вносят по 0,5 г каолина, тщательно взбалтывают и фильтруют. Эозин не адсорбируется каолином, а метиленовый синий – адсорбируется.
28
В. Наблюдение избирательной адсорбции по окрашиванию шерсти в разных средах. В три пробирки наливают соответственно по 3 мл 0,05 %-ного раствора метиленового синего, только во вторую прибавляют 10 капель 2Н раствора НС1, а в третью – 10 капель 2Н раствора NaOH. В каждую пробирку вносят по несколько белых шерстяных ниток, оставляют их на 10–20 мин при комнатной температуре, а затем нити тщательно отполаскивают в воде. Шерсть интенсивно окрашивается в щелочной среде, слабо – в нейтральной, не окрашивается – в кислой. Что происходит с шерстью в пробирках?
Опыт 3. Адсорбция ионов из раствора углем
В две пробирки наливают по 3 мл 0,05 %-ного раствора нитрата свинца. В первую пробирку добавляют 3 мл раствора К2Сг207. В результате обменного взаимодействия образуется объемистый осадок РЬСг04. Во вторую пробирку вносят 1 таблетку (0,25 г) активированного угля, взбалтывают в течение 3–5 мин, затем фильтруют в чистую пробирку. При добавлении к фильтрату 3 мл раствора К2Сг207 осадок не образуется. Следовательно, вследствие адсорбции углем ионов свинца в растворе практически нет.
После окончания опытов опишите визуальные наблюдения. Укажите причину того или иного явления.
Вопросы и задания для самоконтроля
1.Как обычные угли превратить в активные?
2.Почему эозин не адсорбируется, а метиленовый синий адсорбируется каолином?
3.Почему фуксин адсорбируется из водного раствора и не адсорбируется из спиртового раствора?
4.Рассмотрите строение молекул растворителя. Попытайтесь объяснить, почему осуществляется окрашивание шерсти в щелочном и нейтральном растворах красителей, в то время как в кислых растворах шерсть не окрашивается?
5.Рассмотрите строение молекул красителя и белка. Как можно объяснить изменение окраски вещей при стирке («линьку»)? Как стирать вещи, чтобы они не линяли?
29
ЛАБОРАТОРНАЯ РАБОТА № 6 ОПРЕДЕЛЕНИЕ РАЗМЕРА ЧАСТИЦ «БЕЛОГО ЗОЛЯ» КАНИФОЛИ
Цель работы: определить размер частиц белого золя канифоли. Теоретические сведения. Прохождение света через дисперсные системы
сопровождается такими явлениями, как преломление, поглощение, отражение и рассеяние. Преобладание какого-то из этих явлений зависит главным образом от соотношения длины волны падающего света и размера частиц дисперсной фазы.
В грубодисперсных системах размер частиц превышает длину видимой части спектра. Это приводит к отражению света от поверхности частиц. В высокодисперсных золях размер частицы соизмерим с длиной волны видимого света. В результате чего имеет место светорассеяние. При прохождении светового потока через такие системы огибают частицы дисперсной фазы, рассеиваясь при этом во всех направлениях.
Интенсивность рассеянного света Ip определяется по уравнению Д. Релея
Ip K |
V2 |
I |
0, |
(6.1) |
|
4 |
|||||
|
|
|
|
где I0 – интенсивности падающего света;
K – константа для данной системы, зависящая от природы дисперсной фазы и дисперсионной среды;
V – объем частицы;
λ– длина волны падающего света;
– число частиц в единице объема (частичная концентрация).
Для золей, не поглощающих свет в видимой области спектра, интенсивность света, прошедшего через дисперсную систему, определяется разностью
I I0 Ip , |
(6.2) |
гдеI– интенсивность,прошедшегочерезсистемусвета.
Такие системы не имеют окраски и получили название «белые золи». Измерение интенсивности прошедшего через золь света (I) лежит в осно-
ве турбидиметрического метода исследования дисперсных систем. Измерительным прибором в турбидиметрическом методе является фотоэлектроколориметр (ФЭК), позволяющий непосредственно сопоставлять интенсивность падающего (I0) и прошедшего (I) световых потоков.
При прохождении света через дисперсную систему уменьшение интенсивности светового потока характеризуется оптической плотностью D:
D lg( |
I0 |
). |
(6.3) |
|
|||
|
I |
|
|
Исходя из уравнения (6.1), в высокодисперсных золях интенсивность рассеянного света обратно пропорциональна длине волны падающего света в четвертой степени. Однако с увеличением размеров частиц эта зависимость не соблюдается и интенсивность рассеянного света становится обратно пропорциональной длине волны в степени меньше, чем четвертая.
30
