
588_Gulaja_E._V._Fiziko-khimija_nanomaterialov_
.pdfПолная работа, затрачиваемая на диспергирование, выражается уравнением Ребиндера:
W Wдеф Wп k V S. |
(2.4) |
|
При дроблении материалы разрушаются по местам прочностных дефектов (трещин). Поэтому при измельчении прочность частиц возрастает, что используется для получения более прочных материалов.
Конденсационные методы
Конденсационные методы основаны на ассоциации молекул в агрегаты из истинных растворов (гомогенных сред). Путем конденсации в зависимости от условий могут быть получены системы любой дисперсности, с частицами любого размера. Их в основном используют для получения дисперсных систем с размерами частиц 10–8–10–9 м (высокодисперсные и ультрадисперсные), поэтому эти методы широко используют в нанотехнологиях. Конденсационные методы не требуют затраты внешней работы. Появление новой фазы происходит при пересыщении среды, т. е. создании концентраций, превышающих равновесные.
Стадии механизма конденсации:
1)стадия зародышеобразования – возникновение зародышей (центров кристаллизации) в пересыщенном растворе; зародыши образуются тем легче, чем больше в растворе центров зародышеобразования (чужеродных частиц);
2)стадия роста зародышей;
3)стадия формирования слоя стабилизатора (слоя противоионов), определяющего устойчивость полученной дисперсной системы (для дисперсных систем с жидкой дисперсионной средой).
Правила получения дисперсных систем конденсационными методами:
–чем больше степень пересыщения, тем меньше радиус зародыша, тем легче образуются зародыши вещества;
–для получения мелких частиц необходимо, чтобы скорость образова-
ния зародышей была больше скорости их роста: wобр.зар wрост.зар. Пересыщение можно вызвать физическим процессом или проведением
химической реакции. Различают физические и химические конденсационные методы.
Физические конденсационные методы
1.Метод конденсации из паров – образование тумана в газовой фазе при понижении температуры. Применяют при производстве серной и фосфорной кислот, в ректификационных аппаратах (перегонка летучих смесей). В природе
–образование тумана, облаков.
2.Метод замены растворителя – раствор данного вещества при постоянном перемешивании приливают к жидкости, в которой это вещество практически не растворимо, возникающее при этом пересыщение приводит к образованию дисперсных частиц. Так получают гидрозоли серы, холестерина, канифоли и др.
11
Химические конденсационные методы
Методы основаны на образовании новой фазы (малорастворимого соединения) в результате протекания химических реакций. Любая химическая реакция, протекающая с образованием новой фазы, может быть источником получения коллоидной системы.
Для получения высокодисперсных золей концентрированный раствор одного компонента добавляют к разбавленному раствору другого компонента при постоянном перемешивании.
Примеры химических реакций, используемых для образования коллоидных систем.
Реакции восстановления (получение золей Au, Ag, Pt и других металлов). Восстановление аурата калия формальдегидом:
2NaAuO2 3HCOH Na2CO3 2Au 3HCOONa NaHCO3 H2O. |
(2.5) |
В результате получается золь золота, стабилизированный ауратом калия. |
|
Строение мицеллы этого золя можно представить: |
|
m Au nAuO2 (n x)Na x xNa . |
|
Реакции обмена |
|
Метод, наиболее часто встречающийся на практике. |
|
Получение золя иодида серебра: |
(2.6) |
AgNO3 KJ(изб) AgJ KNO3 . |
|
Строение мицеллы: |
|
m AgJ nJ (n x)K x xK . |
|
Реакции окисления |
|
Образование золя серы: |
(2.7) |
2H2S O2 2S 2H2O. |
|
Строение мицеллы: |
|
m S nHS (n x)H x xH . |
|
Реакции гидролиза (широко применяются для получения золей гидрокси- |
|
дов металлов). |
|
Получение золя гидроксида железа: |
(2.8) |
FeCl3(изб) 3H2O Fe(OH)3 3HCl. |
|
Строение мицеллы:
m Fe(OH)3 nFe3 3(n x)Cl 3x 3xCl .
3. Метод пептизации – метод, основанный на переводе в коллоидный раствор осадков, первичные размеры которых уже имеют размеры высокодисперсных систем.
12
Суть метода: свежевыпавший рыхлый осадок переводят в золь путем обработки пептизаторами (растворами электролитов, поверхностно-активных веществ, растворителем).
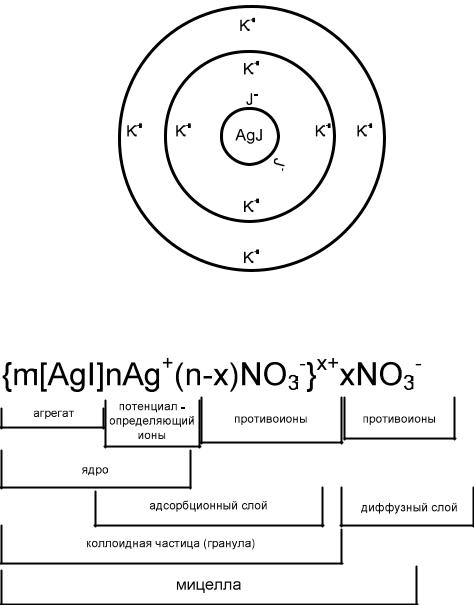
Строение коллоидных мицелл
Коллоидные системы состоят из дисперсной фазы и дисперсионной среды. Частицу дисперсной фазы вместе с двойным электрическим слоем называют мицеллой.
Мицелла – сложное структурное образование, состоящее из агрегата, потенциалопределяющих ионов и противоионов.
Внутреннюю часть мицеллы составляет агрегат основного вещества. Как правило, агрегат состоит из большого числа молекул или атомов кристаллического или аморфного строения. Агрегат электронейтрален, но обладает большой адсорбционной способностью и способен адсорбировать на своей поверхности ионы из раствора – потенциалопределяющие ионы (ПОИ).
При выборе потенциалопределяющих ионов пользуются эмпирическим правилом Фаянса–Панета–Пескова: «На твердой поверхности агрегата в первую очередь адсорбируются ионы, которые:
–входят в состав агрегата;
–способны достраивать кристаллическую решетку агрегата;
–образуют малорастворимое соединение с ионами агрегата;
–изоморфны с ионами агрегата».
Агрегат вместе с потенциалопределяющими ионами составляет ядро мицеллы. Ядро мицеллы, обладающее большим зарядом, притягивает ионы противоположного заряда – противоионы (ПИ) из раствора.
Часть противоионов находится в непосредственной близости от ядра, прочно связана с ним за счет адсорбционных и электростатических сил, и образует плотную часть двойного электрического слоя (адсорбционный слой).
Ядро с противоионами плотной части двойного электрического слоя образуют гранулу или коллоидную частицу. Знак заряда коллоидной частицы определяется знаком заряда потенциалопределяющих ионов.
Коллоидную частицу (гранулу) окружают противоионы диффузного слоя – остальная часть противоионов, подвергающихся броуновскому движению и менее прочно связанная с ядром. Вцелом образуется мицелла. Мицелла в отличие от коллоидной частицы электронейтральна.
Рассмотрим строение мицеллы при образовании коллоидного раствора – золя иодида серебра методом химической конденсации при небольшом избытке нитрата серебра:
AgNO3(изб.) KI AgI KNO3 . |
(2.9) |
13
- |
J |
|
-J
J -
Рис. 2.1. Схематическое строение мицеллы золя иодида серебра
Формула мицеллы запишется:
где m – количество молекул или атомов, образующих агрегат;
n – число потенциалопределяющих ионов, адсорбированных на поверхности агрегата;
(n – x) – число противоионов в плотной части двойного электрического слоя (адсорбционный слой);
x – число противоионов в диффузной части двойного электрического
слоя;
x – заряд коллоидной частицы (гранулы).
При образовании золя иодида серебра, при небольшом избытке иодида калия:
AgNO3 KI(изб.) Ag KNO3. |
(2.10) |
Образуется мицелла следующего состава:
m AgI nI (n x)K x xK .
Заряд коллоидной частицы в этом случае будет отрицательным.
14
Формулы мицелл золей носят только качественный характер, они позволяют судить о структуре поверхностных слоев, но не пригодны для количественной характеристики состава мицелл. Существование мицелл в дисперсных системах приводит к тому, что состав дисперсионной среды вдали и вблизи частиц различается. Если, например, диффузный слой содержит ионы H+, то при фильтровании суспензий эти ионы уходят вместе с частицами. В результате возникает повышенная концентрация ионов H+ в осадке по сравнению с фильтратом. Это явление получило название суспензионного эффекта.
Экспериментальная часть
Опыт 1. Получение коллоидного раствора серебра восстановлением его из соли серебра
Налить в пробирку до половины ее объема 0,01 н раствора нитрата серебра, добавить 1–2 капли свежеприготовленного 1 %-ного раствора таннина в качестве восстановителя. Применяемый в этом опыте таннин представляет собой сложное органическое вещество, эмпирическая формула которого С76Н52О46.
Раствор доводят до кипения и приливают 5–10 капель 1 %-ного раствора соды Na2CO3. Отметить цвет полученного коллоидного раствора серебра. Полученный в результате реакции восстановления золь металлического серебра содержит в качестве стабилизатора комплексное соединение Na[Ag(OH)2]:
AgNO3 Na2CO3 H2O Na Ag(OH)2 NaNO3 CO2 .
Строение коллоидной мицеллы имеет следующий вид:
(mAg) nAg(OH)2 xNa (n x)(n x)Na .
Опыт 2. Получение золя гидроксида алюминия при гидролизе соли алюминия (метод химической конденсации)
Вскипятите 50 мл воды и прилейте 1–2 мл 6 %-ного раствора сульфата алюминия AI2(S04)3.
В условиях высокой температуры и высокой концентрации воды происходит процесс гидролиза:
Al2 (SO4 )3 6H2O 2Al(OH)3 3H2SO4 .
В результате чего образуется коллоидный раствор.
Учитывая, что процесс гидролиза обратим и часть сульфата алюминия остается в растворе, указать те ионы, которые должны адсорбироваться на поверхности агрегата коллоидной частицы. Написать состав мицеллы гидроксида алюминия. Каков знак заряда ее гранулы?
Опыт 3. Получение золя йодистого серебра реакцией ионного обмена
Возьмите 2 мл 0,01 н раствора азотнокислого серебра и добавьте по каплям 0,5 мл 0,01 н раствора йодистого калия. Образуется соль йодистого серебра с положительно заряженными частицами.
15
В другую пробирку налить 5 мл раствора йодистого калия и по каплям из бюретки 1 мл раствора азотнокислого серебра. Образуется золь с отрицательно заряженными частицами.
Напишите уравнение реакции получения йодистого серебра и строение мицелл в обоих случаях.
Опыт 4. Получение золя берлинской лазури методом пептизации
Метод пептизации заключается в переводе в коллоидный раствор осадков, первичные частицы которых уже имели коллоидные размеры.
В пробирку внести 10 капель 0,5 мл 20 %-ного раствора желтой кровяной соли K4[Fe(CN)6] и прибавить 3 капли насыщенного раствора FeCl3. Выпавший осадок берлинской лазури перенесите на воронку с фильтром, промойте водой. После удаления промывных вод вылейте на фильтр 0,1 н раствор щавелевой кислоты. Осадок быстро пептизуется и через фильтр проходит синий золь берлинской лазури.
Напишите уравнение обменной реакции образования синего осадка берлинской лазури и схему строения мицеллы золя берлинской лазури, учитывая, что в реакции используется избыток хлорида железа (III). Каков заряд коллоидной частицы золя Fe4 [Fe(CN)6]?
Опыт 5. Получение золя канифоля
Налейте в пробирку 10 мл дистиллированной воды, добавьте в нее несколько капель 5 %-ного спиртового раствора канифоли. Полученный раствор профильтруйте через бумажный фильтр. Образуется белый опалесцирующий золь канифоли. Укажите каким способом получен золь канифоли,
Вопросы и задания для самоконтроля
1.Что такое коллоидная мицелла?
2.Каково строение коллоидных мицелл?
3.Назовите принципы построения коллоидной мицеллы.
4.Приведите примеры мицелл гидрофобных золей в природе.
16
ЛАБОРАТОРНАЯ РАБОТА № 3 СВОЙСТВА КОЛЛОИДНЫХ РАСТВОРОВ
Цель работы: на практике изучить свойства коллоидных растворов. Теоретические сведения. Все дисперсные системы условно делятся на
лиофильные – получаемые самопроизвольным диспергированием и термодинамически устойчивые – и лиофобные дисперсные системы – термодинамические неустойчивые. Несмотря на термодинамическую неустойчивость (ΔG > 0), многие лиофобные дисперсные системы оказываются устойчивыми кинетически, не изменяясь заметно с течение некоторого времени (иногда десятилетиями). Рассмотрим причины такого поведения лиофобных дисперсных систем.
Устойчивость дисперсной системы – неизменность во времени ее ос-
новных параметров: дисперсности и равновесного распределения дисперсной фазы в дисперсионной среде.
Проблема устойчивости дисперсных систем является одной из важнейших в коллоидной химии. В одних случаях необходимо обеспечить предельно высокую устойчивость дисперсных систем (при получении аэрозольных препаратов, связующих материалов), в других – разрушить дисперсную систему (получение осадков, ликвидация кислотных туманов, очистка сточных вод). Устойчивость является проблемой «жизни и смерти» дисперсной системы и она должна быть управляемой.
Различают два вида устойчивости (по Пескову): агрегативную и седиментационную (кинетическую).
1.Агрегативная устойчивость – способность частиц дисперсной фазы оказывать сопротивление их слипанию и тем самым удерживать определенную степень дисперсности (способность сохранять размер дисперсной фазы).
Решающим фактором в агрегативной устойчивости дисперсной системы является степень дисперсности частиц дисперсной фазы: чем она выше (чем меньше размер частиц), чем больше энергия их броуновского движения, тем выше агрегативная устойчивость. При нарушении агрегативной устойчивости происходит нарушение седиментационной устойчивости.
2.Седиментационная устойчивость – устойчивость дисперсной фазы по отношению к силе тяжести (способность дисперсной системы сохранять равномерное распределение частиц дисперсной фазы по объему дисперсионной среды).
Нарушение седиментационной устойчивости может быть вызвано оседанием (седиментацией) частиц под действием их силы тяжести, приводящей к оседанию (или всплыванию) частиц дисперсной фазы. Это особенно характерно для грубодисперсных систем.
Наблюдаемая долговечность многих лиофобных систем говорит о том, что наряду с Ван-дер-Ваальсовыми силами притяжения между частицами в системе существуют и силы отталкивания или эффекты, экранирующие это притяжение.
17
Рассмотрим факторы, вызывающие устойчивость лиофобных систем:
–электростатический фактор связан с адсорбцией ионов на поверхности частиц и образование ДЭС, что приводит к взаимному отталкиванию частиц. Этот фактор усиливается с ростом потенциала поверхности и толщины ДЭС и характерен для систем с полярными дисперсионными средами. Образование ДЭС приводит не только к появлению зарядов на поверхности частиц, но и снижению при этом поверхностного натяжения на границе раздела фаз, что способствует стабилизации системы;
–адсорбционно-сольватный фактор связан с существованием особых слоев жидкости (сольватных оболочек) вокруг всякой коллоидной частицы, которые препятствуют сближению частиц. Проявляется этот фактор в основном в лиофильных дисперсных системах. Лиофильные системы тем более устойчивы, чем сильнее развиты сольватные оболочки.
–энтропийный фактор связан со стремлением частиц дисперсной фазы к равномерному распределению по объему дисперсионной среды и таким образом удалиться друг от друга. При этом снижается вероятность столкновения частиц, а следовательно, и их агрегация.
–структурно-механический фактор заключается в образовании механически прочных адсорбционных слоев, мешающих слипанию частиц при их сближении. Эти слои образуются при адсорбции длинноцепочечных ПАВ и ВМС.
При нарушении агрегативной устойчивости дисперсной системы происходит слипание частиц – коагуляция.
Коагуляция – агрегация частиц дисперсной фазы с последующим выпадением их в осадок. Коагуляция включает в себя все процессы, идущие в результате потери системой агрегативной устойчивости. Она может закончиться как разрушением системы, так и образованием в ней структур (структурообразованием).
Стадии коагуляции
Во всяком процессе коагуляции различают две стадии:
Скрытая коагуляция – невооруженным глазом нельзя наблюдать какихлибо внешних признаков происходящих изменений в золе.
Явная коагуляция – о коагуляции можно судить невооруженным глазом: по помутнению, по выпадению осадка, по изменению цвета.
Для лиофобных золей характерно то, что стадия скрытой коагуляции очень коротка и быстро переходит в стадию явной коагуляции.
В качестве меры агрегативной устойчивости дисперсной системы можно рассматривать скорость ее коагуляции.
Скорость коагуляции – изменение частичной концентрации дисперсных частиц в единице объема в единицу времени.
Скорость коагуляции может быть самой разной в различных системах (от нескольких секунд до нескольких лет). Система тем более устойчива, чем медленнее она коагулирует.
18
Различают: быструю коагуляцию, при которой каждое столкновение частиц приводит к их слипанию (все соударения эффективны); и медленную коагуляцию, когда не все столкновения частиц являются эффективными.
Теория кинетики быстрой коагуляции однородных сферических частиц была разработана польским ученым М. Смолуховским в 1916 г.
ОсновныеположениятеориибыстройкоагуляцииСмолуховского:
–частицы дисперсной фазы сближаются в результате броуновского движения, слипаются, образуют агрегат, который совершает дальнейшее броуновское движение как единое целое;
–скорость сближения частиц определяется коэффициентом диффузии и средним расстоянием между частицами;
–в каждом элементарном акте участвуют только две частицы дисперсной
фазы;
–все частицы имеют одинаковый размер и обладают одинаковой подвижностью, форму частиц считают сферической.
Представления Смолуховского объясняют коагуляцию монодисперсных золей. Теория коагуляции полидисперсных золей была разработана Мюллером. Мюллер показал, что частицы различных размеров коагулируются быстрее, чем частицы одинаковых размеров. При этом «большие» частицы играют роль центров коагуляции – коагуляция преимущественно происходит при столкновении малых частиц с большими. Таким образом, чем больше больших частиц, тем выше скорость коагуляции. Теория Мюллера объясняет автокаталитический характер коагуляции, скорость которой может постепенно возрастать со временем. Мюллер показал, что скорость коагуляции возрастает, если частицы имеют удлиненную форму. В этом случае на поступательное движение частиц дисперсной фазы накладывается еще и вращательное движение, увеличивающее вероятность столкновения частиц.
Экспериментальная часть
Опыт 1. Коагуляция золя гидроксида железа (III) электролитами
В стакан налейте 40 мл кипящей воды и добавьте 2–3 мл 2 % -ного раствора хлорида железа . Наблюдайте образование красно-коричневого золя гидроксида железа. Полученный золь сохраните для последующих опытов. Налейте в три пробирки по 2 мл полученного золя и по каплям прибавьте до появления мути или осадка:
–в первую пробирку − 0.1 н раствора NaCI;
–во вторую пробирку − 0.1 н раствора Na2SO4;
–в третью пробирку − 0.1 н раствора Na2HPO4.
Запишите в табл. 3.1 количество капель, которые нужно добавить, чтобы вызвать коагуляцию золя Fe(OH)3.
19
Табл. 3.1. Экспериментально полученные результаты
Объем воды, мл |
Электролит |
Количество |
|
капель |
|||
|
|
||
2 |
NaCI |
|
|
2 |
Na2SO4 |
|
|
2 |
Na2HPO4 |
|
Ответьте на вопросы: в каких случаях катионы или анионы вызывают коагуляцию золя? Какой заряд имеет коллоидная частица золя?
Напишите строение мицеллы золя гидроксида железа.
Как влияет величина заряда и радиус анионов на их коагулирующую способность (rCI- < rSO4-2 ; < rHPO4-2) где r – радиус иона?
Опыт 2. Очистка воды коагуляцией
Возьмите четыре чистых пробирки, в каждую из которых налейте по 5 мл мутной воды, содержащей взвешенные частички глины, и прилейте различное количество золя гидроксида железа, полученного в предыдущем опыте: в первую пробирку – 2 мл, во вторую – 4 мл, в третью – 6 мл. В четвертой пробирке вода без золя служит для контроля измерений.
Содержимое пробирок перемешайте и оставьте стоять некоторое время. Наблюдайте, в какой пробирке быстрее происходить очистка воды. Сделайте вывод на основании опыта.
Опыт 3. Защита золя гидроксида железа
В две пробирки налейте по 5 мл коллоидного раствора гидроксида железа, полученного в первом опыте. В одну пробирку добавьте 2–3 капли 0.1 % -ного раствора желатина. Затем в обе пробирки добавьте по 3–5 капель 0.1 н раствора сульфата натрия и перемешайте содержимое каждой пробирки.
Ответьте на вопрос: почему раствор, к которому был добавлен желатин, не помутнел, а появилась только слабая опалесценция?
Опыт 4. Определение знака заряда коллоидной частицы методом капиллярного анализа
Определите знак заряда золя гидроксида железа (полученного в первом опыте).
На фильтровальную бумагу нанесите каплю исследуемого золя и каплю метилоранжа. Далее нанесите на бумагу каплями лакмус и фуксин. Объясните, почемув однихслучаях пятно окрашено равномерно, а в другихтолько в центре?
Вопросы и задания для самоконтроля
1.Перечислите свойства дисперсных растворов.
2.Что такое устойчивость дисперсных растворов и от чего она зависит?
3.Какой процесс называют коагуляцией?
4.Приведите примеры коагуляции в природе.
20
