
- •Ферменты.
- •Основные вопросы лекции:
- •Активаторы – вещества, повышающие ферментативную активность
- •Ингибиторы способны взаимодействовать с ферментами с разной степенью прочности.
- •Механизмы действия ингибиторов
- •Антивитамины - соединения, конкурирующие с витаминами в биохимических процессах или выключающие
- •Антивитамины как лекарственные препараты
- •Некоторые антивитамины (антиметаболиты) — это цитостатические противоопухолевые
- •Ингибиторы,
- •Конкурентное ингибирование основано на связывании ингибитора с субстратсвязывающим
- •Ингибиторы ацетилхолинэстеразы (АХЭ)
- •Лекарственные препараты как обратимые конкурентные ингибиторы ферментов.
- •Фосфорорганические ингибиторы АХЭ приводят к необратимому ингибированию фермента
- •Стратегия применения лекарственных препаратов, действующих как конкурентные ингибиторы ферментов:
- •Неконкурентные ингибиторы не являются структурными аналогами S.
- •Коррекция ферментативной активности реактиваторами при действии тиоловых ядов.
- •Бесконкурентое ингибирование ферментов.
- •Регуляция каталитической активности ферментов.
- •Помимо активного центра, в молекуле фермента может присутствовать также аллостерический центр (центры)
- •Особенности строения и функционирования аллостерических ферментов.
- •Действие аллостерических активаторов.
- •Действие аллостерических ингибиторов.
- •Локализация аллостерических ферментов в метаболических процессах.
- •Последствия нарушения аллостерической регуляции
- •Регуляция активности липазы путем фосфорилирования - дефосфорилирования фермента.
- •Ассоциация - диссоциация протомеров. Протеинкиназа.
- •Адреналин вырабатывается клетками мозгового вещества надпочечников.
- •Регуляция активности путем частичного протеолиза. Проферменты.
- •Регуляция путем изменения биосинтеза ферментов
- •Лактозный оперон Е. coli, состоящий из трех структурных генов, промотора и оператора, был
- •Регуляция путем изменения биосинтеза ферментов
- •Примеры индукции ферментов:
- •Мультиферментные комплексы.
- •Компартментализация ферментов в клетке – это пространственное разделение метаболических процессов.
- •Энзимодиагностика.
- •Аминотрансферазы
- •Локализация аминотрансфераз в клетке.
- •Иммобилизованные ферменты -
- •Применение
- •Энзимодиагностика - постановке диагноза заболевания (или синдрома) на
- •Энзимопатии - это заболевания, обусловленные нарушением в организме регуляции активности ферментов, количества ферментов,
- •Первичные (врожденные) энзимопатии.
- •Фенилкетонурия (ФКУ) -
- •Энзимотерапия – лечение с помощью ферментов, коферментов,
- •Энзимотерапия
- •Коферменты
- •Ингибиторы ферментов
- •Нобелевской премии по медицине и физиологии за 2017 год удостоились Джеффри Холл, Майкл
- •Нобелевской премия по химии за 2017 год будет вручена Жаку Дебоше, Иоахиму Франку
- •Благодарю за внимание.

Ферменты.
Виды и значение регуляции активности ферментов. Аллостерическая регуляция. Ингибирование ферментов.
Лекция для специальности 31.05.01 Лечебное дело подготовлена доцентом кафедры общей и биологической химии ТГМУ О. А. Артюковой
2017 – 2018 учебный год

Основные вопросы лекции:
Ингибирование активности ферментов: обратимое, необратимое, конкурентное, неконкурентное.
Регуляция скоростей синтеза и распада ферментов.
Индукция и репрессия синтеза ферментов.
Компартментация ферментов.
Аллостерическая регуляция. Ингибирование по принципу обратной связи.
Ковалентная модификация ферментов: ограниченный протеолиз проферментов, фосфорилирование и дефосфорилирование.
Органоспецифические ферменты.
Энзимодиагностика и энзимотерапия.
Белковые ингибиторы ферментов.
Ингибиторы ферментов как лекарственные препараты.
Наследственные энзимопатии.
Активаторы – вещества, повышающие ферментативную активность
Действие
активаторов
Участвуют в |
Облегчают |
Восстанавливают |
Стабилизируют |
|
формировании |
SH-группы |
нативную |
||
образование |
||||
активного |
в активном |
структуру |
||
ES-комплекса |
||||
центра |
центре |
фермента |
||
|
Активаторы представляют собой катионы металлов (Zn, Fe, Ca, Mg и др.), реже анионы (cl, F), белки (пептиды) и др.
Примеры действия активаторов:
-желчные кислоты активируют липазу,
-энтерокиназа активирует трипсиноген,
-глутатион, цистеин, витамин С повышают активность оскидоредуктаз, -Nacl активирует амилазу слюны.

Ингибиторы способны взаимодействовать с ферментами с разной степенью прочности.
Ингибирование-
снижение активности Фермента в присутствии определенных веществ –
ингибиторов
Обратимое |
Необратимое |
|
Образуются ковалентные |
||
Ингибиторы связываются |
связи между ингибитором и Е. |
|
с E слабыми связями и |
||
Чаще всего |
||
при определённых условиях |
||
модификации подвергается |
||
легко отделяются от E |
||
активный центр |
||
|
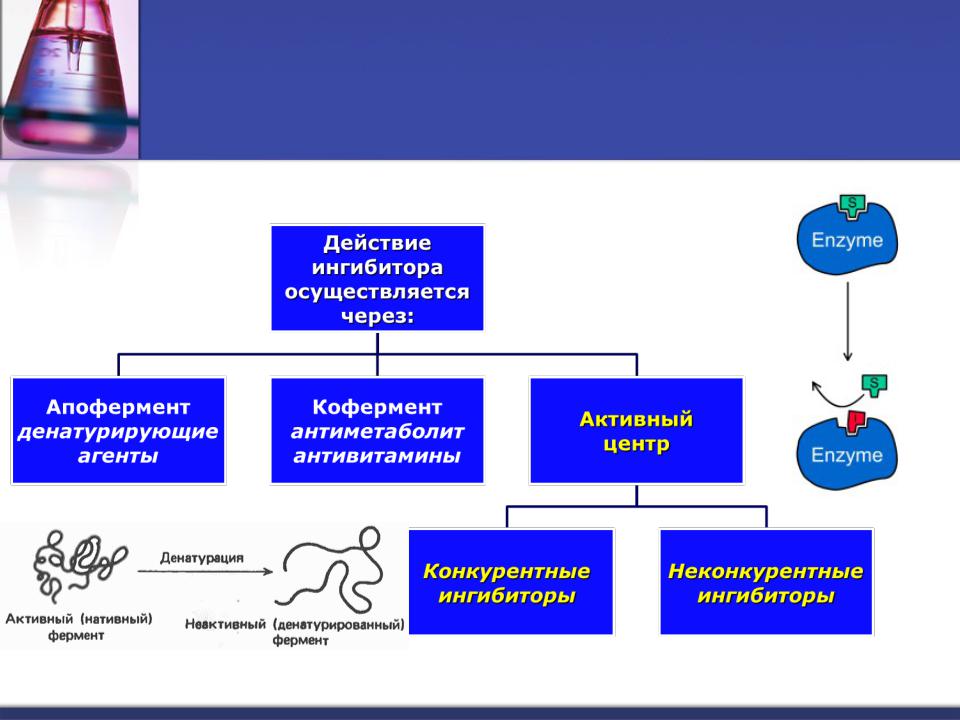
Механизмы действия ингибиторов
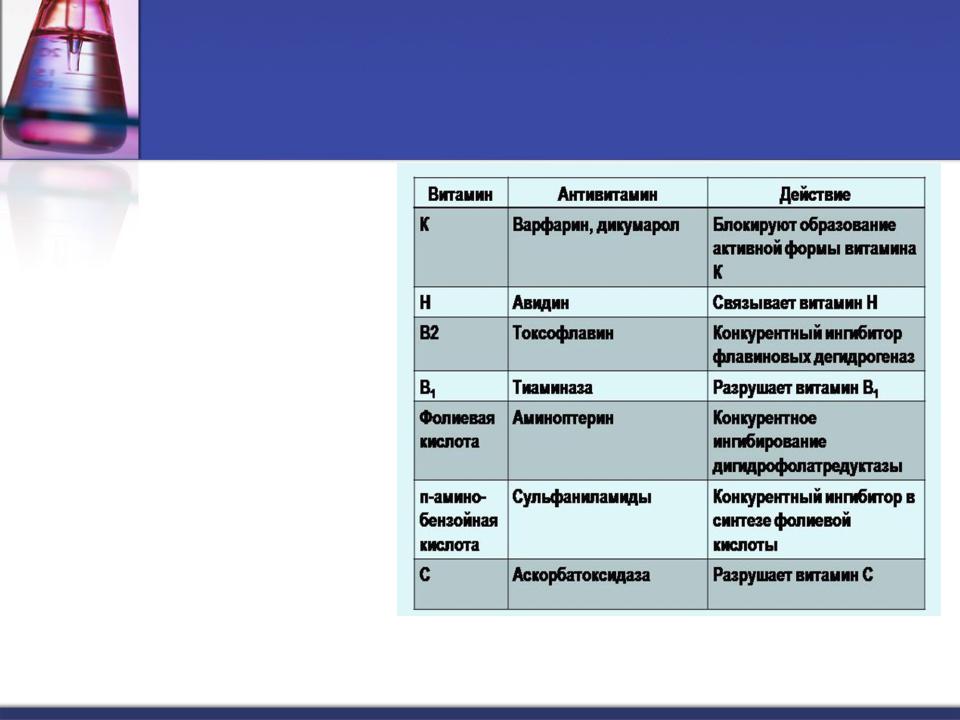
Антивитамины - соединения, конкурирующие с витаминами в биохимических процессах или выключающие
витамины из процессов путем их разрушения или связывания.
Антивитамины принято делить на 2 группы:
1)антивитамины, имеющие структуру, сходную с витамином, и оказывающие действие, основанное на конкуренции с ним;
2)антивитамины, вызывающие модификацию химической структуры витаминов, затрудняющие их всасывание, транспорт и др.
Вкачестве ингибиторов ферментов в медицинской практике используют вещества, называемые антиметаболитами (антивитамины).
Антивитамины как лекарственные препараты
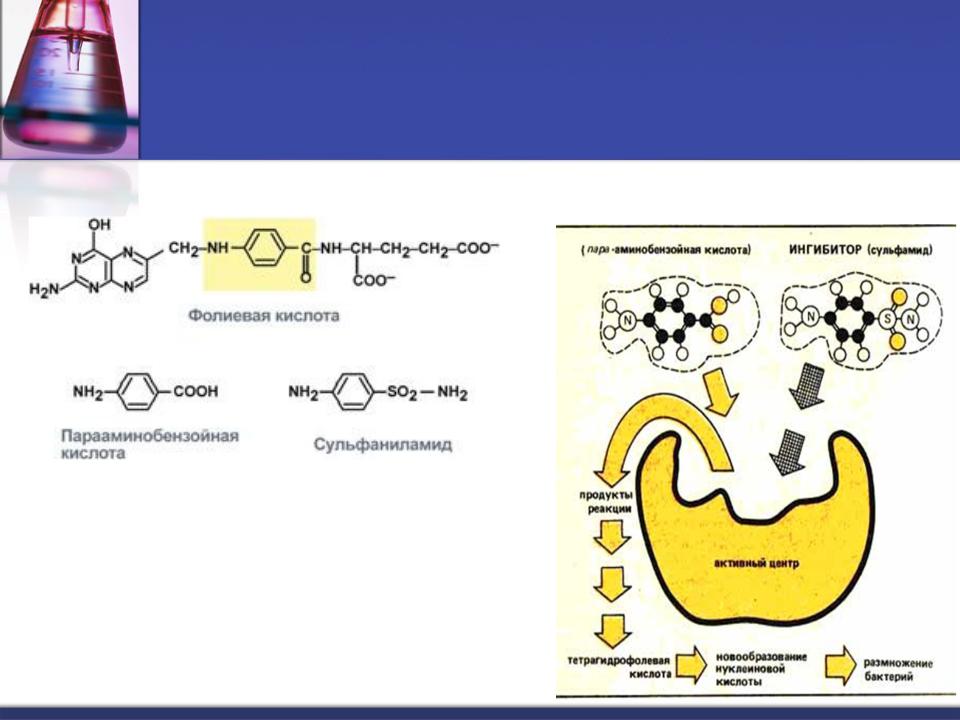
Структурные аналоги витамина (фолиевая кислота, В9)
В качестве бактериостатических лекарственных препаратов используют сульфаниламидные препараты, применяемые для лечения инфекционных заболеваний.

Некоторые антивитамины (антиметаболиты) — это цитостатические противоопухолевые
химиотерапевтические лекарственные препараты, чей механизм действия основан на ингибировании (конкурентном антагонизме)
определённых биохимических процессов, критически необходимых для размножения опухолевых клеток, т. е. для процесса деления, митоза, репликации ДНК.
Ингибирование процесса деления клеток |
приводит к запуску |
процесса апоптоза, |
а на макроуровне — |
к некрозу опухоли и |
|
ремиссии онкологического заболевания. |
|
Метотрексат – аналог фолиевой кислоты (вит. В9)

Ингибиторы,
действующие на
активный центр
Конкурентный |
|
ингибитор |
Неконкурентный |
сходен по структуре |
ингибитор |
с S, конкурирует за |
не похож на S, |
связывание в |
не конкурирует за |
активном центре |
активный центр |
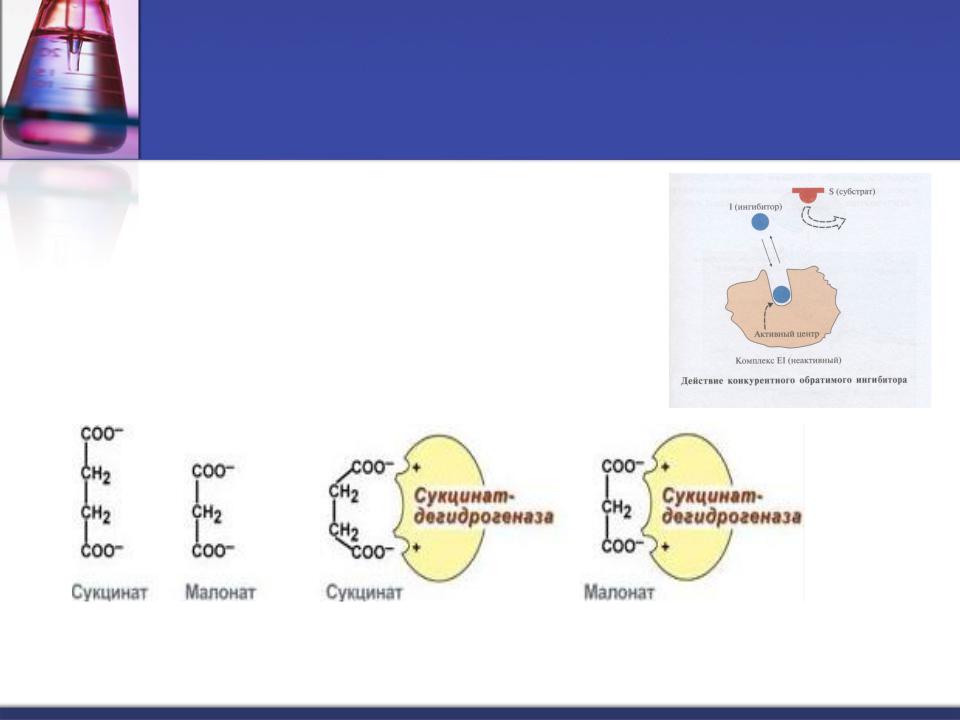
Конкурентное ингибирование основано на связывании ингибитора с субстратсвязывающим
(активным) центром.
Конкурентное ингибирование может быть вызвано веществами, имеющими структуру, похожую на структуру субстрата, но несколько отличающуюся от структуры истинного субстрата.
Ингибирование сукцинатдегидрогеназы малоновой кислотой, структура которой схожа со структурой субстрата этого фермента – янтарной кислоты (сукцината).
