
- •Часть 1
- •Поступательного движения:
- •Вращательного движения:
- •Вращательного движения:
- •Движениями
- •Вращательного движений
- •§ 1.3 Основы релятивистской механики
- •Гармонических колебаний
- •Одинаковой частоты
- •Раздел 2 «Молекулярная физика и термодинамика»
- •§ 2.2. Изопроцессы
- •§ 2.3. Основы термодинамики
Раздел 2 «Молекулярная физика и термодинамика»
Молекулярная физика - раздел физики, изучающий строение, физические свойства и агрегатные состояния вещества, рассматриваемого как совокупность большого количества молекул, которые взаимодействуют между собой и находятся в беспрерывном тепловом движении.
|
§ 2.1 ЗАКОНЫ ИДЕАЛЬНОГО ГАЗА |
Газ – агрегатное состояние вещества, в котором его частицы не связаны или весьма слабо связаны силами взаимодействия и движутся свободно, заполняя весь предоставленный им объем.
Идеальный газ – теоретическая модель газа, согласно которой:
1) собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда;
2) между молекулами газа отсутствуют силы взаимодействия;
3) столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
Модель идеального газа можно использовать при изучении реальных газов, т.к. они в условиях, близких к нормальным (например, кислород и гелий), а также при низких давлениях и высоких температурах близки по своим свойствам к идеальному газу.
Состояние данной массы газа полностью определено, если известны давление р, объем V, температура T. Эти величины называют параметрами состояния газа.
В природе часто имеют место процессы, когда одновременно меняются все три величины, характеризующие состояние газа.
Уравнение, связывающее параметры состояния, называют уравнение состояния (уравнение Клапейрона)- при переходе из одного состояния в другое данной массы газа произведение давления на объем, деленное на абсолютную температуру, есть величина постоянная:
![]() или
или
![]()
Для произвольной массы газа единичное состояние газа описывается уравнение Менделеева-Клапейрона:
![]() ,
,
где
m
– масса газа,
![]() - молярная масса,R
– универсальная газовая постоянная, Т
– абсолютная
температура.
- молярная масса,R
– универсальная газовая постоянная, Т
– абсолютная
температура.
Молярная
масса
![]() -величина,
равная отношению массы вещества к
количеству вещества
-величина,
равная отношению массы вещества к
количеству вещества
![]() [кг/моль]
[кг/моль]
Количество
вещества
![]() -
отношение числаN
атомов и молекул вещества к постоянной
Авогадро NA:
-
отношение числаN
атомов и молекул вещества к постоянной
Авогадро NA:
![]() [моль]
[моль]
Моль – это количество вещества, содержащее столько же частиц, сколько содержится атомов в 0,012 кг углерода 12С.
Постоянная Авогадро показывает, сколько атомов или молекул содержится в одном моле вещества:
![]() =
6,022·1023
моль-1.
=
6,022·1023
моль-1.
Физический смысл универсальной газовой постоянной R состоит в том, что она показывает, какую работу совершает один моль идеального газа при изобарном расширении при нагревании его на 1 К
![]()
Температура газа Т – величина, характеризующая среднюю кине-тическую энергию поступательного движения молекул идеального газа.
Измеряется температура термометрами в градусах различных температурных шкал:
шкала Цельсия: единица температуры – 1 градус Цельсия (ºС).
шкала Кельвина: единица температуры – Кельвин (К).
Так как 1 К = 1ºС, то при любой температуре t по Цельсию значение температуры Т, по абсолютной шкале, выше на 273 градуса:
Т=t ºC + 273.
§ 2.2. Изопроцессы
Особую роль в физике и технике играют изопроцессы, к которым относятся: изотермический, изохорный, изобарный и адиабатный.
Изопроцесс – физический процесс, при котором один из параметров исследуемого вещества поддерживается неизменным.
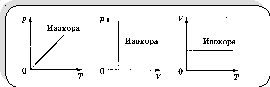
Изотермический процесс – процесс, протекающий при постоянной температуре.
Для данной массы газа при постоянной температуре произведение давления газа на его объем есть величина постоянная (закон Бойля-Мариотта ):
![]() или
или
![]()
Т=const; m =const
Изохорный процесс - процесс, протекающий при постоянном объеме.
Для данной массы газа при постоянном объеме отношение давления газа к его температуре есть величина постоянная (закон Шарля):
![]() или
или
![]()
V=const; m =const
Изобарный процесс - процесс, протекающий при постоянном давлении.
Для данной массы газа при постоянном давлении отношение объема газа к его температуре есть величина постоянная (закон Гей-Люссака):
![]() или
или
![]()
р=const; m =const

