
- •Методические указания
- •1. Растворы неэлектролитов
- •1.1.Общие положения
- •1.2. Концентрация растворов
- •1.3. Идеальные растворы
- •1.4. Растворимость жидкости в жидкостях и
- •1.5. Понижение давления насыщенного
- •1.6. Температура кристаллизации разбавленных
- •1.7. Температура кипения разбавленных растворов
- •1.8. Осмотическое давление растворов неэлектролитов
- •2. Растворы электролитов
- •2.1. Электролитическая диссоциация
- •2.2. Обменные реакции в растворах электролитов
- •2.3. Диссоциация воды. Водородный показатель
- •2.4. Гидролиз солей
- •Методические указания
- •Гоувпо «Воронежский государственный
- •394026 Воронеж, Московский просп., 14
2. Растворы электролитов
2.1. Электролитическая диссоциация
Растворы электролитов, в отличие от растворов неэлектролитов, проводят электрический ток и дают повышенные значения тех величин, которые зависят от числа частиц растворенного вещества в данном объеме раствора: осм., р, Тз, Ткип. Повышенные значения числа частиц в растворах электролитов обусловлены их распадом на ионы.
Вещества, распадающиеся на ионы и проводящие электрический ток в растворенном и расплавленном состоянии, называются электролитами, а процесс распада электролитов на ионы в среде растворителя – электролитической диссоциацией.
Отношение экспериментально найденных значений вышеуказанных величин для растворов электролитов к теоретическим, т.е. вычисленным для растворов неэлектролитов той же концентрации, называется изотоническим коэффициентом i .Формулы, выражающие законы Рауля и Вант-Гоффа, становятся применимыми к растворам электролитов после введения в них изотонического коэффициента. В этом случае учитывается фактическое число частиц в растворе, увеличенное за счет полной или частичной диссоциации молекул растворенного вещества на положительно и отрицательно заряженные ионы.
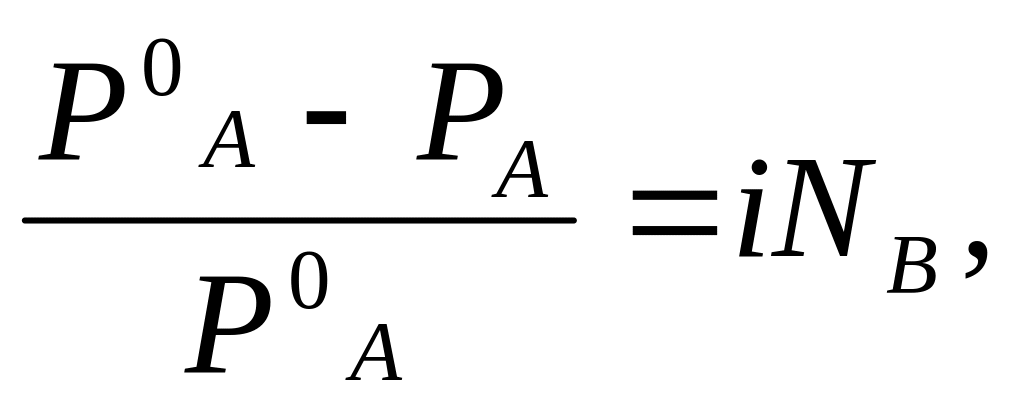
Тз = i KCm,
Tкип. = i E Cm,
осм. = i CMRT.
Для растворов электролитов i 1.
Так как в процессе электролитической диссоциации число положительных зарядов равно числу отрицательных, то раствор в целом электронейтрален. Упрощенно уравнения электролитической диссоциации можно записать так:
НСl = H+ + Cl-; Ca(OH)2 = Ca2+ + 2 OH-;
Na2CO3 = 2 Na+ + CO32-.
Электролитическая диссоциация зависит не только от типа химической связи в молекулах, но и от характера растворителя. Электролиты диссоциируют на ионы только в полярных растворителях.
Кислоты – это электролиты, при диссоциации которых в качестве катионов образуются только ионы водорода:
HNO3 = H+ + NO3-; H2SO4 = 2 H+ + SO42-.
Основания – это электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы:
NaOH = Na+ + OH-; Ba(OH)2 = Ba2+ + 2 OH-
Соли – это электролиты, образующие в водных растворах положительно заряженные ионы металла и отрицательно заряженные ионы кислотного остатка.
KNO3 = K+ + NO3-; CaCl2 = Ca2+ + 2 Cl-.
Электролиты можно разделить на две группы: сильные и слабые электролиты. Сильные электролиты в водных растворах полностью диссоциируют на ионы, и этот процесс практически необратим. Выше приведены уравнения диссоциации подобного рода электролитов. Слабые электролиты диссоциируют только частично, и в растворе устанавливается динамическое равновесие между недисоциированными молекулами и ионами.
К сильным электролитам принадлежат почти все соли. Из важнейших кислот и оснований к ним относятся HNO3, HClO4, HCl, HBr, HI, H2SO4, NaOH, KOH, Ba(OH)2, Ca(OH)2.
К слабым электролитам относится большинство органических кислот. Из важнейших неорганических соединений к ним принадлежат H2CO3, H2SO3, H2S, HCN, H2SiO3, HF, HNO2,
H3PO4 , NH4OH и все нерастворимые в воде основания.
Для количественной оценки силы электролита вводятся понятия степени диссоциации и константы диссоциации.
Степень диссоциации – это доля продиссоциировавших молекул, т.е. отношение числа молекул, распавшихся на ионы, к числу молекул растворенного вещества. Обозначается греческой буквой .
=
![]() .
.
В зависимости от степени диссоциации все электролиты условно делят на сильные ( 0,3), средней силы (0,03 0,3) и слабые ( 0,03). Степень диссоциации зависит от природы электролита, концентрации раствора и от температуры. При введении в раствор слабого электролита одноименных ионов равновесие диссоциации нарушается и смещается в направлении образования недиссоциированнных молекул т.е. степень диссоциации уменьшается. С повышением температуры степень диссоциации увеличивается.
Константа диссоциации Кд вводится для характеристики слабых электролитов. Она равна отношению произведения концентраций ионов в растворе слабого электролита к концентрации недиссоцииированных молекул. Например, для процесса диссоциации электролита КА К+ + А- выражение для Кд имеет вид:
Кд
=
![]() (2.1)
(2.1)
Константа диссоциации слабого электролита есть величина постоянная при данной температуре и не зависит от концентрации. Она характеризует способность данного электролита распадаться на ионы: чем выше Кд, тем легче электролит диссоциирует.
Многоосновные кислоты, а также основания двух- и более валентных металлов диссоциируют ступенчато. В растворах этих веществ устанавливаются сложные равновесия, в которых участвуют ионы различного заряда. Например, диссоциация угольной кислоты происходит в две ступени:
Н2СО3 Н+ + НСО3-
НСО3- Н+ + СО32-.
Первое
равновесие - диссоциация по первой
ступени – характеризуется константой
диссоциации, обозначаемой Кд![]() :
:
Кд
=
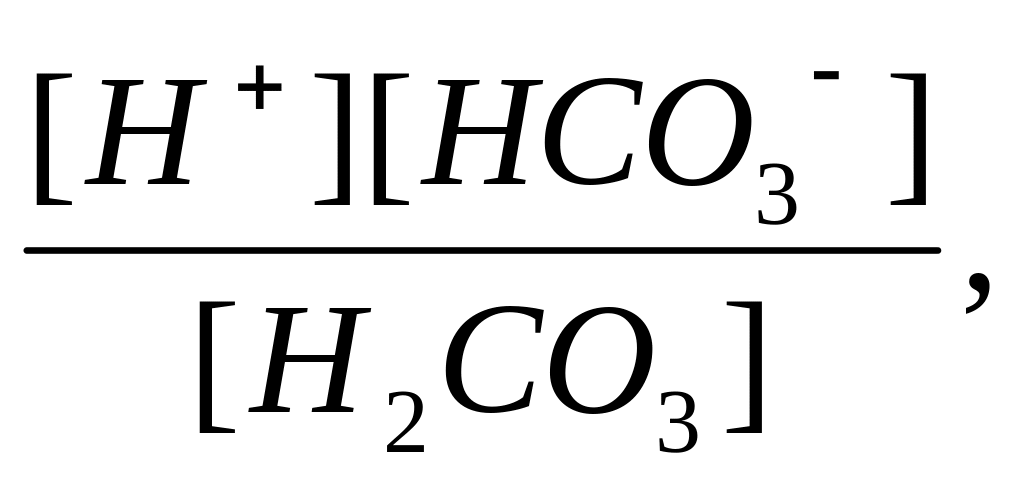
а
второе – диссоциация по второй ступени
– константой диссоциации Кд![]() :
:
Кд
=
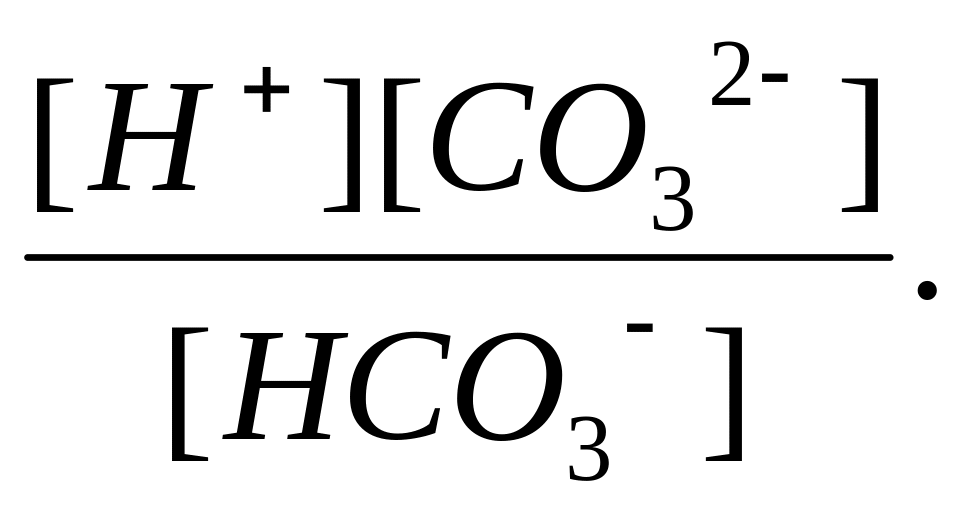
Суммарному равновесию Н2СО3 2Н+ + СО32- отвечает суммарная константа диссоциации Кд:
Кд =
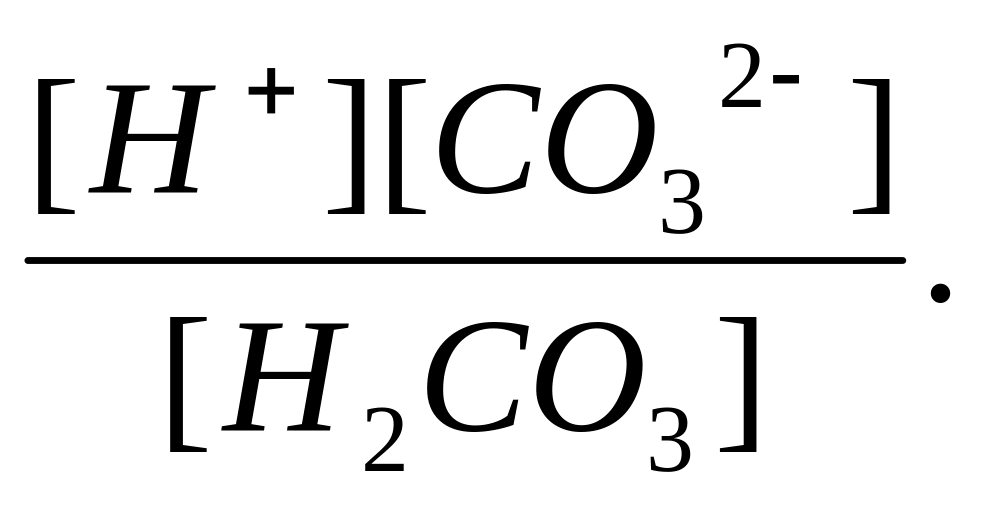
Величины Кд , Кд и Кд связаны друг с другом соотношением:
Кд = Кд Кд .
Аналогичные соотношения характеризуют и ступенчатую диссоциацию оснований многовалентных металлов. Например, двум ступеням диссоциации гидроксида железа (II)
Fe(OH)2 FeOH+ + OH-
FeOH+ Fe2+ + OH-
отвечают константы диссоциации:
Кд
=
![]() и Кд
=
и Кд
=
![]() .
.
Суммарному процессу диссоциации отвечает константа:
Кд =
![]() .
.
При этом
Кд = Кд Кд .
При ступенчатой диссоциации веществ распад по последующей ступени всегда происходит в меньшей степени, чем по предыдущей (по второй меньше, чем по первой и т. д.). Иначе говоря, соблюдается неравенство:
Кд
Кд
Кд![]()
Это объясняется тем, что энергия, которую нужно затратить для отрыва иона, минимальна при его отрыве от нейтральной молекулы и становится больше при диссоциации по каждой следующей ступени.
Если обозначить концентрацию электролита, распадающегося на два иона, через С, а степень его диссоциации в данном растворе через , то концентрация каждого из ионов будет С, а концентрация недиссоциированных молекул С(1 - ). Тогда уравнение константы диссоциации (2.1) примет вид:
Кд =
![]()
или
Кд
=
![]() .
(2.2)
.
(2.2)
Это уравнение выражает закон разбавления Оствальда. Оно дает возможность вычислять степень диссоциации при различных концентрациях электролита, если известна его константа диссоциации. Пользуясь этим уравнением, можно также вычислить константу диссоциации электролита, зная его степень диссоциации при той или иной концентрации.
Для растворов, в которых диссоциация электролита очень мала, уравнение (2.2) упрощается. Поскольку в таких случаях намного меньше единицы, то этой величиной в знаменателе можно пренебречь, и данное уравнение принимает вид:
Кд 2С
или
![]() .
(2.3)
.
(2.3)
Таблица 2.1
Константы диссоциации некоторых слабых электролитов в водных растворах при 25о С
Электролит |
Константа диссоциации |
Электролит
|
Константа диссоциации |
HNO2 |
4 10-4 |
H2CO3 |
K1 = 4,510-7 K2 = 4,710-11 |
H2SiO3 |
K1 10-10 K2 10-12 |
HF |
710-4 |
H2SO3 |
K1 = 210-2 K2 = 610-8 |
HCN |
810-10 |
H2S |
K1 = 610-8 K2 = 110-14 |
CH3COOH |
210-5 |
H3PO4 |
K1 = 810-3 K2 = 610-8 K3 = 110-12 |
NH4OH |
210-5 |
Уравнение (2.3) наглядно показывает связь между концентрацией слабого электролита и степенью его диссоциации: степень диссоциации возрастает при разбавлении раствора.
В табл. 2.1. приведены значения констант диссоциации некоторых слабых электролитов.
