- •Определение кислотно-основных свойств ионообменных материалов
- •1. Общие сведения об ионном обмене и ионитах
- •2. Основные параметры и особенности кислотно-основных равновесий в ионообменных системах
- •2.1. Ионизация катионитов и анионитов
- •2.1.1. Константа ионизации ионитов
- •2.1.2. Расчет констант ионизации ионитов
- •2.2. Факторы, влияющие на кислотно-основные свойства ионитов
- •Влияние ионной силы раствора
- •Влияние температуры
- •Влияние степени сшивания и строения матрицы
- •Влияние диэлектрической проницаемости
- •Влияние природы титранта и природы противоиона
- •Влияние других параметров
- •3. Потенциометрическое титрование ионитов
- •3.1. Особенности потенциометрического титрования ионитов
- •3.2. Способы потенциометрического титрования ионитов
- •3.3. Подготовка ионитов к титрованию
- •Подготовка катионитов
- •Подготовка анионитов
- •Приготовление раствора титранта
- •Определение полной обменной емкости ионитов
- •Определение емкости сильно- и слабоосновных анионитов
- •3.4. Примеры титрования ионитов Титрование слабоосновного анионита
- •Титрование монофункционального карбоксильного катионита
- •Титрование бифункционального фосфорнокислого катионита
- •Определение кислотно-основных свойств ионообменных материалов
- •394006, Воронеж, ул. 20-летия Октября, 84
Определение полной обменной емкости ионитов
Полную обменную емкость ионитов проводят в соответствии с ГОСТ 20255.1-89 “Иониты. Методы определения обменной емкости”.
Около 1 г испытуемого катионита (в пересчете на абсолютно сухой сорбент), взвешенного с точностью до 0,0002 г, помещают в колбу на 250 мл.
В случае испытания сильнокислотного катионита в колбу заливают 100 мл раствора NaOH (или КОН), (для слабокислотного - 200 мл), после чего колбу закрывают пробкой. Сильнокислотный катионит выдерживают 2 ч, слабокислотный - 24 ч, после чего отбирают аликвоты по 25 мл и титруют 0,1 моль/л раствором НС1 в присутствии метилоранжа или смешанного индикатора.
Полную обменную емкость сильнокислотного катионита рассчитывают по формуле:
![]() (11)
(11)
слабокислотного - по формуле:
![]() ,
(12)
,
(12)
где V1 - объем 0,1 моль/л НС1, пошедший на титрование; g - масса ионообменника.
Определение емкости сильно- и слабоосновных анионитов
Около 1 г испытуемого анионита (в пересчете на абсолютно сухой сорбент), взвешенного с точностью до 0,0002 г, помещают в колбу емкостью 250 мл. В случае сильноосновного (высокоосновного) анионита в колбу заливают 100 мл раствора НС1 (для низкоосновного - 200 мл), после чего колбу закрывают пробкой). Сильноосновный анионит выдерживают 2 ч, низкоосновный - 24 ч, после чего отбирают аликвоты по 25 мл и титруют 0,1 моль/л раствором NaOH в присутствии метилоранжа или смешанного индикатора.
Полную обменную емкость высокоосновного и низкоосновного анионитов рассчитывают по уравнениям (11, 12).
3.4. Примеры титрования ионитов Титрование слабоосновного анионита
Подготовленный низкоосновный анионит в гидроксильной форме титруют раствором 0,1 моль/л НСI методом ряда навесок. Для чего в ряд сухих колб объемом 100 мл помещают навески (по 2 г) набухшего анионита после отделения воды центрифугированием. Затем в каждую емкость вносят по 50 мл раствора 0,1 моль/л КС1. В данную суспензию дозируют раствор кислоты, увеличивая дозу на 0,1 мл при переходе к каждой следующей пробе. Колбы плотно закрывают и выдерживают при комнатной температуре (201 С) 10 дней. Затем растворы декантируют в ячейку и измеряют рН.
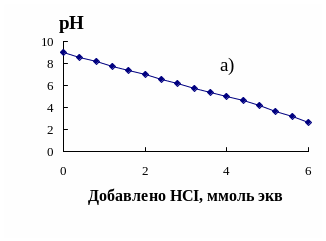
Пример кривой потенциометрического титрования низкоосновного анионита на фенольной основе (ИА-3) представлен на рис. 5.
|
|
Рис. 5. Кривые потенциомерического титрования низкоосновного анионита на фенольной основе
|
|
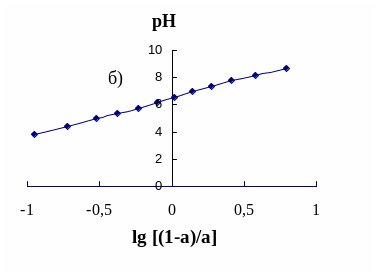
Судя по рис. 5 (а), кривая титрования слабоосновного анионита представляет собой плавно понижающуюся кривую, не имеющую максимума. Такие кривые характерны для ионитов, содержащих один тип функциональных групп с малой константой ионизации. Для нахождения средней величины рКb использовали графическую зависимость рОН - lg[(1-)/] (рис. 5, б), из которой следует, что при =0,5 кажущаяся константа ионизации анионита равна примерно 7,5.
По тангенсу угла наклона зависимости pOH - lg [(1-)/] нашли, что tg=3,1. С учетом этой величины по уравнению Гендерсона-Гассельбаха для титрования основания
![]()
рассчитали показатель основности функциональных групп низкоосновного анионита (табл. 1).
Таблица 1
Зависимость степени ионизации анионита от величины рОН
равновесного раствора
РH |
pOH |
|
lg[(1-)/] |
n lg[(1-)/] |
pKb |
8,55 |
5,45 |
0,07 |
0,79 |
2,4 |
7,85 |
8,15 |
5,85 |
0,14 |
0,58 |
1,8 |
7,65 |
7,77 |
6,23 |
0,21 |
0,41 |
1,27 |
7,50 |
7,33 |
6,67 |
0,28 |
0,27 |
0,84 |
7,46 |
6,98 |
7,02 |
0,35 |
0,14 |
0,43 |
7,45 |
6,58 |
7,42 |
0,42 |
0,02 |
0,06 |
7,48 |
6,20 |
7,80 |
0,49 |
- 0,10 |
- 0,31 |
7,49 |
5,75 |
8,25 |
0,56 |
- 0,23 |
- 0,71 |
7,54 |
5,37 |
8,63 |
0,63 |
- 0,38 |
- 1,18 |
7,45 |
Судя по этим данным, величина рКb анионита практически постоянна в довольно широком интервале рН - от 8,1 до 5,3. Среднее значение рКb=7,54, что совпадает со значением константы, найденным графическим путем. Величина Кb=2,910-8 моль/л.