
- •Введение
- •Тема 1. Равновесия в водных растворах электролитов
- •1.1. Вопросы для подготовки к лабораторному занятию
- •1.2. Выполнение типовых заданий
- •Сильные и слабые электролиты
- •Константы диссоциации кислот и оснований в водных растворах
- •Правила составления уравнений ионно-молекулярных реакций
- •1.3. Вопросы и типовые задания к контрольной работе Вопросы
- •Типовой вариант контрольной работы
- •Тема 2. Приготовление растворов заданной концентрации
- •2.1. Вопросы для подготовки к лабораторной работе
- •2.2. Выполнение типовых заданий
- •2.3. Вопросы и типовые задачи к контрольной работе Вопросы
- •Типовые задачи
- •Тема 3. Жёсткость природных вод
- •3.1. Вопросы для подготовки к лабораторной работе
- •3.2. Выполнение типовых заданий
- •1 Л воды содержит 3,8 ммоль/л ∙ 55,5 мг/ммоль CaCl2,
- •5000 Л воды содержат х мг соли.
- •Тема 4. Методы очистки природных вод
- •4.1. Вопросы для подготовки к лабораторной работе
- •4.2. Выполнение типовых заданий
- •4.3. Вопросы и типовые задания к коллоквиуму Вопросы
- •Типовые задания
- •Тема 5. Гетерогенные дисперсные системы
- •5.1. Вопросы для подготовки к лабораторной работе
- •5.2. Выполнение типовых заданий
- •5.3 Вопросы и типовые задания к контрольной работе Вопросы
- •Типовые задания
- •Тема 6. Химия минеральных вяжущих веществ
- •6.1. Вопросы для подготовки к занятиям
- •6.2. Выполнение типовых заданий
- •6.3. Вопросы и типовые задания к контрольной работе Вопросы
- •Типовые задания
- •Библиографический список
- •Оглавление
- •Растворы. Дисперсные системы
- •394006 Воронеж, ул. 20-летия Октября, 84
Константы диссоциации кислот и оснований в водных растворах
Вещество |
Константа диссоциации |
|||
КI |
КII |
КIII |
||
HF |
6,6 ∙ 10-4 |
|
|
|
HNO2 |
4,0 ∙ 10-4 |
|
|
|
H2S |
1,1 ∙ 10-7 |
1,0 ∙ 10-14 |
|
|
H2SO3 |
1,6 ∙ 10-2 |
6,3 ∙ 10-8 |
|
|
H2CO3 |
4,5 ∙ 10-7 |
4,8 ∙ 10-11 |
|
|
H2SiO3 |
1,3 ∙ 10-10 |
2,0 ∙ 10-12 |
|
|
H3PO4 |
7,5 ∙ 10-3 |
6,3 ∙ 10-8 |
1,3 ∙ 10-12 |
|
NH4OH |
1,8 ∙ 10-5 |
|
|
|
Cu(OH)2 |
|
3,4 ∙ 10-7 |
|
|
Окончание табл.2 |
||||
Fe(OH)2 |
|
1,3 ∙ 10-4 |
|
|
Fe(OH)3 |
|
1,8 ∙ 10-11 |
1,4 10-12 |
|
Zn(OH)2 |
4,4 ∙ 10-5 |
1,5 ∙ 10-9 |
|
|
Mg(OH)2 |
|
2,5 ∙ 10-3 |
|
|
Pb(OH)2 |
9,6 ∙ 10-4 |
3,0 ∙ 10-8 |
|
|
Mn(OH)2 |
|
5,0 · 10-4 |
|
|
Al(OH)3 |
|
|
1,38 ∙ 10‾9 |
|
Таблица 3
Таблица растворимости солей, кислот и оснований в воде
Катион |
H+ |
K+, Na+ |
NH4+ |
Mg2+ |
Ca2+ |
Cu2+ |
Zn2+ |
Mn2+ |
Fe2+ |
Fe3+ |
AI3+ |
Ва2+
|
Анион |
||||||||||||
OH- |
|
Р |
Р |
Н |
М |
Н |
Н |
Н |
Н |
Н |
Н |
Р
|
CI- |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р
|
NO3- |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р
|
S2- |
Р |
Р |
Р |
─ |
─ |
Н |
Н |
Н |
Н |
Н |
─ |
─
|
SO32- |
Р |
Р |
Р |
М |
М |
─ |
М |
Н |
М |
─ |
─ |
Н
|
SO42- |
Р |
Р |
Р |
Р |
М |
Р |
Р |
Р |
Р |
Р |
Р |
Н
|
CO32- |
Р |
Р |
Р |
М |
Н |
Н |
Н |
─ |
Н |
─ |
─ |
Н
|
HCO3- |
Р |
Р |
Р |
Р |
Р |
─ |
─ |
─ |
Р |
Р |
Р |
Р
|
SiO32- |
Н |
Р |
Р |
Н |
Н |
Н |
Н |
─ |
Н |
Н |
Н |
Н
|
РО43─ |
Р |
Р |
─ |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н
|
Р ─ растворимое вещество, М ─ малорастворимое, Н ─ нерастворимое, «─» ─ разлагается водой
H2SO4 серная кислота, является кислотой сильной (=1), диссоциирует необратимо и в одну ступень с образованием двух ионов водорода и одного иона кислотного остатка: H2SO4 2Н+ + SO42.
H2SO3 сернистая кислота, относится к слабым электролитам (табл.1, табл. 2), поэтому степень её диссоциации <<1. Это двухосновная кислота (содержит два атома водорода в молекуле), поэтому диссоциирует обратимо в две ступени, каждая из которых характеризуется константой диссоциации.
Первая ступень диссоциации сернистой кислоты ─ Н2SО3:
I.
Н2SО3
↔ Н+ +
НSО3─
;
КI
Н2SО3
![]() .
.
Вторая ступень диссоциации Н2SО3:
II.
НSО3─
↔ Н+
+ SО32─;
KII
Н2SО3
=
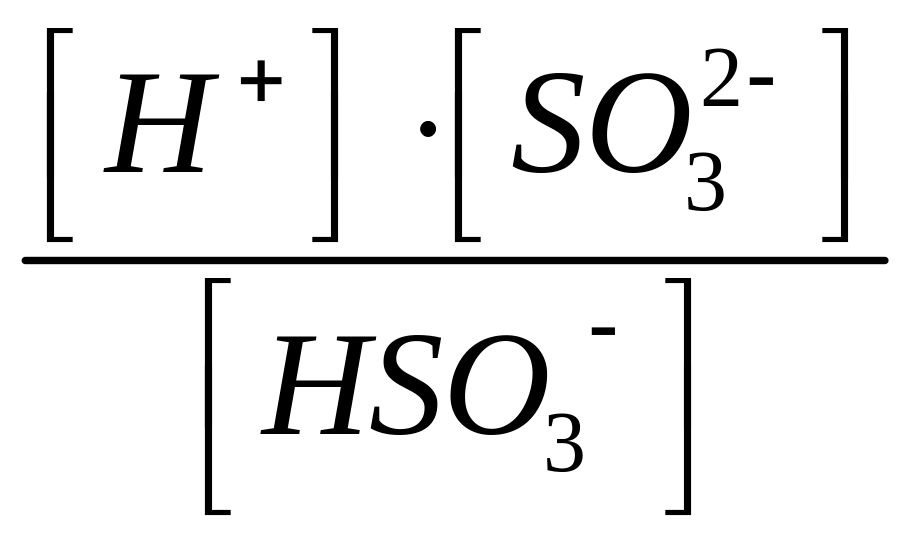 .
.
Ba(OH)2 и Mn(OH)2 относятся к классу гидроксидов, являются основаниями, которые при растворении в воде под действием полярных молекул растворителя диссоциируют на ионы ОН и ионы основного остатка. Формулы средних основных остатков приведены в верхней строке таблицы растворимости (табл. 3).
Ba(OH)2 гидроксид бария, является сильным основанием (=1), диссоциирует необратимо и в одну ступень с образованием двух ионов ОН и одного иона основного остатка: Ba(OH)2 → Ва2+ + 2ОН.
Mn(OH)2 гидроксид марганца (II), относится к слабым электролитам (табл. 1, 2), степень его диссоциации <<1. Это основание двухкислотное (содержит две гидроксильных группы ОН в молекуле), поэтому диссоциирует обратимо в две ступени, каждая из которых характеризуется константой диссоциации.
Первая ступень диссоциации гидроксида марганца (II) :
I.
Mn(OH)2
↔ MnOH+
+ ОН─;
КI
Mn(OH)2
=
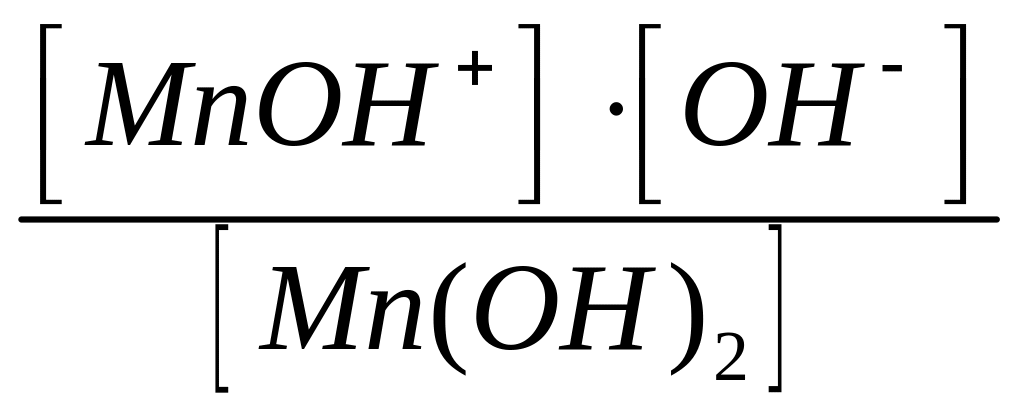 .
.
Вторая ступень диссоциации Mn(OH)2 :
II.
MnOH+
↔ Mn2++
ОН─ ;
KII
Mn(OH)2
=
![]()
Na2SO3, NaHSO3, MnCl2, (MnOH)Cl относятся к классу солей, являются сильными электролитами, имеют степень диссоциации, равную единице. Соли диссоциируют необратимо и в одну ступень на основные и кислотные остатки (табл. 2).
Уравнения диссоциации:
сульфита натрия: Na2SO3 2Na+ + SO32;
гидросульфита натрия: NaHSO3 Na+ + HSO3;
хлорида марганца: MnCl2 Mn2+ + 2Cl;
гидроксохлорида марганца: (MnOH)Cl MnOH+ + Cl.
Задание 2. Напишите молекулярные, полные и сокращённые ионно-молекулярные уравнения реакций взаимодействия между:
а) нитратом цинка и сульфидом натрия;
б) хлоридом аммония и гидроксидом калия;
в) карбонатом натрия и азотной кислотой.
Укажите причину протекания реакции двойного обмена между растворами электролитов.
