
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
.docСКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
Цель работы: изучение влияния концентрации реагирующих веществ и температуры на скорость гомогенной химической реакции.
Согласно закону действия масс при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, причем каждая из концентраций участвует в степени, равной стехиометрическому коэффициенту перед формулой данного вещества в уравнении реакции. Например, скорость v реакции (mА + nB) записывается следующим образом:
v = k[A]m [B]n ,
где k константа скорости реакции, зависящая от природы реагирующих веществ и температуры; [A], [B] концентрации реагирующих веществ, моль *л-1; m, n стехиометрические коэффициенты.
Скорость большинства гомогенных реакций согласно эмпирическому правилу Вант-Гоффа при повышении температуры на 10 °С увеличивается в 2-4 раза:

где vt1 и vt2 скорости при температурах t1 и t2 ; γ - температурный коэффициент скорости реакции, принимающий значения 24 для большинства реакций.
Условием протекания реакции является столкновение молекул, однако результативными оказываются те столкновения, в которых принимают участие так называемые активные молекулы. При повышении температуры энергия вещества возрастает и перераспределяется между молекулами таким образом, что значительно увеличивается число активных молекул, т. е. таких молекул, которые в момент столкновения обладают некоторым избытком энергии над средней энергией частиц. Избыточная энергия носит название энергии активации. Энергией активации реакции называется минимальная энергия (в расчете на 1 моль), которой должны обладать реагирующие частицы, чтобы столкновение между ними привело к реакции.
Интегрирование в интервале (Т1 - Т2 ) уравнения Аррениуса

при допущении, что в малом температурном интервале Е не зависит от температуры, позволяет вычислить энергию активации:
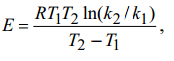
где Е – энергия активации, кДж/моль; R = 8.314 Дж * моль-1 * К-1 универсальная газовая постоянная; Т1 , Т2 абсолютная температура, К.
Для приближенных расчетов отношение k2 / k1 может быть заменено отношением vt2 / vt1.
