
- •1.Теоритические основы метода атомно-абсорбционного анализа. Общая характеристика метода. Достоинства и ограничения метода.
- •2.Что называют коэффициентом пропускания t и оптической плотностью a?в каких пределах изменяются эти величины? Что называется свойством аддитивности оптической плотности?
- •3.Почему атомные спектры имеют линейчатый характер? Интенсивность спектральных линий. Уравнение Ломакина-Шайбе.
- •4.Колебательные спектры молекул. Какие молекулы обладают колебательными спектрами? Нормальные колебания: валентные и деформационные. Основные типы колебаний молекулы воды.
- •5.Теоритические основы рентгеновской спектроскопии. Взаимодействие твердого образца с рентгеновским излучением. Закон Мозли. Закон Вульфа-Брэгга.
- •6.Происхождение люминесцентного излучения. Схема энергетических уровней молекул, возникновение люминесцентного излучения. Флуоресценция и фосфоресценция.
- •7.Спектроскопия ямр. Эффект Зееман. Химический сдвиг.
Контрольная работа
Вариант № 2
Ответы:
1.Теоритические основы метода атомно-абсорбционного анализа. Общая характеристика метода. Достоинства и ограничения метода.
Метод атомной-абсорбционной спектроскопии
Предложен Уолшем .При поглощении кванта света hν свободной атом A переходит в возбужденное состояние A*: A+hν= A* ,
где h-постоянная Планка ;ν-частота, определяемая условием частот Бора,
ν=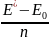 ,
,
где Е*-Е0 –энергия атома в возбужденном и основном состояниях соответственно.
Если на невозбужденный атом направить излучение с частотой ,равной частоте резонансного перехода, кванты света будут поглощаться атомами и интенсивность излучения будет уменьшаться. Общее количество возбужденных атомов составляет 1-2% от невозбужденных. Величина сигнала в меньшей степени будет подтверждена влиянию случайных колебаний в режиме работы различных узлов атомно-абсорбционного спектрофотометра.
Атомно-абсорбционный спектральный анализ получил широкое распространение в практике вследствие многих достоинств:
Зависит от числа невозбужденных атомов, которые мало изменяется с температурой. Это уменьшает взаимное влияние компонентов пробы на аналитический сигнал.
Требования к стабильности условий работы источника возбуждения выше.
В атомно-абсорбционной спектроскопии практически полностью исключена возможность наложения линий различных элементов.
Погрешность определения обычно составляет примерно 5% и зависит от различных условий изменяется в пределах от 3 до 10%
Метод имеет также ряд ограничений.
Ограничения:
Не определяются элементы ,резонансные линии которых лежат в далеком ультрафиолете.
Необходимость растворения пробы.
Невозможность одновременного определения нескольких элементов.
2.Что называют коэффициентом пропускания t и оптической плотностью a?в каких пределах изменяются эти величины? Что называется свойством аддитивности оптической плотности?
Уменьшение интенсивности света, прошедшего через раствор ,характеризуется коэффициентом пропускания T: T=I/I0
,где I и I0-соотвественно интенсивности света, прошедшего через раствор и растворитель.
Эта величина может изменяться от 0 до 1, иногда ее выражают в процентах.
Взятый с обратным знаком логарифм T называется оптической плотностью A:
-lgT = -lgI/I0= lgI/I0 = A
Величина оптической плотности может принимать любые положительные значения от 0 до ∞; однако, современные приборы могут регистрировать изменение только от 0 до 2.
Оптическая плотность раствора ,содержащего несколько окрашенных веществ, обладает свойством аддитивности, которое иногда называют законом аддитивности светопоглощения. В соответствии с этим законом поглощения света каким-либо веществом не зависит от присутствия в растворе других веществ .
3.Почему атомные спектры имеют линейчатый характер? Интенсивность спектральных линий. Уравнение Ломакина-Шайбе.
Атомные спектры имеют линейчатый характер, то есть они состоят из отдельных спектральных линий. Возникновение линий в спектре обусловлено тем ,что при возбуждении атома электроны, принимая соответствующие порции энергии, переходят в состояние с более высокими энергетическими уровнями.
Интенсивность спектральных линий Ikr приближенно определяется выражением:
Ikr=Nk Akr hνkr ,
Где Nk –число атомов в возбужденном состоянии k ; Akr -вероятность перехода из возбужденного состояния k в более низкое состояние r; νkr - частота, соответствующая этому переходу ; h -постоянная Планка.
Не все кванты ,испускаемые возбужденными частицами ,достигают приемниками света. Квант света может быть поглощен невозбужденным атомом и не будет зафиксирован приемником излучения. Это самопоглощение.
Самопоглощение учитывается в ур-нии Ломакина-Шайбе, которое описывает концентрационную зависимость интенсивности спектральной линии:
I=acb ,
Где a –коэффициент, зависит от источника возбуждения, его стабильности, температуры и т.д.; b -коэффициент самопоглощения.
