
- •1.3. Потенциометрическое титрование
- •1. Определение фторида в водах с использованием фторид-селективного электрода. (Метод градуировочного графика и постоянной ионной силы)
- •2. Потенциометрическое кислотно-основное титрование. Определение фосфорной кислоты в растворе
- •3. Определение соляной и борной кислот в растворе при их совместном присутствии
- •4. Окислительно-восстановительное титрование. Определение кобальта (II) в растворе
Приемы, используемые в прямой потенциометрии
(ионометрии)
Метод градуировочного графика. Наиболее часто применяют прием последовательного разбавления исходного раствора дистиллированной водой. Готовят таким образом серию из 5–7 эталонных растворов с известным содержанием определяемого вещества. Концентрация определяемого вещества и ионная сила в эталонных растворах не должны сильно отличаться от концентрации и ионной силы анализируемого раствора: в этих условиях уменьшаются ошибки определения. Ионную силу всех растворов поддерживают постоянной введением индифферентного электролита (метод постоянной ионной силы). Эталонные растворы последовательно вносят в электрохимическую ячейку. Обычно эта ячейка представляет собой стеклянный химический стакан, в который помещают электроды.
Измеряют ЭДС эталонных растворов, тщательно промывая дистиллированной водой электроды и стакан перед заполнением ячейки каждым эталонным раствором. По полученным данным строят градуировочный график в координатах Е(ЭДС) – lg c, где с – концентрация определяемого вещества в эталонном растворе. (Метод постоянной ионной силы позволяет перейти от активностей к концентрациям). Затем в электрохимическую ячейку вносят (после промывания ячейки дистиллированной водой) анализируемый раствор и измеряют ЭДС ячейки. По градуировочному графику находят lg c(Х), где c(Х) – концентрация определяемого вещества в анализируемом растворе.
По данным калибровки ИСЭ определяют следующие электрохимические характеристики.
1. Нернстовскую область электродной функции – интервал прямолинейной зависимости потенциала от активности (концентрации) потенциалопределяющих ионов.
2. Крутизну электродной функции – угловой коэффициент наклона градуировочного графика (Е – раi, Е – рci).
3. Предел обнаружения потенциалопределяющего иона сmin. Для этого экстраполируют прямолинейные участки зависимости Е – рci; полученная точка пересечения соответствует на оси абсцисс величине сmiт .
4. Время отклика ИСЭ – время достижения стационарного потенциала.
5. Селективность электрода относительно определяемого иона в присутствии посторонних ионов.
Метод добавок стандарта. В электрохимическую ячейку вносят известный объем V(X) анализируемого раствора с концентрацией c(Х) и измеряют ЭДС ячейки. Затем в тот же раствор прибавляют точно измеренный небольшой объем стандартного раствора V(st) с известной (достаточно большой) концентрацией с(st) определяемого вещества и снова определяют ЭДС ячейки (необходимо, чтобы ∆Е ≥ 30 мВ).
Рассчитывают концентрацию с(Х) определяемого вещества в анализируемом растворе по формуле
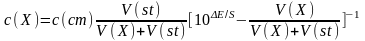 ,
(1.10)
,
(1.10)
где ∆Е – наблюдаемое изменение потенциала в мВ после добавки стандарта; S = 0.059/n – крутизна электродной функции, В.
1.3. Потенциометрическое титрование
Потенциометрическое титрование (ПТТ) – способ определения объема титранта, затраченного на титрование определяемого вещества в анализируемом растворе, путем измерения ЭДС (по сути дела, потенциала индикаторного электрода) с помощью гальванической цепи, составленной из индикаторного электрода и электрода сравнения. При ПТТ анализируемый раствор, находящийся в электрохимической ячейке, титруют подходящим титрантом. Конечную точку титрования (КТТ) находят по скачку потенциала индикаторного электрода, отвечающему моменту завершения реакции. При ПТТ не требуется использование индикаторов, изменяющих окраску вблизи точки эквивалентности (ТЭ). Титрант прибавляют равными порциями, каждый раз измеряя разность потенциалов. В конце титрования (вблизи ТЭ) титрант прибавляют по каплям, также измеряя разность потенциалов.
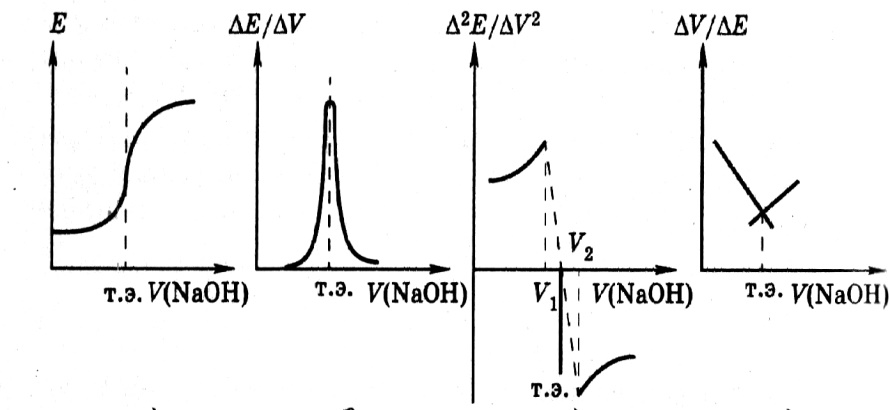
Кривые потенциометрического титрования. Кривая потенциометрического титрования – графическое изображение изменения ЭДС электрохимической ячейки в зависимости от объема прибавленного титрнта.
Кривые ПТТ строят в различных координатах:
Е – V – интегральные кривые титрования;
∆Е/∆V – V – дифференциальные кривые титрования по первой производной;
∆2Е/∆V2 – V – дифференциальные кривые титрования по второй производной;
∆V/∆Е – V – по методу Грана,
где Е – ЭДС потенциометричской ячейки, V – объем прибавленного титранта, ∆Е – изменение потенциала, соответствующее прибавлению ∆V титранта; ∆Е/∆V ≈ dE/dV;
∆2Е/∆V2 = ∆(∆Е)/(∆V)2 ≈ d2E/dV2.
На рисунке 3 приведены различные типы кривых титрования сильной кислоты сильным основанием.
а б в г
Рис. 3. Кривые потенциометрического титрования: а – интегральная; б – дифференциальная (по первой производной); в – дифференциальная кривая по второй производной; г – кривая по методу Грана
Лабораторные работы
1. Определение фторида в водах с использованием фторид-селективного электрода. (Метод градуировочного графика и постоянной ионной силы)
Определение фторид-иона весьма важно при анализе питьевой воды, биологических жидкостей, фармацевтических препаратов и других объектов. Ионоселективный электрод на основе пластинки из монокристалла LaF3 имеет нернстовскую электродную функцию в интервале рF от 1 до 6. Рабочий интервал рН исследуемого раствора составляет 4.5–8.0. Электрод обладает уникальной селективностью: определению практически не мешают значительные количества Cl-, Br -, NO3-, SO42-, SO32-. Более сильно влияет силикат-ион.
Реагенты и аппаратура
Фторид натрия, 0.1000 М стандартный раствор;
нитрат калия, 1 М раствор;
силикат натрия (бромид, хлорид, иодид калия, натрия), 1 М;
рН-метр, иономер;
индикаторный электрод, фторид-селективный;
электрод сравнения, хлоридсеребряный.
Выполнение работы
Включают измерительный прибор в сеть и прогревают в течение 15–20 мин.
Готовят в мерных колбах вместимостью 50.0 мл 1.0∙10-2, 1.0∙10-3, 1.0∙10-4, 1.0∙10-5, 1.0∙10-6 М растворы последовательным разбавлением исходного стандартного 0.1000 М раствора, создавая в каждой колбе постоянную (0.1 М) концентрацию сильного электролита KNO3. Растворы готовят согласно табл. 1.
Таблица 1
Приготовление стандартных растворов фторида натрия
-
Номер колбы
с (F-), М
Способ приготовления
1
1.0∙10-1
Используют 0.1 М NaF в стакане
2
1.0∙10-2
5.00 мл раствора (1) + 4.5 мл 1М KNO3, разбавляют водой до 50.0 мл
3
1.0∙10-3
5.00 мл раствора (2) + 4.5 мл 1М KNO3, разбавляют водой до 50.0 мл
4
1.0∙10-4
5.00 мл раствора (3) + 4.5 мл 1М KNO3, разбавляют водой до 50.0 мл
5
1.0∙10-5
5.00 мл раствора (4) + 4.5 мл 1М KNO3, разбавляют водой до 50.0 мл
6
1.0∙10-6
5.00 мл раствора (5) + 4.5 мл 1М KNO3, разбавляют водой до 50.0 мл
Снимают зависимость потенциала фторидного электрода от
концентрации фторид-иона. Для этого в шесть стаканов вмесимостью 50 мл наливают по 10–15 мл приготовленных растворов и измеряют Е, переходя последовательно от меньших к большим концентрациям. Величину Е фиксируют после установления равновесного потенциала. В разбавленных растворах время отклика фторидного электрода возрастает и для концентрации 1∙ 10-6 М составляет 2–3 мин.
При смене раствора поднимают держатель с электродами. подсушивают торец электрода фильтровальной бумагой и погружают электроды в стакан с новым раствором. После окончания измерения мембрану ИСЭ тщательно промывают дистиллированной водой. Результаты измерений записывают в таблицу (см. табл. 2).
Таблица 2
Результаты измерения потенциала в зависимости от рF для построения градуировочного графика
-
Концентрация фторид-иона, М
рF
Е, мВ
Строят градуировочный график в координатах E–рF и находят область прямолинейной зависимости. Определяют крутизну электродной функции и сравнивают ее с теоретическим значением (59 мВ при 25 °С для однозарядного иона).
По градуировочному графику определяют предел обнаружения сmin фторид-ионов.
Измеряют потенциал анализируемого раствора и по градуировочному графику определяют содержание фторида.
Определяют потенциометрические коэффициенты селективности фторидного электрода по отношению к фторид-иону в присутствии посторонних анионов (SiO32-, Cl-, Br -, I-). Для этого готовят серию стандартных растворов NaF с концентрациями 1.0∙10-2, 5.0∙10-3, 1.0∙10-3, 5.0∙10-4 , 1.0∙10-4, 5.0∙10-5, 1.0∙10-5 М в соответствии с табл. 1, используя в качестве фонового электролита (вместо KNO3) 1.0 М растворы Na2SiO3, NaCl, NaBr, NaI. Строят градуировочные графики в координатах E-рF и находят концентрацию фторида, соответствующую отклонению электродной функции от прямолинейной зависимости (рис. 2). Рассчитывают коэффициент селективности по формуле
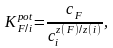 (1.11)
(1.11)
где сF и сi , z(F) и z(i) – концентрации и заряды основного и постороннего ионов соответственно, отвечающие точке перегиба на графике зависимости E–рF.
После окончания работы выключают прибор, промывают электроды дистиллированной водой и оставляют погруженными в воду.
