
4191
.pdf1
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ
«ВОРОНЕЖСКИЙ ГОСУДАРСТВЕННЫЙ ЛЕСОТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ ИМЕНИ Г.Ф. МОРОЗОВА»
ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ МАТЕРИАЛОВ В ДЕРЕВООБРАБОТКЕ
Методические указания к лабораторным работам для студентов по направлению подготовки 35.04.02 – Технология лесозаготовительных
и деревоперерабатывающих производств
Воронеж 2017
2
УДК 544.344.016
Бельчинская, Л. И. Физико-химические методы исследования материалов в деревообработке [Текст] : методические указания к лабораторным работам для студентов по направлению подготовки 35.04.02 – Технология лесозаготовительных и деревоперерабатывающих производств / Л. И. Бельчинская ; М-во образования и науки РФ, ФГБОУ ВО «ВГЛТУ». – Воронеж, 2017. – 35 с.
Печатается по решению учебно-методического совета ФГБОУ ВО «ВГЛТУ» (протокол от № 3 от 01 декабря 2017 г.)
Рецензент канд. хим. наук, доц. кафедры неорганической химии и химической технологии ФГБОУ ВО «ВГУИТ» Ю.С. Перегудов
Методические указания предназначены студентов по направлению подготовки 35.04.02 – Технология лесозаготовительных и деревоперерабатывающих производств, магистерская программа – Технологии мебели, материалов и изделий из древесины.
3 |
|
ОГЛАВЛЕНИЕ |
|
Техника безопасности при выполнении лабораторных работ ……………….. |
4 |
Лабораторная работа № 1 |
|
Оптические методы анализа. …………………………………………………... |
7 |
Лабораторная работа № 2 |
|
Определение содержания меди методом калибровочного графика………….. |
14 |
Лабораторная работа № 3
Рефрактометрический метод анализа. Определение количество компонента в растворе рефрактометрическим методом……………………………………. 16
Лабораторная работа № 4
Электрохимические методы анализа. Электрогравиметрическое определение меди…………………………………………………………...…... 22
Лабораторная работа № 5
Хроматографические методы анализа. Бумажная хроматография…………… 28
Библиографический список................................................................................ |
34 |
4
Правила работы в химической лаборатории
Перед лабораторной работой изучите теоретический раздел и описание лабораторной работы. Покажите преподавателю конспект теоретической и практической части лабораторной работы. Сдайте преподавателю допуск для проведения лабораторной работы.
Уясните технику выполнения лабораторной работы.
В соответствии с техникой безопасности запрещается:
брать реактивы больше требуемого количества;
неизрасходованные или взятые в избытке реактивы возвращать обратно
всклянки (их надо сдать лаборанту);
загромождать рабочее место (во время работы на лабораторном столе должны находиться только необходимые приборы, реактивы и лабораторная тетрадь);
уносить приборы, реактивы общего пользования на свое рабочее
|
место. |
|
путать пробки от склянок. |
|
принимать пищу в химической лаборатории. |
|
работать с включенными токоприемниками одному. |
|
работать в химической лаборатории в неаккуратно застегнутой одежде, с |
|
распущенными волосами. |
|
нагревать на открытом огне горючие жидкости. |
|
сливать горячие растворы в толстостенную посуду. |
|
Необходимо выполнять следующие требования |
|
Перед началом работы следует ополоснуть чистую посуду дистиллиро- |
|
ванной водой над раковиной, затем при необходимости высушить еѐ. |
|
После окончания работы следует тщательно вымыть посуду, кюветы и |
|
вытереть фильтровальной бумагой корзину для кювет. |
|
Склянки и реактивы должны находиться в определенном месте, их нельзя |
|
переносить на другие столы. |
|
Следует работать без лишней торопливости, не проливать и не просыпать |
|
реактивы, если все же это случилось, нельзя сливать загрязненный реактив об- |
|
ратно в склянку с чистым реактивом, а следует собрать его и передать лаборан- |
|
ту; стол (или другой запачканный предмет) нужно вымыть и вытереть. |
|
Бросать бумагу, бытовое стекло и другие предметы можно только в |
|
специальные емкости. |
|
Если во время работы будет пролита в большом количестве кислота или |
|
другой раствор, нужно тотчас сообщить о случившемся лаборанту. |
|
Удалять растворы нужно быстро, так как эти реактивы портят стол и |
|
другие предметы, и осторожно, чтобы не прожечь одежду и не повредить руки. |
|
|
5
При всех несчастных случаях необходимо тотчас обращаться к лаборанту или преподавателю.
Внимательно наблюдать за ходом опыта, отмечая и записывая каждую его особенность (выпадение и растворение осадков, изменение окраски, температуры и т.д.).
Расходовать для осуществления химических реакций то количество реактивов, которое рекомендовано в указаниях по выполнению опыта, а если нет специальных оговорок – минимальное.
Работы с вредными веществами проводить только под тягой. Концентрированные кислоты и щелочи наливать осторожно в вытяжном шкафу; не уносить их на свои рабочие столы.
Если случайно прольете кислоту или щелочь, то быстро смойте их интенсивной струей воды из водопроводного крана, а потом обратитесь к дежурному лаборанту и по его указанию приведите в надлежащий порядок свое рабочее место.
Не выливать в раковину отработанные концентрированные кислоты и щелочи, а пользоваться для этого специально отведенной посудой, установленной под тягой. Отработанные металлы складировать в специальную емкость. Бумагу и остатки твердых веществ бросать в урну.
При работе постоянно следить за тем, чтобы реактивы (особенно кислоты, щелочи) не попадали на лицо, руки, одежду.
При нагревании реактивов или жидкостей не наклоняться над сосудом во избежание попадания брызг на лицо, одежду, обувь.
При нагревании жидкостей в колбе не держите ее отверстием к себе или в
сторону соседа.
Не нюхайте выделяющиеся газы, близко наклоняясь к сосуду. Если нужно понюхать газ, то следует сделать это осторожно, слегка направляя рукой поток воздуха к себе.
В случае ожога (пламенем горелки или горячим предметом) обожженное место смочить крепким раствором марганцовокислого калия. Можно приложить ватку, смоченную жидкостью от ожога.
При разбавлении щелочей, кислот и т.п. веществ, а также при мытье посуды с веществами, разъедающими кожу рук, обязательно надевать резиновые перчатки.
В конце работы уберите рабочее место, выключите воду, электроприбо-
ры.
6
При работе с электроприборами необходимо соблюдать следующие правила
Работу с приборами можно начинать только после тщательного ознакомления с инструкцией по их эксплуатации.
Включать приборы только в сеть переменного тока с напряжением 220 В.
Электроприборы должны располагаться на лабораторном столе таким образом, чтобы химические реактивы не попадали на них, а также в электрическую розетку.
Если произошло замыкание электроустановки или возник пожар, необходимо немедленно обесточить прибор. Тушить пожар следует песком и огнезащитной тканью.
Приборы должны иметь рабочую изоляцию, элемент для заземления.
В электроприборах имеются элементы, находящиеся под напряжением, поэтому запрещается самостоятельно вскрывать и ремонтировать их, а также работать с неисправными приборами.
После окончания работы необходимо отключить прибор от сети.
7
Лабораторная работа № 1 Оптические методы анализа
Цель работы: Изучить устройство и принцип работы фотоколориметра, определить содержание железа методом сравнения.
Теоретическая часть
Оптические методы анализа основаны на изучении взаимодействия электромагнитного излучения с атомами или молекулами исследуемого вещества. В результате взаимодействия возникает аналитический сигнал, содержащий информацию о свойствах исследуемого вещества: частота сигнала зависит от специфических свойств соединения, а интенсивность пропорциональна количеству вещества. Оптическая область включает инфракрасное, видимое и ультрафиолетовое излучение. По характеру взаимодействия излучения с исследуемым веществом и способу его измерения различают абсорбционную спектроскопию, нефелометрию, люминесцентный анализ.
1. Абсорбционная спектроскопия, т.е. анализ по поглощению излучения:
- спектрофотометрический анализ – основан на определении спектра поглощения или измерении светопоглощения при строго определенной длине волны. Фотоколориметрический анализ – основан на измерении интенсивности окраски исследуемого раствора.
2.Анализ, основанный на использовании рассеяния света взвешенными частицами (нефелометрия).
3.Люминесцентный анализ основан на измерении вторичного излучения, возникающего в результате взаимодействия излучения с исследуемым веществом при облучении УФ светом.
Закон Бугера-Ламберта-Бера. Зависимость интенсивности поглощения монохромного излучения от концентрации вещества и толщины поглощающего слоя выражается законом Бугера-Ламберта-Бера
A=-lgI/Io= εlС, |
(1) |
где А – абсорбция или оптическая плотность, Io – интенсивность падающего потока излучения, I – интенсивность потока излучения после прохождения 1 см поглощающего слоя, С – молярная концентрация, ε – молярный коэффициент поглощения.
Молярный коэффициент поглощения равен оптической плотности раствора при единичных значениях концентрации и толщины поглощающего слоя. Он не зависит от объема раствора, толщины слоя и интенсивности освещения. Он является качественной характеристикой вещества и зависит от природы веще-
8
ства и длины волны измерения. Поэтому его величина является объективной характеристикой возможной чувствительности фотометрического определения.
В ИК-области обычно измеряют пропускание Т, равное отношению I/Io и
связанное с оптической плотностью следующим соотношением |
|
-lgT=A. |
(2) |
Зависимость оптической плотности или молярного коэффициента поглощения от длины волны выражается кривой, называемой спектром поглощения. По оси абсцисс откладывается длина волны, частота или волновое число, по оси ординат – молярный коэффициент или пропускание. В случае подчинения закону Бугера-Ламберта-Бера спектр поглощения сохраняет свой вид независимо от концентрации.
Поведение поглощающих систем подчиняется закону Бугера-Ламберта- Бера при определенных условиях. При нарушении этих условий наблюдаются отклонения от закона, выражающиеся в нарушении линейной зависимости между концентрацией поглощающего вещества и величиной абсорбции. Причины отклонения от закона светопоглощения можно разделить на инструментальные, вызванные немонохромностью светового потока, рассеянием света и случайными излучениями; и химические, вызванные дополнительными неучтенными химическими взаимодействиями.
Ошибки молекулярно-абсорбционного анализа Ошибка любого физико-
химического анализа складывается из ошибок, возникающих при подготовке пробы и погрешности измерения аналитического сигнала. Для оценки ошибки при определении концентрации в абсорбционном анализе исходят из допущения, что измерение оптической плотности является основным источником случайных ошибок. Можно показать, что относительная ошибка при определении концентрации, оцениваемая величина С/С, является функцией величины пропускания Т (табл. 1). Допускается, что абсолютная ошибка измерения пропускания Т равна 0.005 или 0.5 %.
Таблица 1 Изменение ошибки определения концентрации в процентах в зависимости от
величины пропускания и оптической плотности.
Пропускание, |
Оптическая плотность, А |
Ошибки в определении |
Т |
(D) |
концентрации С/С*100, % |
1 |
2 |
3 |
0.95 |
0.022 |
10.25 |
|
|
|
0.90 |
0.046 |
5.27 |
|
|
|
0.80 |
0.097 |
2.80 |
|
|
|
0.70 |
0.155 |
2.00 |
|
|
|
0.60 |
0.222 |
1.63 |
|
|
|
|
|
9 |
|
|
|
|
Окончание табл. 1 |
|
|
|
|
1 |
2 |
|
3 |
|
|
|
|
0.50 |
0.301 |
|
1.44 |
|
|
|
|
0.40 |
0.399 |
|
1.36 |
|
|
|
|
0.30 |
0.523 |
|
1.38 |
|
|
|
|
0.20 |
0.699 |
|
1.55 |
|
|
|
|
0.10 |
1.000 |
|
2.17 |
|
|
|
|
0.03 |
1.523 |
|
4.75 |
|
|
|
|
Фотоколориметрический анализ
Приборами для фотоколометрии служат фотоэлектроколориметры (ФЭК), характеризующиеся простотой оптической и электрической схем. Измеряемый диапазон оптической плотности составляет 0.05 – 3.0, что позволяет определять вещества в широком интервале содержаний от 10-6 до 50 %. Для дополнительного повышения чувствительности и селективности определений существенное значение имеют подбор реагентов, образующих интенсивно окрашенные комплексные соединения с определяемыми веществами. Погрешность измерений колеблется от 5 до 0.2 %
Из отечественной аппаратуры наиболее распространены следующие марки фотоколориметров:
-однолучевой колориметр фотоэлектрический КФО с одним каналом
-двулучевые типа ФЭК-М, ФЭК-56, ФЭК-56М.
Они предназначены для определения концентрации вещества в окрашенных или коллоидных растворах в диапазоне длин волн 315-670 нм и снабжены 8 светофильтрами.
Фотоколориметры КФК-3 предназначены для измерения коэффициентов пропускания и оптической плотности прозрачных твердых образцов. Спектральный диапазон работы 315-990 нм. Фотоколориметры широко применяются для проведения серийных определений концентраций веществ на предприятиях водоснабжения, химической, пищевой, лесной промышленности.
Устройство и принцип работы на фотоколориметре КФК-3
Фотоэлектроколориметр КФК-3 (рис. 1) предназначен для измерения коэффициентов пропускания (оптической проницаемости) или оптической плотности цветных растворов с целью определения по калибровочному графику концентрации вещества в растворах.
Спектральный диапазон работы КФК-3 от 315 до 990 нм.
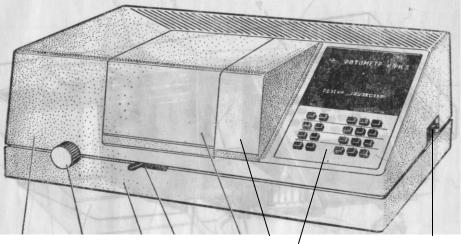
10
Принцип действия фотоэлектроколориметра основан на сравнении светового потока, прошедшего через бесцветный растворитель (Фo), и светового потока, прошедшего через окрашенный раствор (Ф).
Световые потоки Фo и Ф фотоприемника преобразуются в электрические сигналы, которые обрабатываются микроЭВМ прибора и высвечиваются на цифровом табло в виде оптической проницаемости (П, %)
2 |
4 |
3 |
6 |
5 |
1 |
Рис. 1. Вид фотоэлектроколориметра:
1 – тумблер (сеть), 2 – ручка для установления длины волны, 3 – кюветное отделение с кюветодержателем, 4 – рукоятка для ввода светового пучка, 5 – микропроцессор системы, 6 – блок системы
При прохождении света через раствор свет или его компоненты поглощаются или отражаются. По величине поглощения или отражения лучей судят
оприроде и концентрации вещества.
Всоответствии с законом Бугера-Ламберта-Бера зависимость изменения интенсивности потока света, прошедшего через раствор, от концентрации окрашенного вещества в растворе (С), выражается уравнением
lg(Io/I) = l C, |
(3) |
где Io и I – интенсивность потока света, падающего на раствор (Io) и прошедшего через раствор (I); – коэффициент поглощения света, зависящий от природы растворенного вещества, называемый молярным коэффициентом поглощения; l – толщина слоя светопоглощающего раствора.
Измерив изменение интенсивности потока света, можно определить концентрацию анализируемого вещества. Определение проводят на фотоколориметре.
Таким образом, основным показателем для определения концентрации
