
3148
.pdf11
структурно-механического барьера и двойных диффузных слоев ионов. Обра-
зование и свойства растворов коллоидных поверхностно активных веществ (ас-
социативных коллоидов). Термодинамика и механизм мицеллообразования.
Строение мицелл ПАВ. Солюбилизация. Основные факторы, влияющие на кри-
тическую концентрацию мицеллообразования. Методы определения ККМ.
Применение поверхностно активных веществ. Образование и свойства раство-
ров молекулярных коллоидов (растворов ВМС).
Раздел 5. Структурно-механические свойства дисперсных систем
Образование, особенности и разрушение структурированных систем. Рео-
логические свойства дисперсных систем. Свойства коагуляционных структур.
Тиксотропия. Конденсационно-кристаллизационные структуры. Вязкость кол-
лоидных систем. Структурообразование в коллоидных системах. Факторы, оп-
ределяющие прочность структур и механизм структурообразования. Компози-
ционные материалы
Раздел 6. Оптические свойства дисперсных систем
Оптические явления в дисперсных системах. Рассеивание и поглощение света в коллоидных системах. Формула Релея, ее анализ. Оптическая плотность и уравнение Ламберта - Бера. Нефелометрия. Ультрамикроскопия. Определение размеров и формы коллоидных частиц оптическими методами.
Раздел 7. Молекулярно-кинетические свойства высокодисперсных
систем
Причина молекулярно-кинетических свойств. Броуновское движение.
Диффузия. Осмос.
Раздел 8. Виды дисперсных систем
Дисперсные системы с жидкой и газообразной дисперсионной средой; зо-
ли, суспензии, эмульсии, пены, пасты. Особенности золей и суспензий. Пасты,
гели и осадки - как структурированные системы. Эмульсии. Пены. Аэрозоли, их

12
классификация. Представление о дисперсных системах с твердой дисперсион-
ной средой.
4.3.Перечень занятий, проводимых в интерактивной форме
Втаблице 3 представлены темы и краткое содержание лекций по соответствующим разделам курса химии.
|
|
Таблица 3 |
|
|
|
№ п/п |
Тема занятия |
Форма прове- |
|
|
дения |
|
|
|
1 |
2 |
3 |
|
|
|
1 |
Дисперсные (коллоидные) системы и формы получения |
Публичная пре- |
|
лиофобных коллоидов |
зентация |
|
|
|
2 |
Устойчивость и коагуляция коллоидных систем |
Лекция «пресс- |
|
|
конференция» |
3 |
Кинетические и электрические свойства и методы |
Проблемная |
|
исследования дисперсных систем |
лекция |
|
|
|
4 |
Структурно-механические свойства дисперсных систем |
Проект |
5 |
Оптические свойства дисперсных систем |
Проект |
6 |
Виды дисперсных систем |
Коллоквиум |
5. ЛЕКЦИОННЫЕ, ЛАБОРАТОРНЫЕ И ПРАКТИЧЕСКИЕ ЗАНЯТИЯ
5.1. ЛЕКЦИИ
|
|
Таблица 4 |
|
№ |
№ раздела дисци- |
Наименование лекционных занятий |
|
п/п |
плины |
|
|
1 |
2 |
3 |
|
1 |
Раздел 1 |
Дисперсные (коллоидные) системы и формы получе- |
|
|
|
ния лиофобных коллоидов |
|
2 |
Раздел 2 |
Поверхностные явления и особые свойства поверх- |
|
|
|
ности раздела фаз, адсорбционные равновесия |
|
3 |
Раздел 3 |
Кинетические и электрические свойства и мето- |
|
|
|
ды исследования дисперсных систем |
|
4 |
Раздел 4 |
Устойчивость и коагуляция коллоидных систем |
|
5 |
Раздел 5 |
Структурно-механические свойства дисперсных сис- |
|
|
|
тем |
|
6 |
Раздел 6 |
Оптические свойства дисперсных систем |
|
7 |
Раздел 7 |
Молекулярно-кинетические свойства высокодис- |
|
|
|
13 |
|
|
|
|
|
персных систем |
8 |
Раздел 8 |
Виды дисперсных систем |
5.2 ЛАБОРАТОРНЫЕ РАБОТЫ
В таблице 5 приводится перечень наименований лабораторных занятий с указанием номера раздела, к которому относится данное лабораторное занятие.
Таблица 5
№ |
№ раздела дисци- |
Наименование лабораторных работ |
п/п |
плины |
|
1 |
2 |
3 |
1 |
Раздел 1 |
Техника безопасности и правила работы в химиче- |
|
|
ской лаборатории. |
|
|
Лабораторная работа № 1. Получение, очистка и ис- |
|
|
следование процесса коагуляции золя |
2 |
|
Лабораторная работа № 2. Получение ксерогеля |
|
|
кремниевой кислоты |
3 |
Раздел 2 |
Лабораторная работа № 3. Измерение поверхностного |
|
|
натяжения. Исследование взаимосвязи между поверх- |
|
|
ностным натяжением и адсорбцией |
4 |
|
Лабораторная работа № 4. Определение краевого уг- |
|
|
ла смачивания |
5 |
|
Лабораторная работа № 5. Определеиние степени ад- |
|
|
гезии и когезии в различных системах. |
6 |
|
Лабораторная работа № 6. Изучение процесса ад- |
|
|
сорбции метилоранжа из водных растворов на акти- |
|
|
вированном угле |
|
|
|
7 |
Раздел 1,2 |
Контрольная работа №1: «Поверхностные явления и |
|
|
адсорбция. Классификация коллоидных систем, ме- |
|
|
тоды их получения» |
|
|
|
8 |
Раздел 3 |
Лабораторная работа № 7. Определение величины |
|
|
электрокинетического потенциала методом электро- |
|
|
фореза |
|
|
|
9 |
Раздел 4 |
Лабораторная работа № 8. Получение золя гидрокси- |
|
|
да железа и определение порога его коагуляции. |
10 |
Разделы 5 |
Лабораторная работа № 9. Взаимосвязь кинетики |
|
|
процессов структурообразования и химических реак- |
|
|
ций |
11 |
Раздел 7 |
Лабораторная работа № 10. Влияние рН на вязкость |

14
растворов высокомолекулярных соединений
12 Раздел 3,4,5,7 Контроль № 2 Устойчивость, коагуляция и электрические свойства дисперсных систем.
Перечень вопросов к текущему контролю № 1
Билет №1
1.Мера дисперсности. Рассчитать Sуд для частиц кубической и шарообразной формы.
2.Специфические особенности лиофобных коллоидных систем. Доказать!
3.Получение коллоидных систем.
4.Свободная поверхностная энергия. Поверхностное натяжение. Понятия. Термодинамический смысл.
5.Уравнение Гиббса. Анализ. Уравнение Лэнгмюра, анализ.
6.Поверхностная активность. Правило Траубе.
7.Расчет молекулы ПАВ. Вывод.
8.Теплоты адсорбции.
Билет №2
1.Коллоиды. Специфика объектов коллоидной химии.
2.Специфические особенности лиофобных коллоидных систем. Рассмотреть с точки зрения химической термодинамики.
. ПАО и ПИВ – понятия. 3. Факторы, влияющие на величину
4.Смачивание.
5.Построение изотермы адсорбции по изотерме поверхностного натяжения.
6.Изотерма адсорбции Лэнгмюра. Определение констант.
7.Поверхностные пленки нерастворимых веществ. Определение площади и
15
длины молекулы, дающих пленки.
8. Методы определения адсорбции на границе твердая фаза-газ.
Билет №3
1.Специфические особенности лиофобных коллоидных систем. Доказать.
2.Типы классификации коллоидных систем.
3.Понятия: коллоиды, диализ, золь, пептизация.
4.Методы определения поверхностного натяжения.
5.Характеристика ПАВ и ПИВ; поверхностная активность. Правило ДюклоТраубе.
6.Уравнение Шишковского. Вывод. Пояснить константы уравнения.
7.Влияние температуры на физическую адсорбцию и хемосорбцию.
8.Эмпирические уравнения адсорбции Фрейндлиха. Константы, их нахождение. Применение.
Билет №4
1.Химическая теория мономолекулярной адсорбции Лэнгмюра. Вывод уравнения.
2.Виды адсорбции на границе твердое тело-газ. Характеристика хемосорбции. Зависимости, характеризующие адсорбцию.
3.Ориентация молекул ПАВ в поверхностном слое. Почему значение – Г – одинаково в данном гомологическом ряду.
4.Свободная поверхностная энергия твердых тел.
5.Очистка коллоидных систем.
6.Понятия: свободная поверхностная энергия, поверхностное натяжение и адсорбция.
16
7.Мера дисперсности. Диаграмма Sуд = S(а) – размер частицы. Расчет Sуд для частиц кубической формы и шарообразных.
8.Пептизация.
Билет №5
1.Свободная поверхностная энергия. Физический и термодинамический смысл поверхностного натяжения.
2.Специфические особенности лиофобных коллоидных систем, доказать с точки зрения химической термодинамики.
3.Характеристика поверхностных пленок нерастворимых веществ. Расчет площади и длины молекулы. Преимущество исследования пленок.
4.Уравнение: Гиббса, Лэнгмюра, Фрейндлиха. Объяснить константы этих уравнений.
5.Получение коллоидных систем.
6.Поверхностная активность. Правило Дюкло-Траубе.
7.Специфика объектов коллоидной химии.
8.Определение предмета коллоидной химии.
Билет №6
1.Получение коллоидных систем.
2.Мера дисперсности. Диаграмма: Sуд = S(а). Расчет Sуд для золей.
.3. Свободная поверхностная энергия. Поверхностное натяжение. Понятия. Термодинамический смысл
4. Уравнение адсорбции: Гиббса, Лэнгмюра. Их анализ. Уравнение Фрейндлиха, его применение.
5. Поверхностная активность. Правило Траубе. Семейство изотерм адсорбции и
17
поверхностного натяжения для гомологического ряда.
6.Расчет размеров молекулы ПАВ, вывод формулы для длины и площади, занимаемой молекулой.
7.Теплоты адсорбции.
Перечень вопросов к текущему контролю № 2
Билет №1
1.Электрокинетический потенциал. Понятие. Значение. Сравнить преимущества
инедостатки - потенциала.
2.Пять типов изотерм адсорбции.
3.Адсорбция электролитов. Суть. Понятия: ПОИ и ПИ. Правило Фаянса-Панетта. Почему на границе твердая фаза-жидкость всегда возникает ДЭС.
4.Ионнообменные смолы.
5.Строение ДЭС. Общие положения. Теория Гельмгольца, Гуи.
- потенциала по электрофорезу.
6.Электрофорез. Понятие. Определение
7.Написать формулу мицеллы золя SiO2, стабилизированного Н2SiO2. Пояснить строение. Какого электролита надо прилить больше, чтобы вызвать явную коагуляцию: а) 0,1 N CdCl2 и б) 0,1 N Na2SO4.
Билет №2
1.Физическая теория полимолекулярной адсорбции Поляни. Суть. Значение. Недостатки.
2.Адсорбционная способность ПОИ зависимости от радиуса иона и валентности. Правило Фаянса-Панетта.
3.Суть ионного обмена. Сравнение ионов внутренней и внешней обкладок. Вторичный и первичный адсорбционный процесс. Особенности обменной адсорбции.
18
4.Строение ДЭС. Теория Штерна.
5.Эффекты, влияющие на подвижность частицы в электрическом поле.
6.Электроосмос.
7.Золь AgJ получен по реакции: AgNO3 AgJ + KNO + KJ 3 при следующих усло-
виях: 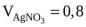 м3,
м3, 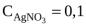 N,
N, 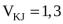 м3,
м3, 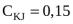 . Написать формулу мицеллы и пояснить строение.
. Написать формулу мицеллы и пояснить строение.
Билет №3
1.Дзета-потенциал и его свойства. Зависимость от концентрации индифферентного электролита. Объяснить.
2.Строение ДЭС. Теория Гельмгольца.
3.Электрокинетические явления. Их причина.
4.Суть ионного обмена. Умягчение воды.
5.Адсорбция из растворов. Классификация. Значение и закономерности молекулярной адсорбции.
6.Теория БЭТ.
7.Золь BaSO4 получен: Ba(NO)3 + H2SO4 = BaSO4 + 2HNO 3. Доказать знак заряда коллоидной частицы и написать формулу мицеллы, если пороги коагуляции разных электролитов равны.
Электролит |
Cd(NO3)2 |
Na2SO4 |
FeCl3 |
С,моль-экв/л |
4,95 |
0,1 |
5,05 |
Билет №4
1.Физическая теория полимолекулярной адсорбции Поляни. Рассчитать изотерму адсорбции при любой температуре.
2.Почему на границе твердое тело-жидкость всегда возникает ДЭС. Понятие ПОИ и ПИ.
19
3.Практическое применение ионного обмена.
4.Теория Штерна. Строение ДЭС.
5.Электроосмос и определение дзета-потенциала.
6.Значение электрокинетических явлений.
7.Написать формулу мицеллы золя Cd(OH)2, если электролит золеобразователь а) CdCl2; б) NaOH. Объяснить строение мицеллы.
Билет №5
1.Понятия: электрофорез, электроосмос, потенциал течения, потенциал осядания. Причина явлений.
2.Пять типов изотерм адсорбции.
3.Значение адсорбции из растворов. Хроматография. Закономерности молекулярной адсорбции.
4.Обменная адсорбция, ее особенности. Кислотный и основной адсорбент.
5.Строение ДЭС. Общие положения всех теорий. Их различия. Теория Гельмгольца, Гуи.
6.Релаксационный и электрофоретический эффекты.
7.Написать формулу мицеллы золя Fe(OH)3, стабилизированного FeCl3. Какого электролита надо прилить меньше, чтобы вызвать явную коагуляцию золя
а) 0,1 N Cd(NO3)2; б) 0,1 N Na2SO4.
1.Экологические последствия, вызванные загрязнением атомной промыш-
ленности.
20
7. Методические рекомендации по организации самостоятельного изучения дисциплины.
Самостоятельная работа студентов
Лекции аудиторно читаются не в полном объеме дисциплины, поэтому на самостоятельное изучение студентам выносятся разделы, которые сообщаются студентам преподавателем и отображаются в рабочем плане.
Организация учебного процесса предполагает достижение основной цели высшего образования – повышения качества подготовки специалистов. Органи-
зация самостоятельной работы студентов является составной частью управле-
ния качеством обучения. Роль организации самостоятельной работы возрастает в виду изменения форм и методов обучения, которые трансформируются и за счет внедрения информационных технологий.
Итак, самостоятельная работа студентов на современном этапе развития высшей школы является одной из основных форм обучения студентов.
По дисциплине “Коллоидная химия” имеются следующие виды самостоя-
тельной работы:
составление конспекта по выполняемой лабораторной работе с исполь-
зованием методических указаний по лабораторному практикуму дисципли-
ны “Коллоидная химия”
освоение теоретического материала по теме лабораторной работы по конспектам лекций и учебнику;
освоение теоретического материала по темам дисциплины “Физическая химия”, вынесенным для самостоятельного изучения, с использованием учебной литературы и конспектов лекций для самостоятельной работы сту-
дентов;
отчет по самостоятельной работе – сдача допуска к лабораторным ра-
ботам;
