
1547
.pdf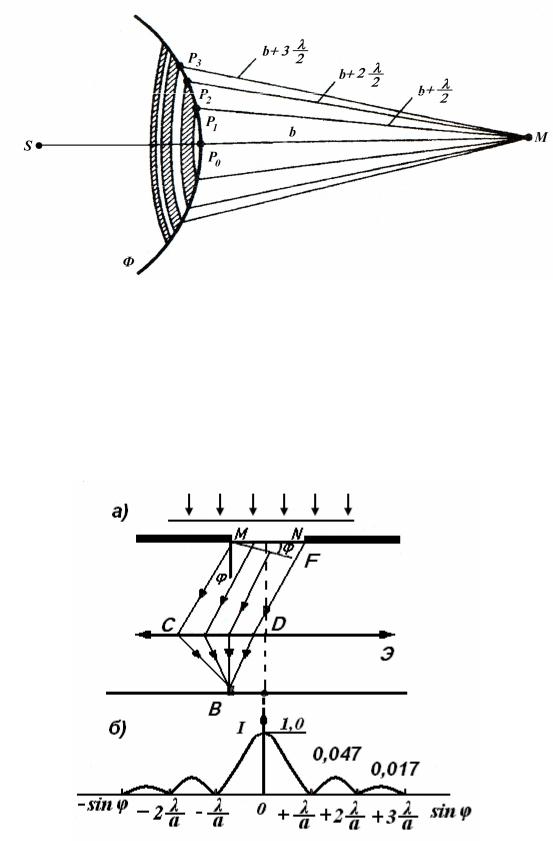
Рис.1. Зоны Френеля
Из полученных соотношений следует, что сужение щели приводит к тому, что центральный максимум расплывается, а его интенсивность уменьшается. При а < 3/2 λ на экране можно увидеть только первую дифракционную полосу (или ее часть). Наоборот, чем щель шире, тем картина ярче, но дифракционные полосы уже. При а» λ в центре получается резкое изображение источника света.
Рис. 2. Дифракция на щели
Положение дифракционных максимумов зависит от длины
50

волны, поэтому рассмотренная выше картина имеет место для монохроматического света. При освещении щели белым светом центральный максимум наблюдается в виде белой полосы; он общий для всех длин волн. Остальные максимумы представляются в виде набора разноцветных полос, при этом фиолетовый максимум расположен ближе к центру дифракционной картины.
Под дифракционной решеткой понимают структуру, состоящую из нескольких щелей шириной а, разделенных одинаковыми промежутками шириной b. Величину d = a+b называют периодом решетки. Картина, получаемая при помощи решетки, будет являться результатом интерференции картин от каждой щели в отдельности. Рассмотрим любые две соседние щели (рис. 3).
Рис. 3. Дифракция на решетке
Пусть плоская монохроматическая волна падает нормально к плоскости решетки. Так как щели находятся на одинаковом расстоянии друг от друга, то разности хода лучей, идущих от двух соседних щелей, для данного направления одинаковы в пределах всей дифракционной решетки:
dsin .
Следовательно, максимумы будут наблюдаться при условии d sinφ = 2k·λ/2,
где k =1,2,3 и т.д.
51
Очевидно, что в тех направлениях, в которых ни одна из щелей не распространяет свет, он не будет распространяться и при нескольких щелях. То есть условие главных минимумов совпадает с условием минимумов для одной щели:
a·sinφ= 2k·λ/2.
В результате интерференции появляются также добавочные минимумы, количество которых зависит от количества щелей. Положение дополнительных минимумов определяется условием
d sin k / N (k≠N, 2N, 3N и т.д.)
Задание к лабораторной работе
Упражнение 1. Дифракция на щели
1.Введите рекомендуемые преподавателем параметры установки
λи а.
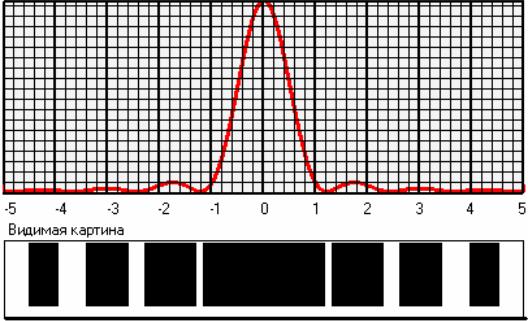
2.Рассмотрите картину дифракции от одной щели при различных масштабах рисунков. Выберите наиболее подходящий, на ваш взгляд, масштаб. Перерисуйте полученный график (рис. 4). Что представляет собой дифракционная картина на одиночной щели?
Распределение интенсивности света
Рис.4. Рабочее окно программы
52

3. По графику определите углы, соответствующие максимумам и минимумам интенсивности света, заполните табл.1.
Таблица 1
Результаты измерений
Номер |
|
|
|
|
|
|
max или |
1 |
2 |
3 |
4 |
5 |
6 |
min |
|
|
|
|
|
|
φmax
φmin
4. Постройте графики sinφ =f(k), где k – номера максимумов и минимумов. Определите по одному из графиков коэффициент вариации по формуле
sin k sin n , k n
где k, n – номера произвольно выбранных максимумов или минимумов. Сравните со значением η = λ/а.
5. Введите длины волн 3-х источников света. Определите углы, соответствующие произвольному (но одинаковому для всех источников) максимуму или минимуму. Заполните табл. 2.
Таблица 2
Результаты измерений
№ |
Длина волны λ |
Угол φ |
|
|
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
6. Постройте график зависимости sinφ = f (λ). Как изменяется вид дифракционной картины при увеличении длины волны света от фиолетового к красному?
53
7. Введите 3 различных ширины щели в пределах от 1 до 5 мкм. Определите углы, соответствующие произвольному (но одинаковому для всех щелей) максимуму или минимуму. Заполните табл. 3.
Таблица 3
Результаты измерений
№ |
Ширина щели а |
Угол φ |
|
|
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
8. Постройте график зависимости sinφ =ƒ(1/а). Как изменяется дифракционная картина при уменьшении ширины щели?
Упражнение 2. Дифракция на дифракционной решетке
1. Выберите пункт меню «Дифракция на решетке». Введите рекомендуемые преподавателем параметры установки - d,λ и N.
2. Рассмотрите картину дифракции на решетке при различных масштабах рисунков. Выберите наиболее подходящий, на ваш взгляд, масштаб. Перерисуйте полученный график. Объясните пропадание некоторых максимумов, вызванных интерференцией
картин от разных щелей. |
|
|
|
|
|
|
|
|
|||
|
3. По графику или рисунку определите |
углы, соответствующие |
|||||||||
главным максимумам, заполните табл. 4. |
|
|
Таблица 4 |
||||||||
|
|
|
|
Результаты измерений |
|
||||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Номер max |
1 |
|
2 |
3 |
|
4 |
5 |
|
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
φmax |
|
|
|
|
|
|
|
|
|
|
4. Постройте графики sinφ = f( k) , где k – номера максимумов и минимумов. Определите по графику коэффициент вариации по
54

формуле
sin k sin n , k n
где k, п – номера произвольно выбранных максимумов или минимумов. Сравните со значением n = λ/d.
5. Введите длины волн 3-х источников света. Определите количество максимумов для различных источников. Заполните табл. 5.
|
|
Таблица 5 |
|
Результаты измерений |
|
|
|
|
№ |
Длина волны λ |
Количество max |
|
|
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
6. Сравните со значением п ≤ λ/d. Как изменятся картина дифракции и количество главных максимумов при увеличении длины волны света?
Заключение
В заключении сделайте вывод о различиях дифракционных картин, создаваемых одиночной щелью и решеткой. Как эти различия сказываются на практическом применении этих дифрагирующих элементов и в чем главное применение явления дифракции?
55

ЛАБОРАТОРНАЯ РАБОТА № 7 (38К)
Водородоподобные атомы
Цели работы: с помощью программы, моделирующей одноэлектронные (водородоподобные) атомы на основе полуклассической теории Бора, определить зависимость радиуса орбиты, скорости и энергии электрона на орбите от номера орбиты. Рассмотреть образование спектра атома водорода, определить его закономерности, рассчитать постоянную Ридберга.
Основы теории
Первая попытка построить качественно новую – квантовую теорию атома – была предпринята в 1913 г. датским физиком Нильсом Бором (1885–1962). Он поставил перед собой цель – связать в единое целое эмпирические закономерности линейчатых спектров, ядерную модель атома Резерфорда и квантовый характер излучения и поглощения света. В основу своей теории Бор положил два постулата.
Первый постулат Бора (постулат стационарных состояний): в атоме существуют стационарные (не изменяющиеся со временем) состояния, в которых он не излучает энергии. Стационарным состояниям атома соответствуют стационарные орбиты, по которым движутся электроны. Движение электронов по стационарным орбитам не сопровождается излучением электромагнитных волн.
В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные, квантованные значения момента импульса, удовлетворяющие условию
m rn n h (n=1,2,3…),
2
где т – масса электрона; υ – его скорость по n –й орбите радиуса rn. Второй постулат Бора (правило частот): при переходе электрона
с одной стационарной орбиты на другую излучается (поглощается) один фотон с энергией
hv En Em ,
равной разности энергий соответствующих стационарных состояний (Ет и Еn – соответственно энергии стационарных состояний атома до и после излучения (поглощения)). При Еn < Ет происходит излучение фотона (переход атома из состояния с большей энергией в состояние с
56

меньшей энергией, т. е. переход электрона с удаленной от ядра орбиты на более близкую), при Еn< Ет – его поглощение (переход атома в состояние с большей энергией, т. е. переход электрона на более удаленную от ядра орбиту). Набор возможных дискретных частот ν = (Еn - Em)/h квантовых переходов и определяет линейчатый спектр атома.
Исследования спектров излучения разреженных газов (т. е. спектров излучения отдельных атомов) показали, что каждому газу присущ определенный линейчатый спектр, состоящий из отдельных спектральных линий или групп близко расположенных линий. Самым изученным является спектр наиболее простого атома – атома водорода.
Швейцарский ученый И. Бальмер (1825–1898) подобрал эмпирическую формулу, описывающую все известные в то время спектральные линии атома водорода в видимой области спектра:
1 |
R |
|
|
1 |
|
1 |
|
|
|
( |
22 |
n2 ) (n = 3,4,5…), |
|||||
|
||||||||
где R'= 10 973 731, 77 м-1 – постоянная Ридберга. Так как v=с/λ, то формула может быть переписана для частот:
v R( |
1 |
|
1 |
) (n = 3,4,5…), |
|
|
|||
22 |
|
n2 |
||
где R = 3,29∙ 1015 с-1 – также постоянная Ридберга.
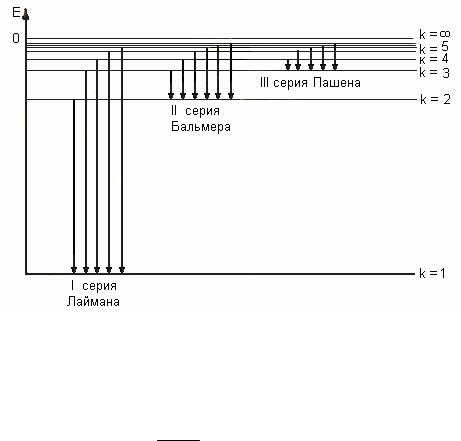
Из данных выражений вытекает, что спектральные линии, отличающиеся различными значениями п, образуют группу или серию линий, называемую серией Бальмера. С увеличением п линии серии сближаются. Значение п = ∞ определяет границу серии, к которой со стороны больших частот примыкает сплошной спектр.
В дальнейшем (в начале XX в.) в спектре атома водорода было обнаружено еще несколько серий. В ультрафиолетовой области спектра находится серия Лаймана:
v R( 1 1 ) (n = 2,3,4…).
12 n2
В инфракрасной области спектра были также обнаружены:
серия Пашена v R ( 1 1 ) (n = 2,3,4…);
32 n2
57

серия Бэкетаv R ( |
1 |
|
1 |
) (n = 5,6,7…); |
||||||||
|
|
|
|
|
|
|||||||
42 |
|
|
|
n2 |
|
|
||||||
серия Пфунда v R ( |
1 |
|
|
1 |
) (n = 6,7,8…); |
|||||||
|
|
n2 |
||||||||||
52 |
|
|
|
|
|
|||||||
серия Хэмфри v R ( |
1 |
|
|
1 |
|
) (n = 7,8,9…). |
||||||
|
|
n2 |
|
|||||||||
62 |
|
|
|
|
|
|
||||||
Все приведенные выше серии в спектре атома водорода могут быть описаны одной формулой, называемой обобщенной формулой Бальмера:
v R( |
1 |
|
1 |
), |
|
m2 |
n2 |
||||
|
|
|
где т имеет в каждой данной серии постоянное значение, т = 1, 2, 3, 4, 5, 6 (определяет серию), п принимает целочисленные значения, начиная с т + 1 (определяет отдельные линии этой серии).
Исследование более сложных спектров – спектров паров щелочных металлов (например, Li, Na, К) – показало, что они представляются набором незакономерно расположенных линий. Ридбергу удалось разделить их на три серии, каждая из которых располагается подобно линиям бальмеровской серии.
Приведенные выше сериальные формулы подобраны эмпирически и долгое время не имели теоретического обоснования, хотя и были подтверждены экспериментально с очень большой точностью. Приведенный выше вид сериальных формул, удивительная повторяемость в них целых чисел, универсальность постоянной Ридберга свидетельствуют о глубоком физическом смысле найденных закономерностей, вскрыть который в рамках классической физики оказалось невозможным.
Постулаты, выдвинутые Бором, позволили рассчитать спектр атома водорода и водородоподобных атомов – систем, состоящих из ядра с зарядом Z и одного электрона (например, ионы Не2+, Li3+), а также теоретически вычислить постоянную Ридберга.
Следуя Бору, рассмотрим движение электрона в водородоподобной системе, ограничиваясь круговыми стационарными орбитами. Решая совместно уравнение, определяющее первый постулат Бора и уравнение Ньютона, для движения электрона, для радиуса стационарной орбиты можно получить
rn n2 h2 02 ,
mZe
58
где п = 1, 2, 3, ... . Из выражения следует, что радиусы орбит растут пропорционально квадратам целых чисел.
Рис.1. Схема энергетических уровней атома водорода
Для атома водорода (Z = 1) радиус первой орбиты электрона при n = 1, называемый первым боровским радиусом, равен
2
r1 a h 0 = 0,528∙ 10-10 = 52,8 пм,
me2
что соответствует расчетам на основании кинетической теории газов. Так как радиусы стационарных орбит измерить невозможно, то для проверки теории необходимо обратиться к таким величинам, которые могут быть измерены экспериментально. Такой величиной является энергия, излучаемая и поглощаемая атомами водорода.
Полная энергия электрона в водородоподобной системе складывается из его кинетической энергии и потенциальной энергии в электростатическом поле ядра:
E |
m 2 |
|
Ze2 |
|
1 |
|
Ze |
2 |
. |
|
4 0r |
|
|
|
|||||
2 |
|
|
2 |
|
4 |
0r |
|||
Учитывая квантованные для радиуса п–й стационарной орбиты значения, получим, что энергия электрона может принимать только следующие дискретные значения:
1 |
|
Z2me4 |
|
||
E |
|
|
|
(n = 1,2,3…) , |
(1) |
n2 |
4h2 02 |
||||
|
|
|
59 |
|
|
