
- •Введение
- •2. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ВЫПОЛНЕНИЯ КУРСОВОЙ РАБОТЫ
- •2.1. Основные понятия и определения химической термодинамики
- •2.2. Первый закон термодинамики
- •2.3. Термохимия
- •2.4. Второй закон термодинамики
- •2.5. Термодинамические потенциалы
- •4. ОФОРМЛЕНИЕ КУРСОВОЙ РАБОТЫ
- •Вопросы и задания к защите курсовой работы
- •Библиографический список
2. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ВЫПОЛНЕНИЯ КУРСОВОЙ РАБОТЫ
2.1. Основные понятия и определения химической термодинамики
СХим ческая термод намика изучает изменение энергии в результате процессов в с стеме, пр водящих к изменению её состава и физикохимическ х свойств.
Термодинамика изучает законы взаимных превращений различных видов энергии, связанных с переходами энергии между телами в форме
теплоты работы. Обычно она изучает только макроскопические систе-
мы.
Хим ческая термод намика представляет важнейший раздел физи-
Гесса и КирхгофаУчебный, их применение для расчетов тепловых эффектов; второй закон термодинамики, его статистический характер; применение эн-
ческой х м . Объектами изучения химической термодинамики являются тепловые балансы ф з ко-химических процессов, фазовые и химические
равновес я. |
|
по химической термодинамике включает: |
материал |
|
|
первый закон термод намики; взаимосвязь теплоты, работы и изменения |
||
внутренней энерг |
в различных термодинамических процессах; законы |
|
тропии и термодинамических потенциалов как критериев равновесия и
направления самопроизвольных процессов. |
|
||
|
Д |
||
Рассмотрим основные понятия и определения химической термоди- |
|||
намики. |
А |
||
Термодинамическая система – это любой изучаемый макроскопиче- |
|||
ский материальный объект, отделённый от внешней (окружающей) среды |
|||
реальной или воображаемой границей. |
И |
||
Типы термодинамических систем: |
|||
|
|||
а) закрытая |
(замкнутая) система отличается постоянством общей |
||
массы, она не обменивается с внешней средой веществом. Обмен энергией в форме теплоты, излучения или работы возможен;
б) открытая система обменивается энергией и веществом с внешней средой;
в) изолированная система не обменивается энергией (теплотой или работой) и веществом с внешней средой и имеет постоянный объём;
г) адиабатически-изолированная система лишена возможности только теплообмена с внешней средой, она может быть связана с внешней средой работой, получаемой от неё и совершаемой над ней.
Параметры состояния системы – это любые измеряемые макро-
скопические характеристики состояния системы. Различают:
8
-интенсивные параметры – параметры, не зависящие от массы (температура T, давление р);
-экстенсивные параметры (ёмкостные) – параметры, пропорциональные массе вещества (объем V, теплоемкость C, масса m). Экстенсивные параметры станут интенсивными, если их отнести к единице массы вещества (удельный объем Vуд, плотность).
Термодинамический процесс – это всякое изменение в системе, связанное с изменением хотя бы одного из термодинамических параметров.
Изменен е вследств е химического превращения называется хими-
ческой реакц ей. |
|
|
|
Виды процессов: |
|
1. |
T = const – |
зотерм ческий или изотермный. |
С |
||
2. |
P = const – |
зо ар ческий или изобарный. |
3. |
V = const – |
зохор ческий или изохорный. |
4. Q = const – ад а ат ческий или адиабатный.
Круговым (ц кл ческим) процессом или циклом называется про-
цесс, в течен |
е которого |
изменяла свои свойства и в конце кото- |
система |
|
|
рого вернулась к сходному состоянию. |
||
Обрат |
процесс – это идеальное понятие. Он протекает как в |
|
прямом, так |
в обратном направлении без изменения работоспособности |
|
системы. Обратимыйпроцесс протекает бесконечно медленно через одну |
||
и ту же последовательность состояния равновесия в обоих направлениях, |
||
чтобы после возвращенияАсистемы в первоначальное состояние ни в окружающей среде, ни в самой системе не было никаких изменений. В обратимых процессах совершается максимальная работа.
При необратимом процессе возвращение системы в исходное состояние связано с изменением состояния внешней среды. Поэтому затрата работы на обратный процесс (возвращение в исходное состояние) значи-
зависит только от начального и конечного состояний системы и не зависит от пути процесса (внутренняя энергия U, энтальпия H, энергия Гиббса G, энергия Гельмгольца F, энтропия S, химический потенциал μ).
тельно больше работы прямого процесса. |
|
Д |
|
Функция состояния системы – это параметр, изменение которого |
|
|
И |
Равновесное состояние системы – это состояние, при котором тер-
модинамические параметры не изменяются со временем и сохраняют одинаковые значения в каждой фазе; при этом энергия системы минимальна. Неравновесное состояние системы – это состояние, при котором термодинамические параметры изменяются со временем.
9

2.2. Первый закон термодинамики
Внутренняя энергия U – это общий запас энергии системы, который складывается из энергии движения и взаимодействия молекул, ядер и электронов в атомах, т. е. всех видов энергии системы, кроме кинетической энергии системы как целого, и её потенциальной энергии положения. Абсолютную величину U определить невозможно, можно определить только её изменение ∆U. Внутренняя энергия зависит от природы вещества, Т, р, агрегатного состояния и др. U – это функция состояния системы.
Другая функц я состояния системы – это энтальпия Н. H = U+pV, |
||||
где pV – работа расш рен я. Энтальпию называют энергией расширенной |
||||
системы ли теплосодержанием системы. Абсолютное значение H опре- |
||||
С |
|
|
||
делить невозможно. |
|
|
||
Для оп сан |
процессов, протекающих при V = const, используется |
|||
∆U. Для оп сан я процессов, протекающих при P = const, используется |
||||
∆H. Разн ца между ∆U |
∆H значительна для систем, содержащих веще- |
|||
ства в газообразном |
|
. Для конденсированных, особенно кри- |
||
состоянии |
|
|||
сталлическ х состоян й, разница между ∆U и ∆H относительно невелика. |
||||
Теплота |
ра ота – это формы передачи энергии, величины кото- |
|||
рых характеризуют процесс и зависят от пути процесса; они функции |
||||
процесса. |
б |
|||
|
|
|
|
|
Теплота Q – это неупорядоченная форма передачи энергии. Она все- |
||||
гда связана с тепловымА(хаотическим) движением частиц. Теплота внутри системы считается положительнойД(Q > 0), если тепло поглощается системой (эндотермический процесс). Теплота внутри системы отрицательна (Q < 0), если тепло выделяется системой (экзотермический процесс).
Тепловой эффект Q – это изменение теплоты в окружающей систему среде (теплота, которая выделяется в окружающую среду из системы или поглощается из окружающей среды системой) в результате процесса. При этом
|
|
|
|
|
|
|
|
|
|
∆Q > 0 → |
Q < 0 |
(эндотермический процесс); |
|||||
|
|
|
|
|
|
|
||
|
∆Q < 0 → |
Q > 0 |
(экзотермический процесс). |
|||||
|
|
|
|
|
|
|
|
И |
То есть |
Q Q |
|
|
|
|
|||
|
|
|
, теплота и тепловой эффект различаются по знаку. |
|||||
Работа А – это упорядоченная форма передачи энергии. Работа считается положительной (A > 0), если она совершается системой против внешних сил (например, расширение газа), и работа отрицательна (A < 0), если она производится внешними силами над системой (например, сжатие
|
|
p V , |
|
|
|
газа). Работа представляет сумму |
A A |
здесь |
– это полезная |
||
|
|
A |
работа (работа против гравитационных, электрических и других сил, не
10
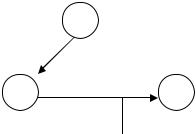
связанных с изменением термодинамических параметров); p V – работа по преодолению внешнего давления, необходимая для удержания системы в состоянии механического равновесия, или работа расширения. Для многих систем она единственный вид работы, поэтому A = 0 и A = p∆V.
С |
V2 |
|
A pdV , тогда A pdV , |
||
V1 |
||
|
||
здесь d – мгновенное изменение; δ – бесконечно малая величина; индекс 1 |
||
– начальное, а ндекс 2 – конечное состояния системы. |
||
Первый закон термодинамики – это постулат. Известны следующие вивалентныхформулировки закона:
1. Закон сохранен я энергии в применении его к термодинамическим процессам является одним из выражений первого закона термодина-
мики: |
зол рованной с стеме о щий запас энергии сохраняется посто- |
|||||||||||
янным. |
|
|
|
|
|
|
|
|
|
|
|
|
2. Энерг я переход т из одного вида (формы) в другой в строго эк- |
||||||||||||
|
|
кол |
чествах. |
|
|
|
|
|
||||
3. Вечный дв гатель первого рода невозможен: получить работу, не |
||||||||||||
затрачивая энерг |
ю, нельзя. |
|
|
|
|
|||||||
|
|
|
|
|
|
А |
||||||
Пусть система переходит из состояния 1 в состояние 2. При этом |
||||||||||||
система поглощаетбтеплоту Q, которая расходуется на изменение внут- |
||||||||||||
ренней |
энергии |
системы |
∆U и совершение |
работы А (рис. 1). |
||||||||
Q = ∆U + A |
или |
Q = dU + A. |
Д |
|||||||||
Это математическое |
выражение |
|||||||||||
|
|
Q |
||||||||||
|
|
|
|
|
|
|
|
|
|
|||
первого закона термодинамики. |
|
|
|
|
||||||||
Рассмотрим изохорный про- |
|
|
|
|
||||||||
цесс (V = const): |
|
|
|
1 |
|
2 |
||||||
Qv dU pdV |
|
|
|
|||||||||
. |
|
|
|
∆U, A |
|
|||||||
Если |
V = const, |
то dV = 0, |
|
И |
||||||||
|
|
|
|
|||||||||
тогда |
pdV = 0 |
и, следователь- |
Рис. 1. Схема, иллюстрирующая |
|||||||||
но, QV dU; QV |
U2 |
U1 |
; |
|||||||||
первый закон термодинамики |
||||||||||||
|
|
|
|
|
|
|
|
|||||
Q U , или |
|
|
U . |
|
|
|
|
|
||||
QV |
|
|
|
|
|
|||||||
V |
|
|
|
|
|
|
|
|
|
|
|
|
11
Тепловой эффект реакции при изохорном процессе равен изменению внутренней энергии системы.
Рассмотрим изобарный процесс (р = const):
Qp dU pdV , |
или |
Qp (U2 U1) ( pV2 pV1) , |
|||
или |
Qp |
(U2 pV2 ) (U1 pV1). |
|||
Так как U pV H |
– это энтальпия системы, тогда |
||||
СибАДИ |
|||||
H2 U2 pV2 , H1 |
U1 pV1 |
или |
|
Qp H2 H1 и |
|
|
|
Qp H или |
Q |
p H . |
|
В зобарном процессе тепловой эффект реакции равен изменению |
|||||
энтальпии. |
|
|
|
|
|
Замен м выражен е H U p V на выражение Qp Qv pdV. огласно уравнен ю Клайперона – Менделеева, p V nRT , тогда
Qp Qv nRT ,
где n – зменен е ч сла молей газообразных веществ, участвующих в реакции.
Для конденс рованных систем Qр = QV.
Теплоёмкость – это количество тепла, необходимое для нагревания данного количества вещества на один градус. Удельная и молярная теплоёмкость – это отношение количества теплоты Q, поглощённое одним граммом (Суд – удельная) или одним молем (См – молярная) вещества к повышению температуры (∆T = T2 – T1), которым сопровождается его нагревание.
Единицы измерения теплоемкости: [Cуд] = |
ж/г·К, [Cм] = Дж/моль·К. |
||||||||||||
Средняя теплоемкость |
|
|
определяется как |
|
|
||||||||
|
|
|
|
|
C |
|
Q |
|
Q . |
|
|
|
|
|
|
|
|
|
T T |
|
|
|
|||||
|
|
|
|
|
|
T |
|
|
|
||||
|
|
|
|
|
|
|
2 |
1 |
|
|
|
|
|
Истинная теплоемкость определяется как |
|
|
|
||||||||||
|
|
|
|
C lim |
Q |
Q . |
|
|
|||||
|
|
|
|
T |
|
|
|||||||
|
|
|
|
|
T2 |
T1 |
dT |
|
|
|
|||
При p = const Cp |
Qp |
|
; |
|
при |
V = const |
CV |
Qv |
. |
||||
dT |
|
dT |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||
Разница между теплоемкостью при изобарных и теплоемкостью при изохорных условиях равна газовой постоянной R и описывается уравнением Майера Cр – CV = R.
Теплоемкость зависит от температуры. Зависимость C = f(T) выражается эмпирическими уравнениями, найденными опытным путём. Они
имеют вид
C = a + bT = cT2 + dT3 или C = a + bT + c'T-2,
12
