
Билет № 1.
-
Кольцевые молекулы ДНК и понятие о сверхспирализации ДНК. Параметры сверхспирализованной ДНК и конформационные переходы в сверхспирализованной молекуле ДНК. Топоизомеры ДНК. Механизм действия топоизомераз.
В 60-х годах было обнаружено, что ДНК некоторых бактериофагов и митохондрий модет существовать в виде циклических молекул. Позже было установлено, что большинство вирусных и множество клеточных ДНК имеют кольцевую форму. Важнейшим параметром каждой кольцевой замкнутой молекулы ДНК является порядок зацепления двух одноцепочечных колец в ней. Он обозначается как L (Lk) и в первом приближении равен числу пересечений одной полинуклеотидной цепи с другой в двуспиральном кольце. Т.о. этот параметр имеет целочисленные значения, явл. постоянной величиной для данной ковалентно замкнутой кольцевой ДНК. Если такая ДНК находится в т.н. релаксированном состоянии, т.е. без напряжения может быть расположена в одной плоскости, то L=T, где T (Tw) – число витков в двойной спирали данной ДНК. Однако если увеличить или уменьшить число витков дв. спирали, сохранив ковалентную непрерывность обеих цепей, то в силу инвариантности Lk такое изменение будет компенсироваться образованием сверхвитков. Число сверхвитков в сверхспирализованной ДНК обозначается W (Wr, райзинг) и определяется как W=L-T.
Wr м.б. как положительной, так и отрицательной величиной. Кольцевые ДНК, выделенные из клеток, всегда имеют отрицательную сверхспирализацию. Степень сверхспирализации той или иной ДНК удобно характеризовать плотностью сверхвитков σ, которая равна W/T. Для многих сверхспирализованных природных ДНК сигма равна примерно -0,05.
Сверхспирализованная ДНК обладает значительным запасом энергии по сравнению с релаксированной формой, следовательно, локальной расплетание дв. спирали ДНК с отр. сверхвитками будет приводить к сбросу напряжения сверхспирализации, поэтому оно энергетически выгодно. Это отчетливо проявляется в том, что отрицательная сверхспирализация заметно стимулирует переход ДНК из правой B-формы в левую Z-форму. Другой пример влияния сверхспирализации на структурные превращения дв. спирали ДНК – образование крестообразных структур. Практически любая ДНК содержит инвертированные, или палиндромные, повторяющиеся последовательности длиной от нескольких п.о. до многих тысяч п.о. Для релаксированного состояния вероятность такого превращения ничтожна, а для ДНК с отр. сверхвитками этот переход энергетически выгоден (экспериментально наличие крестообразной стр-ры обнаруживают по расщеплению однотяжевых петель в конце шпилек нуклеазами, специфичными к однотяжевой ДНК).
Если ДНК содержит гомопиримидин – гомопуриновые последовательности, то под влиянием сверхспирализации (отрицательной) она может переходить в форму трехцепочечной спирали. Т.к. для последовательностей типа d(AG)n*d(CT)n такой переход происходил при пониженных значениях рН (при 4,3 он наблюдался и при отсутствии сверхспирализации), она получила название Н-формы. Стоит также отметить, что отрицательная сверхспирализация ДНК облегчает связывание с ней белков, раскручивающих её двойную спираль.
Зависимость эффекта обработки повышающейся конц. интеркалирующего агента на отрицательно суперскрученную плазмиду близка к параболической (отрицательная парабола).
Топоизомеразы регулируют топологию ДНК:
топоизомераза I вносит временные однонитевые разрывы и релаксирует супервитки;
топоизомераза вторая вносит временные двунитевые разрывы, релаксирует супервитки, разделяет катенаны;
гираза генерирует негативные супервитки, используя энергию АТФ;
обратная гираза генерирует позитивные супервитки.
Топоизомераза I имеет в активном центре остаток тирозина, играющий существенную роль в реакции: она проходит через образование фосфотирозина – промежуточного продукта. Реакция не сопровождается затратой энергии АТФ (гидролизом). L изменяется на единицу.
Рисунок иллюстрирует механизм действия топоизомеразы второй, гиразы.

Гираза (или топоизомераза вторая) вносит обворачивает вокруг себя ДНК так, чтобы образовалась правозакрученная спираль, наносит двухнитевой разрыв, перемещает их и снова соединяет цепи, в результате чего появляется левозакрученный виток и L увеличивается на 2. Топоизомераза вторая также устраняет проблему катенации (явление, при котором две кольцевые молекулы удерживают др. друга, как звенья цепи, например, после репликации плазмиды).
Топоизомеразы [Drlica, K. 1984 и Gellert, M. 1981] - ферменты, способные менять топологическое состояние кольцевых ДНК путем создания временного однонитевого или двунитевого разрыва в молекуле ДНК, проведения сквозь разрыв другого, целого сегмента цепи и воссоединения цепи в месте разрыва. В результате такого ферментативного акта целостность цепей сохраняется, но их топологическое состояние может измениться.
Топоизомеразы необходимы в клетке для решения различных топологических проблем, возникающих при репликации и транскрипции кольцевых замкнутых ДНК. Кроме того, они обеспечивают поддержание определенного уровня сверхспирализации ДНК в клетке, по крайней мере в случае простейших.
По механизму действия топоизомеразы делятся на два типа: I и II. Первая топоизомераза, относящаяся к типу I, была открыта в 1969 г. ( Wang J.C., 1971 ). В настоящее время топоизомеразы типа I найдены почти во всех классах живых организмов. В ходе своей работы топоизомеразы типа I вносят разрыв лишь в одну из цепей двойной спирали. Топоизомеразы типа I из прокариотических клеток способны вызывать релаксацию отрицательно, а из эукариотических - иногда и положительно сверхспирализованной кольцевой замкнутой ДНК. Для своей работы они не требуют никаких кофакторов. Внося разрыв в одну из цепей двойной спирали, фермент ковалентно пришивается к одному из концов цепи, запасая в образованной связи энергию, необходимую для последующего воссоединения этой цепи.
Топоизомеразы I и II делают, соответственно, одноцепочечные и двуцепочечные разрывы. Топоизомераза I E.coli (сигма-протеин, тип 1) уменьшает суперспирализацию ДНК, в то время как топоизомераза II (ДНК-гираза, тип 2) увеличивает ее.Топоизомераза I - это полипептид, массой 101 килодальтон, кодируемый геном topA. ДНК-гираза состоит из двух субъединиц весом 105 и 95 килодальтон, кодируемых, соответственно, генами gyrA и gyrB, и имеет тетраметрическую структуру типа А2В2.
Топоизомеразы типа II в ходе своей работы рвут одновременно обе нити двойной спирали ДНК и проводят сквозь разрыв другой двунитевой сегмент. В ходе такой реакции порядок зацепления, Lk , а следовательно и число сверхвитков, должно изменяться на 2. Поэтому из определенного топоизомера топоизомераза типа II может сделать лишь топоизомеры , отличающиеся от исходного на четное число сверхвитков, что и было продемонстрировано экспериментально ( Brown P.O. and Cozzarelli N.R., 1979 иLiu L.F. ea, 1980 ). Почти для всех реакций, катализируемых топоизомеразами типа II, необходим сопряженный гидролиз АТР ( Gellert M., 1981 , Liu L.F., 1983 , Wang J.C., 1985 , Baldi M.I. ea, 1980 и Hsieh T.S. and Brutlag D., 1980 ). Именно он делает возможной реакцию сверхспирализации кольцевой замкнутой ДНК, при которой происходит увеличение ее свободной энергии .
Топоизомеразы способны не только вызывать изменение сверхспиральной плотности кольцевой замкнутой ДНК, но и катализировать другие процессы, в которых меняется топология цепей ДНК. Было показано, что топоизомеразы типа II способны катализировать реакцию образования заузленных двунитевых кольцевых ДНК , а также реакцию образования зацеплений нескольких молекул. Равновесие в реакциях можно сдвигать в ту или другую сторону в зависимости от условий опыта.
Узлы и зацепления в двунитевых ДНК могут образовываться и при действии топоизомераз типа I при условии, что в кольцевых ДНК имеются однонитевые разрывы ( Tse Y.C. and Wang J.C., 1980 и Brown P.O. and Cozzarelli N.R., 1981 ). При этом фермент связывается с ДНК в точке однонитевого разрыва и производит разрыв в другой цепи, сквозь который проходит сегмент двойной спирали.
Икеда и др. показали, что ДНК гираза может способствовать незаконной рекомбинации (рекомбинация между последовательностями с небольшими участками гомологии или не имеющими гомологии вообще [Franklin, N. 1971 ]) . Инкубация плазмиды pBR322 и фага лямбда в экстракте клетки E.coli привела к формированию рекомбинантов лямбда-pBR322. Добавление оксолиновой кислоты (ингибитора ДНК гиразы, которая воздействует на субъединицу А), стимулировало рекомбинацию. Стимуляция не наблюдалась у гиразы из клеток Nal(r), субъединица А которой резистентна к оксолиновой кислоте. Добавление очищенной ДНК-гиразы к экстракту также стимулировало реком- бинацию. Было предположено, что две А-субъединицы каждой тетрамерической молекулы гиразы ковалентно связываются с ДНК и эти две тетрамерические молекулы гиразы, одна связанная с ДНК фа- га лямбда, другая с ДНК pBR322, кратковременно ассоциируют в ок- тамерический комплекс. Диссоциация октамера в тетрамеры сопровож- дается обменом между одной из двух А-субъединиц и нитями ДНК, прикрепленными к этим субъединицам. Сшивание разрыва после высво- бождения гиразы генерирует рекомбинантную молекулу ДНК.
Одним из предположений, следующих из данной модели является то, что новые стыки, созданные гиразой должны соответствовать известным сайтам , по которым гираза расщепляет ДНК. К сожалению, они оказались существенно вырожденными. Опубликованны консенсусные последовательности , определенные in vitro и in vivo как YRT^GNYNNY и NRT^GRYCKY, соответственно (знак "^" указывает позицию расщепления). Консенсус стыков рекомбинантов pBR322-лямбда, выделенных из клеточных экстрактов, NRT^RNNYNY, лишь слабо пересекается с консенсусами гиразных сайтов ра- зрыва. Аналогично, стыки рекомбинантов pBR322-лямбда, полученных in vivo, имели лишь слабую гомологию с этим консенсусом. Тем не менее, направленные тесты показали, что три из пяти рекомбинационных сайтов лямбда-pBR322 сшиты ДНК гиразой in vitro, что говорит в пользу данной модели.
Другим выводом из данной модели является то, что гираза в одиночку может взять на себя выполнение целиком всего процесса рекомбинации. Этого не наблюдалось с очищенной гиразой E.coli, так как для протекания реакции помимо фермента требовался клеточ- ный экстракт. Противоположный результат был получен с фер- ментом типа 2 (топоизомеразой фага T4), который также является мультипротеиновым комплексом. Инкубация генетически меченой лямбда-ДНК с очищенным ферментом в отсутствие кле- точного экстракта привела к появлению рекомбинантов, отличающихся от родительских геномов наличием делеции или дупликации. Эти результаты поддерживают, но окончательно не подтверждают
-2 постулированную модель. Частота рекомбинации (порядка 10 ) была слишком мала, чтобы позволить прямое выявление рекомбинантов, и они были зафиксированы только после введения ДНК, обработанной T4-топоизомеразой, в клетки E.coli. Возможность того, что топо- изомераза не выполняет целиком рекомбинационный процесс, а только включает его посредством нанесения рекомбиногенных повреждений, следовательно, не совсем исключается.
Топоизомеразы типа I, возможно, вызывают изменчивость генома у эукариот . Эти ферменты могут разрезать одноцепочечную ДНК в районах с потенциалом к внутрицепочечному спариванию и ос- таются связанными с 3'- концом. Они могут присоединять этот конец к 5'- концу одноцепочечной или двуцепочечной ДНК. Короткие последовательности, вовлеченные в вырезание провирусаSV40 из генома клеточной линии крысы, похожи на сайты узнавания топоизомеразы, также некоторые сайты вырезания SV40 совпадают с сайтами, по которым топоизомераза режет in vitro.
2. Преобразования первичных транскриптов у эукариот, приводящие к созданию функциональной мРНК.
Понятие прерванных генов: экзоны плюс интроны, которые вырезаются в процессе сплайсинга. Работа Шарпа и Робертса, опубликованная в 1977 году, показала, что гены высших организмов имеют «прерывистую» структуру: кодирующие отрезки гена перемежаются с некодирующей ДНК, которая не используется при экспрессии генов. «Прерывистая» структура гена была обнаружена, когда аденовирусная мРНК была гибридизована с фрагментами одиночной цепи ДНК. В результате выяснилось, что мРНК-участки этих гибридных двухцепочечных молекул мРНК-ДНК содержат 5'- и 3'-концы участков, не обладающие водородными связями. Более длинные отрезки ДНК при гибридизации закольцовывались и образовывали ответвления. Стало ясно, что эти закольцованные участки, содержащие «ненужные» последовательности, извлекаются из пре-мРНК в результате процесса, который и был назван «сплайсингом». Впоследствии было также выяснено, что прерывистая структура крайне широко распространена у эукариотических генов.
В природе обнаружены несколько вариантов сплайсинга. Какой из них будет проходить в каждом случае, зависит от структуры интрона и катализатора, необходимого для реакции.
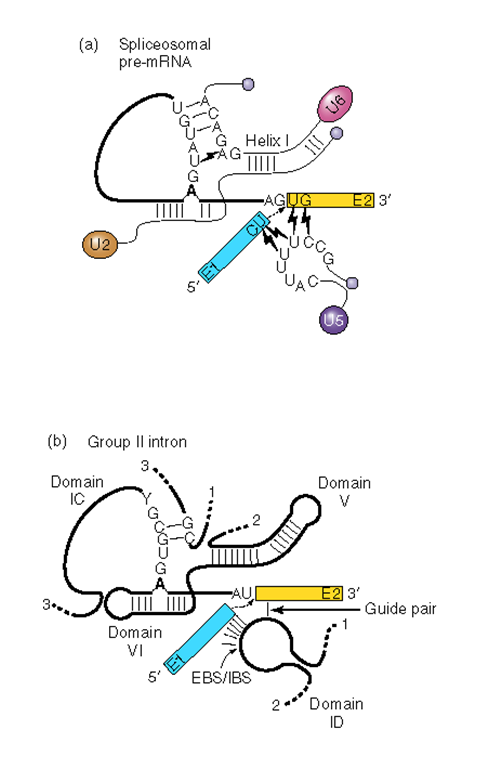
Сплайсосомные интроны часто находятся в генах, кодирующих белки. Для сплайсинга необходимо наличие специальных 3'- и 5' — последовательностей. Важная роль в защите 5'-конца мРНК от деградации экзонуклеазами принадлежит 5'-кэпу. Сплайсинг катализируется сплайсосомой — большим (у высших эук. 60S, у дрожжей – 40S) комплексом, состоящим из РНК и белков и включающим пять малых ядерных рибонуклеопротеидов (мяРНП). РНК-составляющая мяРНП взаимодействует с интроном и, возможно, участвует в катализе. Обнаружены два типа сплайсосом (главная и дополнительная), отличающиеся по входящим в их состав мяРНП. Главная сплайсосома принимает участие в сплайсинге интронов, содержащих гуанин и урацил (GU) в 5' сайте, и аденин и гуанин (AG) в 3' сплайсинг-сайте. Она состоит из мяРНП: U1, U2, U4, U5 и U6, каждая из которых находится в комплексе с рядом белков.
Также существуют РНК, сплайсирующие сами себя (РНК тетрахимены обладает рибозимной активностью и может замыкаться в кольцо и одним своим концом вырезать интроны из другого).
Сигналы вырезания интронов:
Экзон/GU-интрон-AG/экзон.
Для обеспечения точного вырезания интронов консенсус должен быть более длинным:
5’-AG/GUAAGU–intron–YNCURAC–YnNAG/G-3' – для млекопитающих (Y – пиримидин; A – пурин; N – любой).

Branch point – точка
ветвления, там должен быть аденозин.

Нотабене: атом фосфора между экзонами происходит из 3'-сплайс-сайта.

U1 snRNA первой связывается в 5’-концевой областью вырезаемого интрона Этому способствует наличие прямой гомологии последовательностей
U2 snRNA связывается с точкой разветвления (остатком аденина, участвующем в образовании петли).
Гибридизация snRNA с сайтом сплайсинга важна для осуществления сплайсинга. Мутации в сайте сплайсинга, нарушающие комплементарное спаривание, во многих случаях могут быть компенсированы мутациями в snRNA, восстанавливающими комплементарность
Основные этапы сплайсинга:

На первом этапе с вырезаемым интроном связываются U1 и U2. U6 также имеет гомологию к 5’-концевой области интрона (сшивается с нуклеотидом +5), но до определенного времени она находится в комплексе с U4. После освобождения U6 из комплекса с U4, U6 вытесняет U1. При этом она связывается как с 5’- концом интрона, так и с U2 (c которой она имеет область комплементарности), образуя мостик, который направляет образование петли. U5 «стягивает» соседние экзоны. Первая трансэтерификация осуществляется каталитическим центром, образованным при участии U6 и U2. Вторая трансэтерификация осуществляется при участии U6, U2 и U5.
Сплайсированная структура типа «лассо» разрезается специальными ферментами и деградирует. Иногда внутри интронов находятся другие мРНК. Тогда процесс преобразования интронов оказывается более сложным.



Для правильного выбора 3’ сплайс-сайта необходимы также факторы сплайсинга Slu7 и U2AF. Фактор сплайсинга SC35 необходим для формирования начального комплекса (commitment complex), включающего U1 snRNA
У высших эукариот аппарат сплайсинга узнает экзоны (exon definition). У низших эукариот (дрожжи) аппарат сплайсинга узнает интроны (intron definition). У дрожжей идентифицированы белки, которые участвуют в распознавании интронов. Эти белки образуют мостик , связывающий концы интрона (5’ и 3’ сплайс-сайты).

У высших эукариот вспомогательные белки аппарата сплайсинга связываются с экзонами, способствуя их распознаванию. Связывающиеся с энхансерами сплайсинга регуляторные белки могут привлечь факторы сплайсинга к «слабым» сплайс-сайтам. В экзонах могут присутствовать энхансеры сплайсинга, которые привлекают компоненты сплайсосомы и повышают вероятность осуществления сплайсинга в той или иной альтернативной позиции.


ESE – энхансеры сплайсинга (exon splicing enhancers)
SR – белки, связывающиеся с энхансерами сплайсинга
U2AF65/35 – субъединицы фактора U2AF, который связывается с полипиримидиновым блоком в непосредственной близости от 3’ сплайс-сайта
Обычно сплайсинг осуществляется одновременно с транскрипцией. Особенно это касается больших генов (например, ген дистрофина, имеющий длину ~ 2500000 пн). В привлечении компонентов сплайсосомы важную роль играет C-концевой домен РНК-полимеразы II.

Связанные с CTD доменом РНК полимеразы II белки распознают соседние экзоны и позиционируют их таким образом, чтобы облегчить вырезание интрона.
Факторы сплайсинга локализуются внутри ограниченного числa ядерных компартментов. Активные гены обычно локализуются на поверхности таких компартментов.
Про самосплайсирующиеся интроны:
Интроны типа I (пример: интрон 26S рРНК тетрахимены). Интрон укладывается в частично двуспиральную структуру, в которой есть «карман», удерживающий ГМФ. Стерически структура напоминает район, содержащий точку разветвления (А) в обычных интронах.
Интроны типа II (митохондриальные и хлоропластные гены; есть также у архей и цианобактерий, возможно являются предшественниками классических интронов, попавшими в эукариотические клетки вместе с симбиотическими бактериями, давшими начало митохондриям).
Альтернативный сплайсинг.
Известно множество генов, продукты транскрипции которых подвергаются альтернативному сплайсингу. У человека таких генов ~55%. Альтернативный сплайсинг существенно увеличивает многообразие белков. При этом интроны в составе пре-мРНК вырезаются в разных альтернативных комбинациях, при которых вырезаются и некоторые экзоны. Разные варианты альтернативного сплайсинга одной пре-мРНК могут осуществляться в разные периоды развития организма или в разных тканях, а также у разных особей одного вида. Некоторые из продуктов альтернативного сплайсинга пре-мРНК нефункциональны (такой вариант альтернативного сплайсинга осуществляется у дрозофилы при определении пола), но нередко в результате альтернативного сплайсинга пре-мРНК одного гена образуются многочисленные мРНК и их белковые продукты.

У трипаносом, нематод и некоторых других низших эукариот описаны случаи транссплайсинга в результате которого к мРНК пришивается короткая лидерная последовательность, происходящая из другой части генома. Сплайсинг пре-мРНК и транссплайсинг происходят по аналогичному механизму.

Транс-сплайсинг описан также у дрозофилы и других высших эукариот. Пример: локус (mod)mdg4: общие экзоны транскрибируются с одной цепи. Дополнительно в РНК могут присутствовать экзон «А», транскрибирующийся с той же цепи под контролем другого промотора, и экзоны «B», «С», транскрибирующиеся с другой цепи. Все эти экзоны прикрепляются к основному транскрипту посредством транс-сплайсинга (Дорн, 2001 год, PNAS).

Многообразие мРНК, а следовательно и белков, кодируемых одним геном, существенно возрастает благодаря использованию альтернативных промоторов.
Резюме сплайсинга и прелюдия к остальному процессингу: в классической молекулярной биологии геном называли последовательность ДНК, кодирующую определенный белок. У высших эукариот такого рода ген формируется только на уровне мРНК.
Преобразования 5’ конца м РНК (присоединение 7-метилгуанина)
Cap:
-
Защищает РНК от экзонуклеазного расщепления
-
Спсобствует трансляции
-
Способствует транспорту РНК из ядра в цитоплазму
-
5’ cap представляет собой «перевернутый» остаток гуанина, присоединенный к mRNA посредством 5’-5’ связи.
-
Гуанозин в составе Cap-структуры обычно метилирован.
-
Первый и второй нуклеотидные остатки в мРНК тоже часто метилируются по 2'-О-положению остатка рибозы.
Ферменты, участвующие в кэпировании: фосфогидролаза (РНК-трифосфатаза) отщепляет один из фосфатов на 5'-конце мРНК (остаётся два); гуанилитрансфераза использует ГТФ, чтобы присоединить к 5'-концу гуанин (побочный продукт – пирофосфат); гуанин-7-метилтрансфераза метилирует остаток гуанина по 7 положению, используя SAM – S-аденозилметионин. Далее могут последовать необязательные реакции: метилирование первого и второго остатков в цепи с помощью 2'-О-метилтрансферазы.

На 2013 год известны следующие типы кэпа:
-
кэп 0 (m7GpppNp, где N — любой нуклеотид) — это минимальная кэпирующая структура, которая представляет собой 7-метилгуанозин, соединённый 5',5'-трифосфатным мостиком с первым нуклеотидом РНК[1]. Кэп 0 распознаётся фактором инициации трансляции eIF4E;
-
кэп 1 (m7GpppNm2'-Op) отличается от кэпа 0 метилированием первого нуклеотида транскрипта по 2'-O положению рибозы;
-
кэп 2 (m7GpppNm2'-OpNm2'-Op) отличается от кэпа 0 метилированием первого и второго нуклеотидов транскрипта по 2'-O положению рибозы;
-
кэп 4 (m7GpppNm2'-OpNm2'-OpNm2'-OpNm2'-Op) соответственно;
-
2,2,7-триметилгуанозиновый кэп (m2,2,7GpppNp) характерен для малых ядерных РНК и служит сигналом к их транспорту и/или удержанию в ядре (Кугот, 2004 год).
