
biofizika
.pdfкак стандартному акцептору) при стандартных концентрациях. Потенциал переноса выражается в кДж на моль переносимой группы.
Величины потенциалов переноса (включая свободные энергии гидролиза) могут быть в принципе, разумеется, рассчитаны по таблицам свободных энергий образования соединений путем комбинирования соответствующих химических уравнений, но прямые расчёты обычно затрудняются необходимостью учета ионизации соединений, гидратации ионов и др. Поэтому более удобно использование специальных таблиц свободных энергий гидролиза.
Подобно тому, как редокс-потенциалы позволяют судить о термодинамической возможности протекания окислительно-восстановительных реакций, потенциалы переноса определяют термодинамическую возможность реакций переноса. Уменьшение свободной энергии, сопровождающее перенос отдельной группы (например, фосфатной) на воду; называет-
ся свободной энергией гидролиза.
Свободная энергия гидролиза АТФ используется в качестве стандарта, по которому можно сравнивать АТФ с другими членами группы. Символ " " используется для обозначения отдельной связи, вокруг которой локализована энергия. Так, молекулу АТФ сокращенно обозначают А–R–P P P (где А – аденин, а R – рибоза), для того чтобы подчеркнуть отличие высокоэнергетических пирофосфатных связей от фосфоэфирной связи, соединяющей рибозу с первой фосфатной группой (P), Перенос концевой фосфатной группы АТФ на воду будет сопровождаться освобождением свободной энергии, примерно вдвое большей, чем при гидролизе обычной фосфоэфирной связи, например в аденозинмонофосфате (АМФ). С учетом этих сокращений эти реакции имеют вид
А–R–P P P4– + Н2О → А–R–P P3– + НРО24− + Н+,
(АТФ) |
(АДФ) |
G′ |
= – 29,31 кДж/моль; |
А–R–P2– + Н2О → А–R + НРО42− + Н+, |
|
(АMФ) |
|
G′ |
= – 12,56 кДж/моль. |
|
180 |
Символ G′ означает, что величина G0 рассчитывается для реакции при физиологическом значении рН = 7,0, и температуре 298 К. Величину G′ (кДж/моль) для этих реакций гидролиза называют потенциалом переноса фосфата (или фосфатной группы). Свободные энергии гидро-
лиза и потенциалы переноса фосфатной группы для ряда органических фосфатов приведены в таблице 4.
Таблица 4 – Свободная энергия гидролиза при 298 К соединений, содержащих фосфатные группы
Соединение |
G′, |
Соединение |
G′, |
|
кДж/моль |
кДж/моль |
|||
|
|
|||
|
|
|
|
|
Ацетиладенилат |
–55,68 |
АДФ |
–26,8 |
|
Фосфоенолпируват |
–53,6 |
Глюкозо-1 -фосфат |
–20,9 |
|
1,3-дифосфоглицерат |
–49,4 |
2-фосфоглицерат |
–17,17 |
|
Креатинфосфат |
–43,12 |
Фруктозо-6-фосфат |
–15,91 |
|
Ацетилфосфат |
–42,29 |
Глюкозо-6-фосфат |
–13,82 |
|
Аргининфосфат |
–33,49 |
Фруктозо-1-фосфат |
–12,98 |
|
АТФ |
–29,3 |
3-фосфоглицерат |
–12,56 |
|
Неорганический пиро- |
–27,63 |
Глицерол-1-фосфат |
–9,63 |
|
фосфат |
|
|
|
Высокую свободную энергию гидролиза высокоэнергетических соединений, содержащих фосфатные группы, объясняют разными причинами.
Особую роль придают увеличению резонансной стабилизации и уменьшению электростатического отталкивания в результате гидролиза. Если посчитать число резонансных форм АТФ4– и сравнить их с суммой различных резонансных форм АДФ3– и НРО24− , то действительно получается, что гидролиз должен приводить к резонансной стабилизации.
Что касается электростатического отталкивания, существующего между четырьмя близко расположенными и отрицательно заряженными атомами кислорода в АТФ, то оно в самом деле должно ослабляться в результате отщепления концевого фосфата. Это связано с тем, что два
181
продукта, АДФ3– и НРО24− , довольно легко уходят в воду, и поэтому силы отталкивания между их одноименными зарядами уменьшаются.
Уравнение
А–R–P P P4– + Н2О → А–R–P P3– + НРО24− + Н+
отражает сильно упрощенный вариант реакции: оно справедливо только для растворов, имеющих рН > 7. Все три фосфатных соединения – АТФ, АДФ и неорганический фосфат – диссоциируют при значениях рН, близких к нейтральным. Следовательно, при рассмотрении основных ионных форм, присутствующих в нейтральных растворах, необходимо учитывать следующие: АТФ4–, АТФ3–, АДФ3–, АДФ2–, НРО24− и НРО−4 . Если, кроме того, учитывать различные физиологически важные кальциевые и магниевые комплексы этих соединений, которые существуют в интервале рН 4–10, то будем иметь в общей сложности 7 видов АТФ, 7 видов АДФ и 4 вида неорганического фосфата. Только учитывая все эти виды, можно правильно представить себе характер зависимости гидролиза АТФ от рН.
Свободная энергия, выделяемая при окислительном распаде питательных веществ, используется различными путями для выполнения разных видов работы в организме, но почти все они проходят через стадию, когда свободная энергия сосредотачивается в аденозинтрифосфорной кислоте. АТФ играет роль универсального источника энергии во всех без исключения живых существах, начиная от простейших организмов и кончая высшими растениями и животными вплоть до человека.
Помимо АТФ, в организме имеется много других макроэргических соединений, с высокими значениями свободной энергии гидролиза или, точнее, термодинамического потенциала переноса групп (часто просто говорят о "потенциале переноса групп").
Макроэргические фосфатные связи, кроме АТФ и АДФ, содержатся и фосфоэнолпировиноградной кислоте, в креатинфосфате, в дифосфоглицериновой кислоте (содержащей одну простую и одну макроэргическую фосфатную связь) и в ряде других соединений.
182
Соединения, для которых характерно сильное уменьшение величины G′ при гидролизе их фосфатных групп, можно разделить на несколько категорий:
а) полифосфаты, такие, как АТФ; б) енолфосфаты; в) ацилфосфаты;
г) гуанидинфосфаты.
Структурные формулы этих соединений приведены в учебниках биохимии.
В живых системах энергия переноса фосфатной группы не растрачивается на бесполезные реакции гидролиза. Она запасается благодаря реакциям переноса с небольшими потерями энергии или даже вовсе без потерь, либо используется для синтеза необходимых метаболитов. Рассмотрим каждый из этих двух процессов в отдельности.
Реакции переноса, в которых энергия запасается в форме АТФ.
При окислении питательных веществ в клетках энергия окисления запасается в форме АТФ или восстановленных пиридин-нуклеотидов. Эти процессы являются общими почти для всех живых систем; вместе с тем организм человека обладает способностью запасать большую часть химической энергии АТФ и в другой форме – в форме креатинфосфата. Креатинфосфат стабилен в клетках мышц, в которых он накапливается, но легко отдает свою высокоэнергетическую фосфатную группу для нового синтеза АТФ. Уравнение этой реакции выглядит следующим образом
А–R–P P P4– |
КРЕАТИНКИНАЗА |
+ Креатин ←→ А–R–P P3– + |
|
(АТФ) |
(АДФ) |
|
+ Креатин P2– + Н+. |
Для этой реакции величина G0 = +11,72 кДж/моль при рН 7,4, температуре T = 303 К и в присутствии 0,01 М Mg2+. Хотя направление изменения свободной энергии не способствует синтезу креатинфосфата в
183
стандартных условиях, тем не менее при накоплении АТФ в отдыхающих мышцах реакция будет смещаться в правую сторону, благодаря чему высокоэнергетический фосфат будет запасаться до тех пор, пока он не понадобится. Фермент креатинкиназа был открыт в 1935 г. Лохманном, который до этого открыл АТФ.
Другим примером переноса энергии без потерь может служить ферментативное фосфорилирование кофермента А за счет фосфатной группы АТФ
АТФ4− + КоА−SH КоА−S PO32− + АДФ3− + Н+ .
Для этой реакции G0 = −0,84 кДж/моль при рН 7,4 и T = 310 К.
Реакции, в которых используется свободная энергия гидролиза АТФ. Кроме механической работы мышц, живые системы используют химическую энергию АТФ для производства электрической энергии, света и химической работы. Остановимся на химической работе, так как среди этих различных форм полезной работы она является наиболее общей.
Для многих химических реакций, протекающих с участием АТФ, характерна почти полная их необратимость в физиологических условиях. Тот факт, что константы равновесия таких реакций имеют порядок величины 103 и выше, означает, что для их изучения в условиях обратимости необходимо использовать очень высокие концентрации продуктов. Из этого следует, что АТФ представляет собой превосходный фосфорилирующий агент. Кроме того, известно несколько реакций, в которых предпочтительным является образование АТФ из АДФ и подходящего органического соединения, содержащего фосфатную группу (Ф). К реакциям такого типа относится, в частности, реакция
Енолпируват-2-Ф3– + АДФ3– + Н+ → Пируват– + АТФ4–.
Эти реакции известны под названием реакций субстратного фосфорилирования; они хотя и немногочисленны, однако играют важную роль в процессах метаболизма.
184
Синтез глицерол-1-фосфата может служить примером реакции, сопровождающейся сильным уменьшением свободной энергии. Живые клетки не способны фосфорилировать первичную спиртовую группу глицерина с помощью неорганического фосфата ( Фн2− ). Тем не менее, эфир может быть синтезирован ферментативно, если фосфорилирующим агентом является АТФ. Реакция протекает по уравнению
Глицерин+ АТФ |
4− |
α−ГЛИЦЕРОЛКИНАЗА |
2− |
+ |
+ АДФ |
3− |
. |
|
→Глицерол-1-Ф |
|
+ Н |
|
На основании закона Гесса уменьшение свободной энергии для этой реакции, исходя из приведенных ниже уравнений и данных, взятых из таблицы 4 для гидролиза глицерол-1-фосфата и АТФ, равно
АТФ4− + Н2О→Фн2− + АДФ3−+Н+ |
( |
G′= –29,3 кДж/моль) |
|
+ |
|
|
|
Глицерин + Фн2− → Глицерол-1-Ф2− + АДФ3− + Н2О |
|
( |
G′= +9,63 кДж/моль) |
Глицерин+АТФ4− → Глицерол-1-Ф2− + АДФ3−+ Н+ |
( |
G′= –19,68 кДж/моль). |
|
Высокую отрицательную свободную энергию гидролиза АТФ можно рассматривать при такой комбинации этих двух реакций как термодинамическую движущую силу процесса, несмотря на то, что биохимический механизм не включает совместного протекания двух последовательных стадий гидролиза, выражаемых приведенными уравнениями. Вместе с тем многие биохимические синтезы протекают благодаря экзергоническим реакциям, управляющим сопряжёнными с ними эндергоническими реакциями. Рассмотрим такие сопряжённые, или тандемные, реакции более подробно.
Сопряжённые (тандемные) реакции. Некоторые последовательно
сопряжённые, или, как их называют, тандемные, реакции, протекающие в живых системах, являются сопряжёнными в том смысле, что сопровождающее их суммарное изменение свободной энергии обеспечивает возможность образования конечного продукта. Тот факт, что величина G0
185
химической реакции положительна, ещё не означает, что из реагентов не могут образоваться продукты. Он говорит лишь о том, что величина константы равновесия такой реакции меньше единицы. Знак G0 указывает направление самопроизвольного изменения реагентов в стандартном состоянии, но не является показателем реакции, отвечающим на вопрос "всё или ничего".
Если за реакцией, для |
которой величина |
G0 |
положительна |
(т. е. Кр < 1), следует реакция, |
для которой величина |
G0 |
отрицательна |
(т. е. Кр > l), то вторая экзергоническая реакция может обеспечивать протекание, т. е. направлять первую эндергоническую реакцию; тем самым открывается возможность образования желательных продуктов. Несколько таких сопряжённых реакций протекает, например, при гликолизе. В одной из них из фосфоглицерата образуется пируват. Изомеризация 3-фосфоглицерата в 2-фосфоглицерат энергетически невыгодна
1) 3-фосфоглицерат3– → 2-фосфоглицерат3–
G′ = +4,438 кДж/моль.
Тем не менее, сопряжённая с ней реакция – превращение 2-фосфо- глицерата в фосфоенолпируват, – так же как и следующая за ней реакция превращения фосфоенолпирувата в пируват и АТФ, идет самопроизвольно в правую сторону
2)2-фосфоглицерат3– → 2 фосфоенолпируват3– + Н2О
G′ = –2,68 кДж/моль.
3)2-фосфоенолпируват3– + АДФ3– + Н+ → Пируват– + АТФ4–,
G′= –25,54 кДж/моль.
Суммарное уравнение для реакций 1, 2 и 3 имеет вид
3-фосфоглицерат3– + АДФ3– + Н+ → Пируват– + АТФ4– + Н2О,
G′ = –23,78 кДж/моль.
186
Таким образом, 3-фосфоглицерат непрерывно удаляется из системы, и гликолиз проходит в прямом направлении. Бартон и Кребс суммировали данные для свободных энергий ряда реакций, представляющих интерес с биохимической точки зрения, и сгруппировали в соответствии с путями метаболизма.
Разумеется, сопоставление потенциалов переноса показывает лишь термодинамическую возможность данной комбинации реакций; факти-
ческое её осуществление зависит от ряда других условий – кинетических, структурных и др. Кроме того, надо помнить, что сопоставление стандартных значений G0 характеризует лишь термодинамическую возможность реакции при стандартных условиях – при одномолярных концентрациях компонентов, рН 7,0 и др.
7.2. ПРОЦЕССЫ РАСПАДА УГЛЕВОДОВ
Распад и окисление углеводов – основной источник энергии в живом организме – покрывает, например, в организме человека, до 60% энергетических потребностей. Основные этапы распада и окисления углеводов общие для всех видов живых организмов – от микроорганизмов до человека, вследствие чего их изучение имеет большое значение. Поэтому рассмотрим их более подробно. Обычно различают два основных процесса обмена углеводов в организме – анаэробный распад углеводов (гликолиз) и аэробный распад (окисление) углеводов.
Гликолиз углеводов (анаэробный распад углеводов). Типичный ход анаэробного распада углеводов можно проследить на процессе превращения глюкозы в молочную кислоту. Суммарная реакция этого превращения выражается простым уравнением
С6Н12О6 → 2СН3–СНОН–СООН.
Однако в результате многочисленных биохимических исследований было установлено, что этот процесс имеет сложный многоступенчатый характер и протекает с участием многих ферментов (таблица 5).
187

Таблица 5 – Общая схема реакций гликолиза – превращения глюкозы С6Н12О6 в молочную кислоту CH3-CHOH-COOH
|
Схема реакций |
G0 , |
|
|
кДж/моль |
||
|
|
||
|
|
||
Глюкоза С6Н12О6 |
–28,05 |
||
АТФ→↓(1) |
|||
Глюкозо-6-фосфат |
|
||
|
↓(2) |
+2,093 |
|
Фруктозо-6-фосфат |
|
||
АТФ→↓(3) |
–22,19 |
||
Фруктозо-1,6-бисфосфат |
|
||
|
↓(4) |
+19,26 |
|
2 |
мол. 3-фосфоглицериновый альдегид |
|
|
|
↓(5) |
|
|
2 |
мол. 1,3-бисфосфоглицериновый альдегид |
–10,05 |
|
|
↓(6) |
||
|
|
||
2 |
мол. 1,3-бисфосфоглицериновая кислота |
|
|
2 АТФ← ↓(7) |
|
||
2 |
мол. 3-фосфоглицериновая кислота |
+9,21 |
|
|
↓(8) |
||
2 |
мол. 2-фосфоглицериновая кислота |
–5,024 |
|
|
↓(9) |
||
2 |
мол. фосфоэнолпировиноградная кислота |
|
|
|
|||
2 АТФ← ↓(10) |
–36,00 |
||
2 |
мол. энолпировиноградная кислота |
||
|
|||
|
↓(11) |
|
|
2 |
мол. пировиноградная кислота (пируват) |
–44,38 |
|
|
↓(12) |
||
2 |
мол. молочная кислота (лактат) |
|
|
Всего |
–115,137 |
||
|
|
|
|
Подробное описание гликолиза углеводов и других, рассмотренных ниже биохимических процессов, содержится в специальных курсах биохимии. В таблице приведены лишь основные реакции, необходимые для понимания химического существа превращений, и связанные с ними изменения свободной энергии.
188
Внешне простая реакция, которая выражается суммарным уравнением С6Н12О6 → 2СН3–СНОН–СООН протекает через 12 промежуточных стадий.
Общая схема происходящих превращений и соответствующих изменений свободной энергии приведена в таблице 5.
Из таблицы 5 видно, что в процессе превращения глюкозы в две молекулы молочной кислоты (лактат) затрачивается две молекулы АТФ и вновь образуется четыре молекулы АТФ. Таким образом, в результате анаэробного распада глюкозы образуется две молекулы АТФ на одну молекулу превращенной глюкозы.
Общее изменение G0 по данным таблицы 5 составляет
G0 = –115,137 кДж/моль в реакции
глюкоза + 2АДФ3− + 2НРО24− → 2лактата− + 2АТФ4− + 2Н2О,
а в реакции (см. таблицу 6)
глюкоза → 2лактата− + 2Н+
( G0 = –209,34 кДж/моль).
Следовательно, образование двух молекул АТФ сопровождается затратой 94,2 кДж/моль с учетом теплот ионизации и др. Принимая, как указывалось выше, G0 = –41,87 кДж/моль на одну молекулу АТФ, получим КПД процесса гликолиза около (2·41,87 / 209,34) 100 = 40%.
Однако значение процесса гликолиза заключается не только в полезном использовании свободной энергии процесса в форме АТФ, но и в образовании ряда важных промежуточных продуктов обмена.
В частности, уже первая – гексокиназная реакция приводит к образованию глюкозо-6-фосфата, который не только открывает путь к дальнейшим стадиям гликолиза, но является важным этапом на пути окисления углеводов, когда глюкозо-6-фосфат через ряд этапов образует лишь одну молекулу 3-фосфоглицеринового альдегида и три молекулы СО2.
На пути этого превращения образуются пентозофосфаты (рибозофосфат и др.), которые служат составной частью таких важных соедине-
189
ний, как нуклеотиды и нуклеиновые кислоты. Этот процесс, называемый пентозофосфатным циклом, образует нечто вроде циклического ответвления на прямом пути гликолиза.
Таблица 6 – Изменения свободной энергии при анаэробных брожениях (по Кребсу и Корнбергу) при рН 7 на 1 г/моль глюкозы
|
Реакция |
G0 , |
|
кДж/моль |
|
|
|
|
|
|
|
С6Н12О6 |
→ 2 лактат– + 2Н+ |
–209,34 |
С6Н12О6 |
→ 2 С2Н5ОН + 2CO2 |
–260,84 |
11/2С6Н12О6 → 2 пропионат– + CH3COO– + 3H+ + СО2 + Н2О |
–473,95 |
|
3 лактат– → 2 пропионат– + CH3COO– + СО2 + Н2О |
–178,36 |
|
Глицерин C3H5(OH)3 → пропионат– + Н+ + Н2О |
–152,4 |
|
С6Н12О6 |
→ бутират– + Н+ + 2СО2 + 2Н2 |
–262,094 |
2С6Н12О6 → C4H9OH + CH3-CO-CH3 + 5СО2 + 4Н2 |
–469,34 |
|
Вторым важным циклом биохимических превращений, связанным с глюкозо-6-фосфатом, является перенос фосфатного остатка к атому C1 с образованием глюкозо-1-фосфата. Этот процесс катализируется ферментом фосфоглюкомутаза.
Из глюкозо-1-фосфата под действием фермента фосфорилазы может образоваться высокомолекулярный полисахарид – гликоген, с отщеплением эквимолярного количества неорганического фосфата. Гликоген является запасным полисахаридом в животном организме (в печени, в мышцах и др.). Из гликогена под действием амилаз может образоваться глюкоза, замыкая цикл
гликоген 
глюкоза →глюкозо-6-фосфат →глюкозо-1-фосфат
(гликолиз)
190
Равновесие (гликоген глюкоза) позволяет регулировать содержание глюкозы в крови, но в основном распад гликогена идет по пути обращения указанных стадий, через образование глюкозо-1-фосфата и глю- козо-6-фосфата, с последующим течением процесса по схеме, приведенной в таблице 5.
Полная последовательность превращений от гликогена до молочной кислоты (гликогенолиз) наблюдается, например, в клетках мышц.
Из таблицы 5 видно, что замкнутые циклы образуются в отношении двух молекул АТФ, затем 2Н, отнимаемые от 1,3-бисфосфоглицеринового альдегида (реакция (6) в таблице 5) могут расходоваться на восстановление пировиноградной кислоты до молочной кислоты (реакция (12) в таблице 5) и др.
Наличие многочисленных циклических превращений и ответвлений широко распространенная особенность биохимических процессов.
Одним из наиболее важных, ключевых веществ промежуточного метаболизма является пировиноградная кислота (пируват). Указанный в таблице 5 путь её превращения в молочную кислоту является лишь одним из возможных её превращений (наблюдаемым в мышцах или при молочнокислом брожении у бактерий).
Другим важным направлением процесса является превращение пировиноградной кислоты в этиловый спирт (спиртовое брожение).
При другом пути превращений с участием ацетилкоэнзима А образуется уксусная кислота СН3СООН (уксуснокислое брожение). Различные виды микроорганизмов осуществляют образование из пировиноградной кислоты ряда других продуктов (пропионовой кислоты, масляной кислоты, бутилового спирта, ацетона и др.) при общности предыдущих стадий гликолиза; некоторые виды таких брожений могут происходить одновременно (например, образование бутилового спирта при спиртовом брожении).
Изменения свободной энергии при различных видах анаэробного брожения (для сопоставления их все можно отнести на 1 г/моль глюкозы) приведены в таблице 6.
191
При аэробном окислении до конечных продуктов СО2 и Н2О продукты превращения пировиноградной кислоты входят в цикл трикарбоновых кислот. Наконец, надо указать на тесную связь пировиноградной кислоты с обменом аминокислот, жиров, углеводов и ряда других веществ.
Аэробный распад (окисление) углеводов. Гликолиз и аэробный распад углеводов проходят одинаково вплоть до стадии образования пировиноградной кислоты (таблица 5). При наличии пентозофосфатного цикла окислительный распад углеводов начинается и раньше – со стадии образования глюкозо-6-фосфата, однако основное значение имеют окислительные превращения пировиноградной кислоты.
В присутствии кислорода этот вид превращений пировиноградной кислоты преобладает над её превращением в молочную кислоту, т. е. гликолиз тормозится кислородом (эффект Пастера). Это объясняется тем, что окисление пировиноградной кислоты энергетически гораздо более выгодный процесс. Переход от пировиноградной кислоты к молочной (таблица 5) даёт лишь G = −22,19 кДж/моль, а полное окисление пировиноградной кислоты до СО2 и воды даёт около 1256 кДж/моль, т. е. в 60 раз больше, и даже с включением изменений G на предыдущих стадиях гликолиза (от глюкозы до пировиноградной кислоты) различие составит около 20 раз. Поэтому в энергетическом отношении аэробный распад углеводов имеет большое значение. Продукты превращения пировиноградной кислоты проходят при этом через цикл трикарбоновых кислот, в результате которого они и подвергаются полному окислению до СО2 и воды. Включение в этот цикл проходит двумя путями, из которых второй имеет основное значение:
1)через образование щавелевоуксусной кислоты при участии фермента карбоксилазы;
2)через промежуточное соединение ацетилкоэнзим А.
Эта реакция имеет сложный характер и протекает с участием фермента декарбоксилаза пировиноградной кислоты (катализирующей удаление СО2) и пиридинового фермента – дегидрогеназа, катализирующей
192
дегидрирование (т. е. окисление). В результате этой реакции образуется соединение с макроэргической тиолацильной связью – ацетилкоэнзим А (ацетил-КоА, другое название – ацетилкофермент А). Через образование ацетилкоэнзима А обмен углеводов тесно связан с обменом жиров, так как это же соединение имеет важное значение при окислительном распаде и синтезе жирных кислот.
7.3. ОКИСЛЕНИЕ ЖИРНЫХ КИСЛОТ
Окислительный распад жирных кислот является вторым по значению, после распада углеводов, источником энергии в живом организме. Процессы окисления жирных кислот обычно локализованы в митохондриях. Окисление жирных кислот происходит с карбоксильного конца фрагментами по два атома углерода в каждом, т. е. путем β-окисления. Жирные кислоты образуются из жиров при действии тканевых ферментов липаз. Распад жирных кислот начинается с их активации путем реакции с АТФ и коэнзимом A (кофермент А, KoASH) (реакция (1) в таблице 7)
RCH2–СН2–СН2–COOH + KoASH + АТФ →
→RCH2–СН2–СН2–СО–SKoA + АМФ + пирофосфат.
Вэтой реакции одна молекула АТФ дефосфорилируется до адениловой кислоты (АМФ), образуя другое макроэргическое соединение – производное ацетилкоэнзима А. Ввиду того, что эта реакция имеет харак-
тер переноса, суммарное изменение свободной энергии невелико ( G0 = −0,837 кДж/моль; таблица 7).
Следующая реакция (2) (таблица 7) заключается в дегидрировании полученной активированной жирной кислоты в α-, β-положении с образованием ненасыщенной жирной кислоты
RCH2–CH2–CH2–CO–SKoA −2Н→ RCH2–CH=CH–CO–SKoA.
Эта реакция катализируется ферментом ацилдегидрогеназа из группы флавиновых ферментов, причем водород переносится на цитохром-с.
193
Таблица 7 – Общая схема окисления жирных кислот
Схема реакции |
G0 , |
|
кДж/моль |
||
|
||
|
|
|
KoASH, |
|
|
АТФ→ RCH2–СН2–СН2–COOH |
–0,837 |
|
↓ (1) |
|
|
RCH2–СН2–СН2–СО–SKoA |
–17,585 |
|
↓ (2) |
||
|
||
RCH2–CH=CH–CO–SKoA |
|
|
–1,256 |
||
↓ (3) |
||
|
||
RCH2–CHOH–CH2–CO–SKoA |
|
|
–15,49 |
||
↓ (4) |
||
RCH2–CO–CH2–CO–SKoA |
|
|
|
||
KoASH →↓ (5) |
–12,56 |
|
RCH2CO–SKoA + CH3CO–SKoA |
|
|
Всего |
–47,73 |
|
|
|
Затем в реакции (3) (таблица 7) происходит присоединение молекулы воды к ненасыщенной жирной кислоте под действием фермента кротоназа (еноил-КоА-гидратаза)
RCH2–CH=CH–CO–SKoA +H2O→ RCH2–CHOH–CH2–CО–SKoA.
После этого происходит окисление (дегидрирование) полученной оксикислоты с переносом водорода на никотинамидадениндинуклеотид НАД
RCH2–CHOH–CH2–CO–SKoA −2Н→ RCH2–CO–CH2–CO–SKoA.
Наконец, в заключительной стадии (реакция (5) в таблице 7) происходит под влиянием фермента кетотиолазы отщепление 2С-фрагмента в виде ацетилкоэнзима А и образование с новой молекулой коэнзима А вновь активированной жирной кислоты, но с укороченной на два атома углерода цепью
RCH2–CO–CH2–CO–SKoA +КоASH→ RCH2–CO–SKoA + СН3СО–SKoA.
194
После этого укороченная жирная кислота вновь подвергается β-окислению, которое происходит с вовлечением новых молекул коэнзима А на каждый С2-фрагмент, но уже без расхода АТФ, которая затрачивается в количестве одной молекулы на всю молекулу жирной кислоты, независимо от её длины. Изменения свободной энергии G0 на различных стадиях отщепления С2-фрагмента приведены в таблице 7, из которой видно, что общий перепад G0 в 47,73 кДж/моль используется мелкими долями в ряде частных реакций. Это обстоятельство характерно и для других сложных биохимических процессов.
В результате β-окисления жирных кислот образуется значительное количество молекул ацетилкоэнзима А, соответственно числу С2-фраг- ментов. Так, например, из одной молекулы пальмитиновой кислоты образуется восемь С2-фрагментов, т. е. восемь молекул ацетилкоэнзима А. Как и аэробный распад углеводов, окисление жирных кислот приводит к образованию ацетилкоэнзима А, который образует как бы общее русло, в которое сливаются оба основных потока промежуточного метаболизма.
При протекании в обратном направлении реакции из таблицы 7 приводят к удлинению цепи (биосинтезу) жирных кислот, причем на конечной стадии ацетилкоэнзим А с длинной R-цепью реагирует с глицерофосфатом или глицерином с образованием нейтральных жиров.
Направление процесса в сторону распада или синтеза жирных кислот в значительной мере зависит от относительного количества ацетилкоэнзима А и свободного KoASH. При избытке углеводов создается избыток ацетилкоэнзима А и недостаток KoASH, что приводит к замедлению распада и усилению синтеза жиров; недостаток углеводов усиливает распад жиров. Взаимосвязь этих двух основных процессов обмена имеет важное значение для баланса энергетических затрат организма.
7.4. ЦИКЛ ТРИКАРБОНОВЫХ КИСЛОТ
Ацетилкоэнзим А – важнейший промежуточный продукт метаболизма углеводов и жирных кислот. Достаточно указать, что 2/3 С-атомов углеводов и все С-атомы жирных кислот (а также приблизительно поло-
195
вина С-атомов аминокислот) проходят через стадию образования ацетилкоэнзима А. Подсчитано, что при суточной норме питания человека в 400 г углеводов, 70 г жиров и 100 г белков в организме человека ежесуточно возникает около 350–400 г уксусной кислоты, главным образом, в виде ацетилкоэнзима А.
Обратимость ряда реакций его образования способствует взаимодействию различных видов обмена (жирового, белкового, углеводного) в организме. С другой стороны, после образования ацетилкоэнзима А значительная часть его окисляется до СО2 и Н2О, поставляя основную часть, энергии метаболических процессов. Дело в том, что на пути образования ацетилкоэнзима А используется лишь небольшая часть свободной энергии питательных веществ.
В процессе гликолиза, на пути от глюкозы до пировиноградной кислоты, расходуется всего около 5–7% свободной энергии углеводов. Если изменение свободной энергии при полном окислении глюкозы составляет G0 = −2872,14 кДж/моль, то на пути от одной молекулы глюкозы до двух молекул молочной кислоты расходуется лишь G0 = −209,34 кДж/моль или около 7%, а на пути от одной молекулы пировиноградной кислоты до одной молекулы ацетилкоэнзима А G0 = −251,21 кДж/моль, т. е. около 9%.
Значительно выше изменение G0 на пути от одной молекулы пальмитиновой кислоты до восьми молекул ацетилкоэнзима А;
G0 = −9776,18 – 8(–866,67) = –2842,84 кДж/моль, что составляет около
30% от изменения свободной энергии при полном окислении пальмитиновой кислоты. Остальное количество свободной энергии выделяется именно на стадии полного окисления ацетилкоэнзима А. Поскольку коэнзим A (KoASH) при этом не деградирует, а отщепляется, то основное значение, следовательно, имеет просто реакция окисления уксусной кислоты
СН3СООН → 2СО2 + 2Н2О,
где G0 = −866,67 кДж/моль. При окислении углеводов эта реакция даёт до 80–85%, а при окислении жирных кислот – до 70% от общего измене-
196
ния свободной энергии. Этот процесс полного окисления активированной уксусной кислоты до СО2 и Н2О как раз и происходит в цикле трикарбоновых кислот (ЦТК или цикл Кребса), который, таким образом, имеет основное значение для энергетики организмов.
Замечательно, что цикл Кребса, подобно основным стадиям гликолиза, имеет универсальное значение для всего биологического мира – простейших, микроорганизмов, растений, насекомых, птиц и млекопитающих, вплоть до человека. Как и процессы окисления жирных кислот, цикл Кребса локализован в митохондриях, которые, таким образом, являются энергетическим центром живых клеток.
Суммарная реакция окисления уксусной кислоты связана с выделением большого количества энергии ( G0 = −866,67 кДж/моль). Поэтому, естественно, что она протекает в организме через ряд промежуточных реакций с участием большого числа различных ферментов и представляет собой многоступенчатый процесс, подобно ранее рассмотренным процессам распада углеводов или окисления жирных кислот.
Однако в данном случае цепь промежуточных реакций образует отчетливый замкнутый цикл, который служит одним из наиболее характерных примеров важной роли циклических превращений в биохимических процессах. Цикл Кребса получил название цикла трикарбоновых кислот (ЦТК) потому, что ряд веществ, входящих в цикл, относится к органическим кислотам, содержащим по три карбоксильные группы, т. е. являются трикарбоновыми кислотами. Фактически, однако, в цикл входит и ряд дикарбоновых кислот.
При каждом обороте цикла происходит полное окисление одной молекулы уксусной кислоты.
Основные реакции ЦТК с соответствующими изменениями свободной энергии приведены в таблице П3 Приложения.
Цикл трикарбоновых кислот тесно связан с обменом аминокислот, не только через ацетилкоэнзим А, но также через кетоглутаровую кислоту, которая может образоваться из глутаминовой кислоты, гистидина, аргинина и др., через щавелевоуксусную кислоту, которая может образоваться из аспарагиновой кислоты, тирозина, фенилаланина и др.
197
Наряду с приведенными выше данными о взаимосвязи обмена углеводов и жиров, связи ЦТК с обменом белков и аминокислот характеризуют глубокое переплетение процессов обмена всех основных питательных веществ. Можно ещё добавить, что ЦТК и ацетилкоэнзим А тесно связаны с обменом порфиринов и стероидов и, в частности, имеют существенное значение для их биосинтеза.
Многие процессы обмена (например, некоторые стадии гликолиза, обмен аминокислот и др.) имеют для энергетики организма сравнительно подчиненное значение; более существенно их значение для обеспечения необходимыми веществами различных процессов биосинтеза.
С другой стороны, окисление жирных кислот, аэробный распад углеводов, цикл трикарбоновых кислот являются основными источниками энергии организма, хотя, разумеется, образуемые в этих процессах промежуточные вещества являются необходимыми и для процессов синтеза. Материальная и энергетическая стороны процессов обмена веществ образуют единый, неразделимый процесс. В энергетическом отношении процессы распада питательных веществ в организме могут быть, по Кребсу и Корнбергу, достаточно отчетливо разделены на три стадии:
1)распад макромолекул биополимеров до мономеров – углеводов до моносахаридов, белков до аминокислот и жиров до глицерина и жирных кислот, когда освобождается лишь небольшая часть энергии (0,1–0,5%); это характеризует и небольшую роль конфигурационной энтропии;
2)превращение перечисленных мономеров в пировиноградную кислоту, ацетилкоэнзим А и некоторые другие члены ЦТК, когда освобождается 15–30% энергии;
3)окисление в цикле трикарбоновых кислот, в котором выделяется до 70–80% энергии.
Однако дело заключается не только в суммарном выделении энергии, что могло бы удовлетворить потребности организма в теплоте. Наиболее существенное значение для организма имеет возможность использования выделяемой свободной энергии для совершения различных видов
198
работы – механической, осмотической, электрической и др., но для этого организм имеет лишь один путь – накопление свободной энергии в соединениях с высоким потенциалом переноса групп, прежде всего в АТФ. Поэтому вопрос о полезном использовании свободной энергии метаболических процессов сводится прежде всего к вопросу о сопряжённом образовании молекул АТФ и аналогичных соединений.
Процесс гликолиза сопровождается образованием двух молекул АТФ с полезным выходом (КПД) около 40%. Этот процесс называется
анаэробным фосфорилированием.
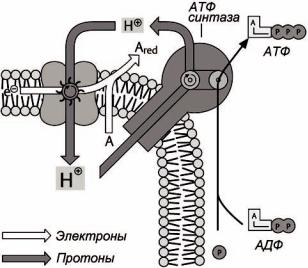
Для целого ряда других процессов – для окислительных стадий ЦТК, окисления жирных кислот, для окисления молочной кислоты и глицерина до пировиноградной кислоты фосфорилирование осуществляется при переносе протонов и электронов по цепи окислительных ферментов от субстрата до молекулярного кислорода; механизм этого процесса подробно рассматривается в курсах биохимии и молекулярной биологии. Сопряжение фосфорилирования с окислением при участии кислорода назы-
вается окислительным фосфорилированием (рисунок 18).
Рисунок 18 – Схема окислительного фосфорилирования
199
