
- •Літературний огляд
- •Висновки та постановка завдання досліджень
- •Експериментальна частина
- •2.3 Матеріали, устаткування і методика досліджень
- •Отримані порошкові систем Fe – Ti – c (b4c) суміші є лігатурою для приготування шихт призначених для процесу гарячого штампування. Вихідні склади шихт для процесу гарячої штампування мелють склад:
- •3. Обговорення результатів
- •Висновки
- •Список використаної літератури
- •Присвячена 50-річчю заснування фтімс нан України
- •Запрошення і програма конференції
- •Програма роботи конференції
- •28 Травня 2008 року
- •Секція 1 - Плавлення та позапічна обробка металів і сплавів.
- •Секція 2 - Розливання, формоутворення та кристалізація металів і сплавів.
- •29 Травня 2008 року
- •Секція 3 - Металознавство та термічна обробка матеріалів.
- •Секція 4 - Нові прогресивні матеріали і технології їх одержання.
- •Секція 4 - Нові прогресивні матеріали і технології їх одержання.
- •Організаційний комітет конференції:
Експериментальна частина
Теоретичні та технологічні основи отримання композитів на основі системи карбід титану – сталь
Основні структурні та технологічні особливості карбідосталей
Серед зносостійких матеріалів, що виготовляються методами порошкової металургії, отримали широке застосування карбідосталі – композити, що складаються з карбідів масовою часткою від 10 до 70 % та металевої зв’язки з як правило, легованої сталі. В якості основного карбіду для карбідосталі найчастіше використовується карбід або диборид титану.
Карбідосталі спочатку розроблялися як сплави, за своїми властивостями проміжні між інструментальними сталями та твердими сплавами. Місце псевдосплавів карбіду титану з сталевою матрицею наглядно можна представити на рис. 2.1.
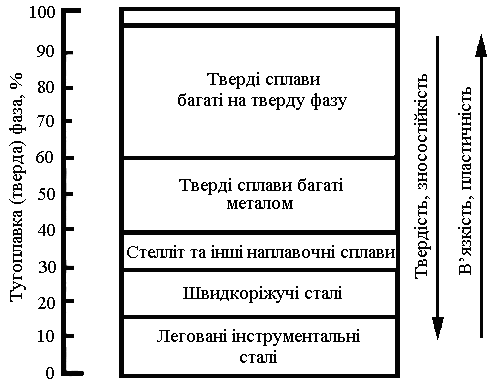
Рисисунок 2.1 Вплив об’ємного вмісту твердої фази на зносостійкість та основні механічні властивості матеріалів [43]
Традиційні карбілосталі з 40 – 60 % об’ємної частки ТіС є твердими сплавами, багатими на метал. Об’ємний вміст тугоплавкої фази в карбідосталях значно більше, ніж в інструментальних сталях, але менше, ніж в традиційних твердих сплавах. Це дозволяє після відпалу піддавати їх всім видам механічної обробки, а після гартування та відпуску карбідосталі мають відносно високу твердість та зносостійкість, в деяких випадках не поступаючись відповідним характеристикам традиційних твердих сплавів, однак завдяки високому вмісту металевої фази у них суттєво вищі пластичність та в’язкість.
Властивості карбідосталей в значній мірі залежать від властивостей тугоплавкої та металевої складових, а також від міцності адгезійного зв’язку між ними. Остання повинна мати той же порядок, що й міцність cкладових псевдосплаву, причому основну роль при утворенні між ними міцного адгезійного зв’язку відіграє змочування тугоплавкої фази розплавом та між фазна поверхнева енергія на границі розподілу тугоплавкої фази та металевої зв’язки [43].
При виборі складових карбідосталей необхідно також враховувати термодинамічну сумісність фаз. Це означає, що між твердою фазою та металевою зв’язкою не повинно спостерігатися значного взаємного розчинення або відбуватися відчутної хімічної взаємодії з утворенням нових крихких фаз. Нарешті, при виборі компонентів необхідно враховувати також їх термохімічну взаємодію, тобто компоненти сплаву повинні, по можливості, мати близькі коефіцієнти термічного розширення, бо при їх суттєвій різниці виникають відчутні термічні напруження на міжфазній границях, що зменшує міцність останніх [43]. В зв’язку з цим, найуживанішою основною твердою фазою для отримання карбідосталей так як і для отримання твердих сплавів, є переважно, карбіди перехідних металів. Так, в переважній більшості твердих сплавів використовується в основному монокарбід вольфраму WC завдяки його унікальним властивостям серед інших твердих металоподібних сполук. Він має найбільший модуль пружності Е в сполученні з деякою пластичністю при кімнатній температурі [44]. Тверді сплави на основі WC відрізняються високою зносостійкістю в поєднанні з високими властивостями міцності [45]. В той же час, для використання в якості твердої фази карбідосталі з точки зору економічної та технічної доцільності найбільше поширення знаходять тугоплавкі сполуки титану (головним чином – TiC та Ti(C, B)). Такий вибір зумовлений, в першу чергу, достатньо високими характеристиками твердості та пружності в цих сполуках [43].
Карбід титану по мікротвердості переважає більшість інших карбідів перехідних металів (див. таб. 2.1). Він має високу термодинамічну стабільність в металевих розплавах, високу температуру плавлення, низьку щільність, високу корозійну стійкість [44]. Неменш важливо, те що вихідна сировина для виробництва TiC не є дефіцитною.
Недоліками карбіду титану в порівнянні з WC є його висока крихкість, великий коефіцієнт термічного розширення, низька теплопровідність, відносно гірше змочування металами, більш низька гаряча міцність у порівнянні з WC. Принциповою різницею TiC від WC є те, що він має широку область гомогенності та здатен утворювати широкі області твердих розчинів з іншими карбідами металів IV a … VI a підгруп [43, 44].
Аналіз структурних діаграм, контактна взаємодія та змочування в системах сплавів Fe – Ti – C – В
Вибір оптимальних по властивостям та складу композитів на основі системи Fe – Ti – C, режимів їх спікання та термічної обробки заснований на аналізі відповідних діаграм стану системи.
Перед тим як перейти до розгляду діаграми стану потрійної системи, коротко зупинемося на і розглянемо бінарні системи Fe – Ti та Ті – С.
Таблиця 2.1 – Основні фізико – механічні характеристики карбідів, боридів та нітридів перехідних металів IV a … VI a підгрупи [239, 241]
|
Сполука |
Е, ГПа |
Мікротвердість |
α×106, К-1 |
λ, Вт/(м×К) |
Тпл, К |
γ, кг/м-3 |
σзтиснення, ГПа |
|
TiC ZrC HfC VC NbC TaC Cr3C2 Mo2C WC |
494 410 480 495 479 550 370 531 737 |
3000 2800 2600 2880 2170 1830 1500 1830 1890 |
7,59 7,01 6,80 7,25 7,21 7,8 11,7 7,8 3,9 |
6,8 11,6 16,3 9,8 15,0 31,8 19,1 31,8 29,3 |
3530 3803 4233 2898 3660 2792 2103 2792 3054 |
4930 6730 12600 5360 7560 9040 6680 9040 15700 |
1,38 1,60 — 0,62 2,42 1,75 1,05 — 2,72 |
|
TiN ZrN HfN VN NbN TaN |
390 374 480 390 484 576 |
1950 1500 1670 1300 1830 1440 |
9,35 7,24 6,90 9,20 10,1 3,6 |
41,8 28,2 19,0 2,9 4,2 5,5 |
3220 3260 3580 2300 2323 3360 |
5430 7090 11700 6040 8400 13800 |
1,30 1,00 — — — — |
|
TiB2 ZrB2 HfB2 VB2 NbB2 TaB2 CrB2 Mo2B5 W2B5 |
541 496 480 340 638 687 450 672 775 |
3370 2250 2900 2800 2590 2540 2070 2330 2660 |
4,6 5,9 6,3 6,1 8,0 8,2 10,5 8,6 7,8 |
66,4 57,9 51,0 42,2 24,0 16,0 31,8 50,2 25,9 |
3063 3473 3523 2673 3050 3473 2473 2473 2640 |
4380 6170 10500 5100 6970 12380 5220 7010 11000 |
1,35 1,59 — — — — 1,28 — — |
В системі Fe – Ti (рис. 2.2) існує дві інтерметалідні фази: Fe2Ti, що містить близько 30,0 % Ti, та FeTi с 46,17 % Ti з температурами плавлення відповідно 1427 та 1317 °С. Сполука Fe2Ti має більш широку область гомогенності (близько 10 % ат. долей при 1300 °С), ніж FeTi (не більше 4 % ат. долей). Температура евтектичного перетворення Fe + Fe2Ti складає, по даним роботи [46], близько 1289 °С, однак в літературі приводяться і інші значення (по даним [47] – 1340 °С).
Гранична розчинність титану в -Fe, при температурі евтектики досить висока і складає, по даним різних дослідників, від 8 до 13,74 % ат. [41]. При зниженні температури розчинність різко зменшується, складаючи при 700 °С близько 2,3 % ат. Розчинність Ti в -Fe більш низька: максимально 0,70,9 [46] і навіть 0,2 % ат. [43] при 1100 0С.
В системі Ti – C й досі не існує єдиної думки про температуру плавлення карбіду титану: різні автори вказують температури від 2940 до 3250 °С [46, 47]. Максимальний вміст вуглецю в TiC змінюється від 50 % ат. (20 % мас.) при температурі евтектики TiC + С близько 2900 °С, до 47,8 % ат. при температурі евтектики -Ti + TiС при 1645 °С (Рис. 2.3).
Карбід титану має широку область гомогенності: низьковуглецева границя діаграми розміщена при температурі евтектики -Ti + TiС, по даним різних авторів від 18 до 33 % ат., що відповідає складам від TiС0,22 до TiС0,49 [43]. Високовуглецева границя точно не встановлена. При температурі евтектики TiС + С (2776 °С) склад карбіду близький до TiС1,0, а область гомогенності зазвичай приймається в межах TiС0,48 – TiС0,98 [40].
Система залізо – титан – вуглець відноситься до групи систем Me - C - Me, где Me – перехідний метал IV a підгрупи, Me – метал групи заліза, типовим для якого є квазібінарна рівновага евтектичного типу між MeC та Fe, Co або Ni [48]. Однак, квазібінарна рівновага існує лише в достатньо вузьких межах складу карбіду в області гомогенності, близькому до стехіометричного складу. При зниженні або підвищенні вмісті вуглецю за межами квазібінарної рівноваги з’являються надлишкові фази, що зазвичай призводять до зниження механічних властивостей сплавів.
Дослідження
системи Fe
– Ti
– C,
результати яких приведені в публікаціях
[49], дозволили визначити, що в останній
існують наступні тверді фази:
та
тверді розчини на основі титану, графіт,
інтерметаліди FeTi
та Fe2Ti,
тверді розчини заліза
та
і карбідна фаза TiC.
Потрійних сполук, що зайдені, наприклад,
в системах MeC
– Me,
а також подвійних карбідів титанут або
заліза не знайдено. Щодо твердо фазної
розчинності Ti,
Fe
і
C,
то не перевищує 2
% ат.
в більшості фаз аж до температури
плавлення. Розчинність Fe
в TiC0,9
при 1475 °С
складає близько 1
ат. %,
а у відповідності до [47]
– 0,7 мас. %
при 1100 °С.
Твердофазна
розчинність TiC
в -Fe
або
-Fe
при будь-яких аж до температури евтектики
(1475 °С)
не перевищує 0,6
мас. %
і швидко знижується зі зниженням
температури: 0,2
% при 1200 0С
та
0,04 % при 920 °С [50].
Розчинність вуглецю в фазах Fe2Ti
та FeTi
згідно даним [49] не перевищує 0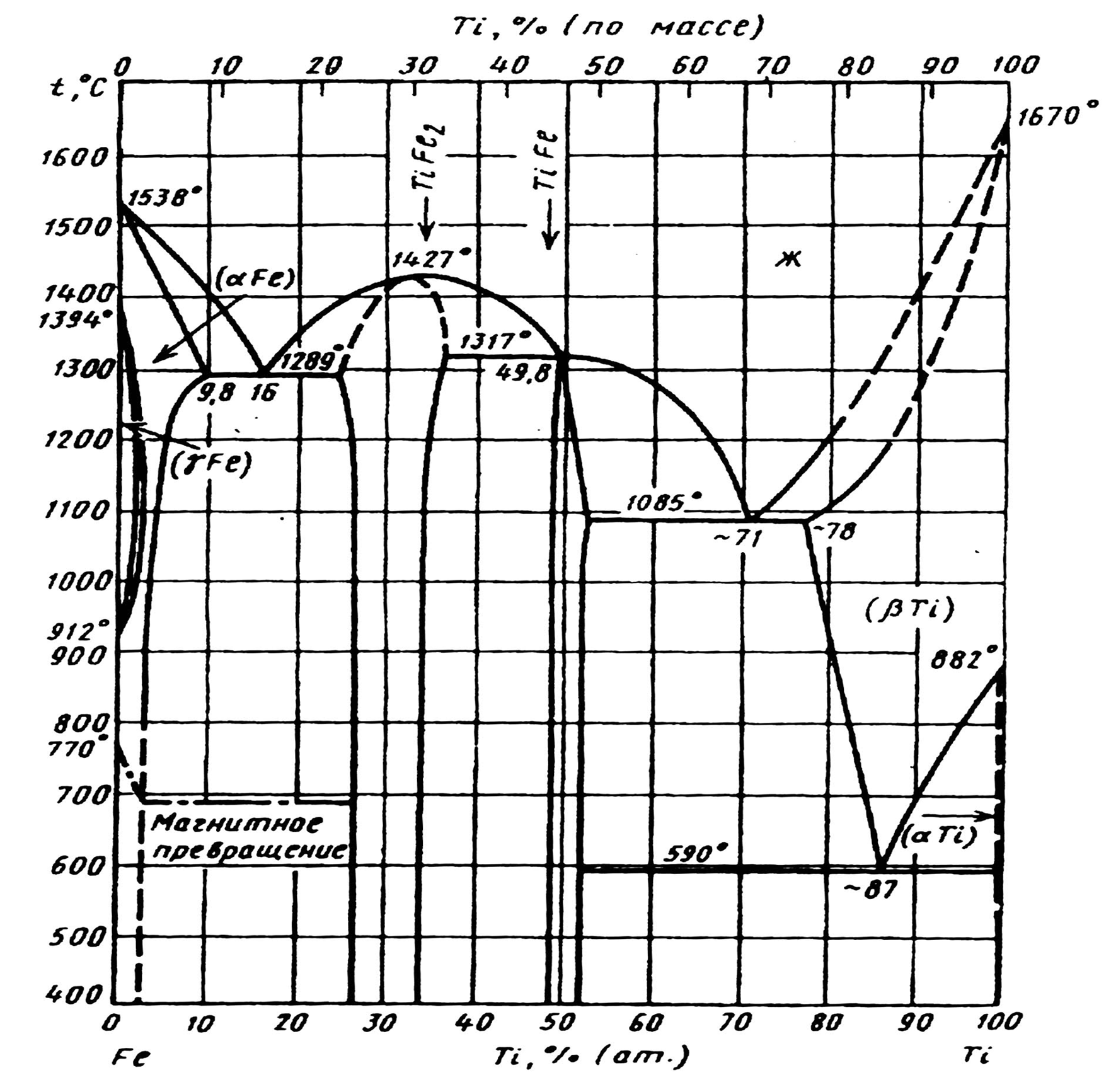 ,2
мас.% (2,4
ат. %) і
0,1 мас. % (0,85 ат.
%) відповідно.
,2
мас.% (2,4
ат. %) і
0,1 мас. % (0,85 ат.
%) відповідно.
Р исунок
2.2
– Діаграма
стану
системи
Fe
–
Ti
исунок
2.2
– Діаграма
стану
системи
Fe
–
Ti
Рисунок 2.3 Діаграма стану системи Ti – С
На Рис. 2.4 а, б представлені ізотермічні перерізи діаграм системи Fe – Ti – С, отримані в різний час в роботах [49]. Для обох приведених перерізів діаграми характерна наявність областей фазової рівноваги: + -Fe; + -Fe +
Рисунок
2.4
Ізотермічні перерізи діаграми стану
системи
Ti – C –
Fe при 1000
(а) та
1100 0С
(б) 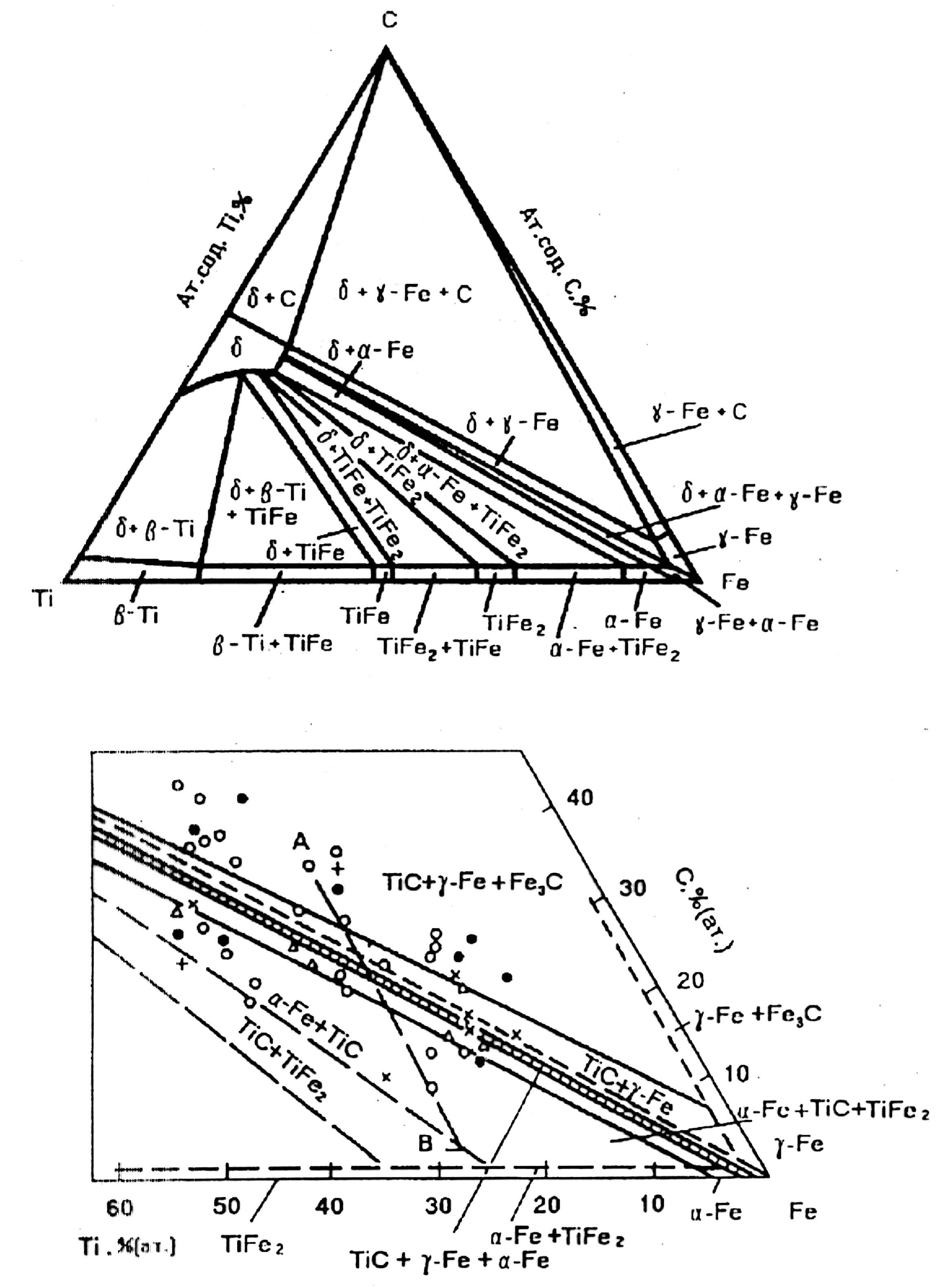
-Fe, -Fe + . Ці області головним чином цікаві тим, що оскільки саме в них знаходяться склади сплавів, маючих практичне значення. В той же час, дані приведені в [49] відрізняються від даних [48] існуванням трьохфазної області TiС + Fe3C + -Fe, що вказує на той факт, що підвищення концентрації вуглецю в сплаві TiС – Fe веде до появи не вільного вуглецю, як у відомих системах Ti – Ni - C або Ti – Co – C, а цементиту Fe3C. При цьому, дані отримані з обох робіт схожі тим, що при зміщенні по діаграмі стану в сторону зменшення в сплаві заліза, ширина областей + -Fe + -Fe і + -Fe зменшується, а областей -Fe + збільшується. З чого слідує, що зі збільшенням в сплаві вмісту TiC зменшується можливість отримання сплавів, що можна піддати гартуванню, через те що зі зменшенням вмісту вуглецю нижче лінії:
+ -Fe + -Fe = + - Fe
сплави стають нетермооброблюваними в зв’язку з відсутністю переходу.
Неоднозначна думка різних дослідників відносно температури протікання двох псевдобінарних евтектичних реакцій:
L = TiC + Fe2Ti і L = TiC + -Fe.
Так, по даним [49] ці значення складають 1370 °С и 1475 °С відповідно, в той же час [47] вказують на значення температури 1350 и 1520 °С. Дані отримані В.Н. Єременко щодо реакції L = TiC + -Fe близькі за температурою перетворення (1460 °С) до даних [49], однак різняться у визначенні складу евтектики: 3,8 % мас. TiC (7 мол. %) по даним [50] при 13 мол. % TiC в роботі [49]. В той же час склади евтектик, отримані в роботах [46] и [49] досить близькі.
Формування структури карбідосталі, а отже, її основні властивості в значній мірі залежать від характеристик змочування застосовуваної сталі – зв’язки по відношенню до тугоплавкої фази, температурної залежності зміни краєвого кута змочування q карбіду титану сталлю, вихідного стану компонентів по вмісту домішок, що впливають на термокінетичні параметри процесу спікання. Змочування забезпечує тісний контакт на міжфазній поверхні тверде тіло – рідина та, таким чином, міцний зв'язок на контактній поверхні тугоплавкої та металевої фази отриманого композиту. Крім того, змочування в значній мірі визначає рівномірність розподілення твердої та металевої фаз в об’ємі матеріалу [41].
Значний інтерес представляє можливість оцінити впливу легування заліза різними елементами на змочування карбіду титану. При цьому, в першому наближенні характеристику змочування можна оцінити виходячи із значення поверхневого натягу розплаву gжт, зменшення якого призводить до зменшення краєвого кута змочування. У відповідності до роботи [51] поверхнево – активні елементи, що знижують gжт є: Cu, B, Si, Zr, P, O, S, Cr, Sb, As, Mn, Ni. Поверхнево неактивним є: C, N, V, Co, а підвищують значення gжт Ti, Mo, W.
В літературі приведено багато даних щодо змочування карбіду титану залізом та сплавами на його основі [51 - 54 та ін.]. Головним чином, інтерес представляють, дані про змочування TiC в вакуумі, оскільки технологічні процеси отримання карбідосталей (спікання, просочування) проводяться, як правило, в вакуумі. В середовищі аргону та особливо водню залізо та його сплави змочують карбід титану помітно гірше [52], що можна пояснити наявністю певної кількості залишкового кисню в застосовуваних захисних газах та погіршенням очищення оксидних плівок в газах на відміну від вакууму.
Краєвий кут змочування TiC чистим залізом по даним більшості авторів становить 40 °, в той час як змочування карбіду титану сплавами заліза може, в залежності від складу сплаву, чистоти карбіду та температури, змінюватися в широких межах від 0 до 82° [52, 53].
Автори роботи [54], досліджуючи контактну взаємодію карбіду титану зі сплавами на основі заліза в температурному інтервалі 1480 – 1500 °С, показали, що добавки Ni, Cr і Si, введені в залізо, поліпшують його адгезію до карбіду титану, тобто є міжфазноактивними елементами, а також сприяють формування гетерофазної, дрібнозернистої структури контактної зони взаємодії. При цьому, для кожної з розглянутих добавок існує її оптимальний вміст в сплаві, що мінімізує краєвий кут змочування. Так, зі збільшенням вмісту нікелю в сплаві до 12 мас. % контактний кут збільшується до 54 °, а потім, при вмісті нікелю 20 – 30 мас. % – зменшується до 11 °. Оптимальне значення вмісту хрому в Fe – Cr сплаві, що забезпечує кут змочування карбіду титану в межах 30 – 34 °, складає 11 – 16 мас. %. Більш високі адгезій ні характеристики по відношенню до TiC забезпечують Fe – Si сплави, що пояснюється досить високою міжфазною активністю кремнію. При вмісті кремнію в сплаві 2,9 мас. % краєвий кут складає 18 °, та досягає нульового значення при 5,4 мас. % [54]. Іншим сильним розкислювачем є – алюміній, також проявляє в розплавах Fe – Ni та Fe – Cr значну між фазну активність, призводячи до значного зменшення та підвищенню роботи адгезії.
Певний інтерес представляє питання впливу вмісту вуглецю в сталевій зв’язці на змочування карбідної складової. Автори роботи [52] показали, що при нагріванні в вакуумі рівновісні та нерівновісні кути змочування карбідів (TiC та ZrC) розплавами Fe – C збільшуються при підвищенні вмісту вуглецю в залізі від 1 до 4 %. Зростання значення при збільшенні вмісту вуглецю в сталі від 0,6 до 1,0 % відмічено в роботі [54]. Ці дані відповідають загальним уявленням про змочування, згідно до яких по мірі наближення системи до стану рівноваги, що відбувається при збільшенні вмісту вуглецю в сталі, взаємодія між карбідом та рідким металом послаблюється, а значення , відповідно, збільшується [52].
Ступінь змочування карбідів в деякій мірі змінюється, також, зі зміною складу карбідної фази. Для системи карбід – метал з хімічною взаємодією на міжфазній границі величина θ зменшується разом зі збільшенням дефектності карбіду по вуглецю [53]. Поліпшення змочування може бути досягнуто, також, шляхом легування TiC карбідами перехідних металів V а та VI а підгруп, що краще змочуються металами групи заліза, ніж карбіди перехідних металів Iv а підгрупи, до яких належить TiC. Одним з прикладів такого підходу є ефект зниження при змочуванні подвійного карбіду (Ti, Nb)C нікелем [52].
Теоретичні принципи формування боровмісних композитів на основі залізовуглецевих сплавів
Застосування бору як основний легуючий елемент для виготовлення зносостійких порошкових композицій на основі сплавів заліза обуславліваєтся цілим рядом його унікальних властивостей. Так, автори [45] вважають, що використання бору (разом з ванадієм, титаном, ніобієм і так далі) відкриває принципово нові можливості для отримання економнолегированних сталей, експлуатаційні характеристики яких у багатьох випадках не тільки не поступаються, але і перевершують рівень властивостей сталей, що отримуються із застосуванням традиційної системи легування. Вибір бору, окрім того, цікавий тим, що його евтектичні сплави із залізом мають, як правило, вищу температуру плавлення, ніж чавун, добре змочують твердофазне залізо, відновлюють оксиди і, що особливо цінно, схильні до гетерогенізації при взаємодії з іншими легуючими елементами.
Аналіз діаграми стану Fе B (рис.2.10) показує, що введення бору значно знижує температуру плавлення заліза; що знаходиться в лівій частині діаграми стану евтектика, що складається з α-Fe і бориду Fe2В, має мінімальну в системі Fe-В температуру плавлення 1200 0С
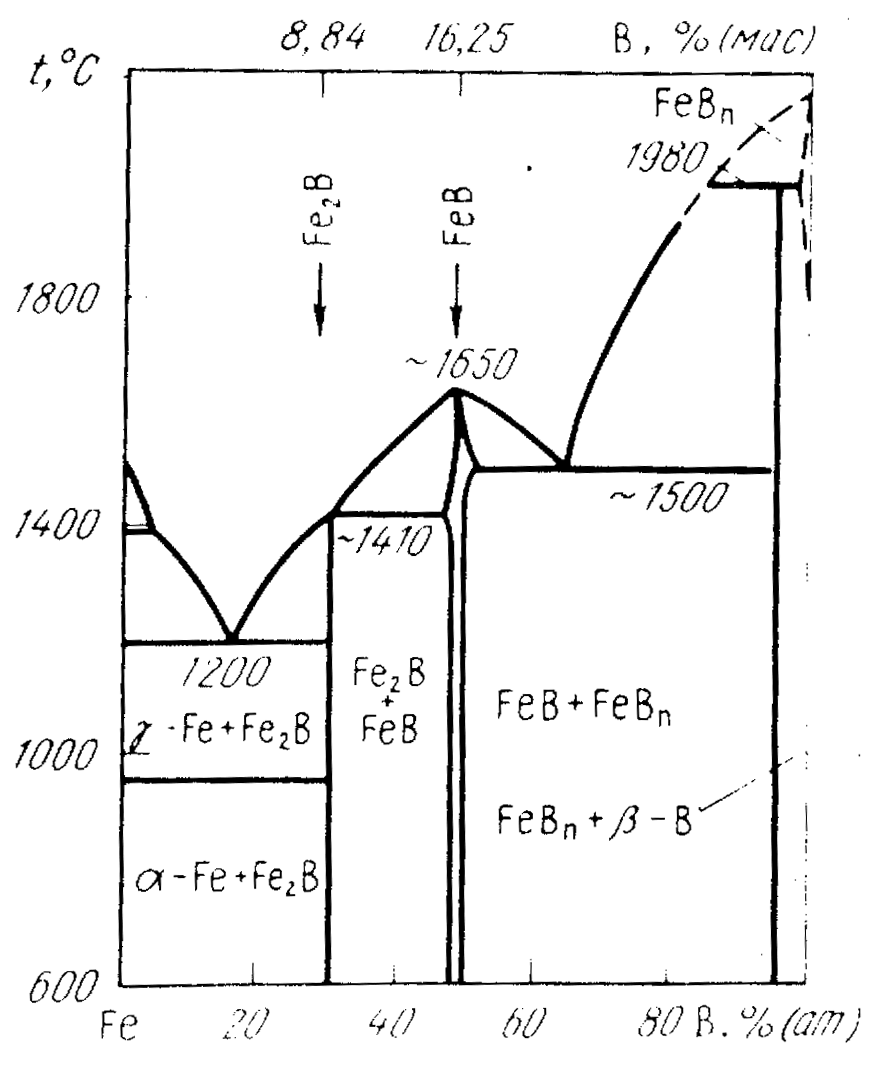
Рисунок 2.5. Діаграма стану системи Fe – B
Борид заліза, як вказують автори [53], характеризується високою твердістю, зносостійкістю, жаростійкістю і корозійною стійкістю. Ці властивості бориду заліза використовують, зокрема, для поверхневого борування сталей в газовій, рідкій або твердій борвмісній фазі [55, 56].
Аналіз теоретичних уявлень про механізм легування металів бором вказує на несприятливі умови впровадження і заміщення заліза бором при боруванні, оскільки для цього потрібна в 300 разів більше енергія деформації ніж, наприклад, для впровадження в залізо атомів вуглецю [55].
В той же час, в евтектичних сплавах металів групи заліза з бором відбувається утворення боридних з'єднань при вельми низьких енергетичних витратах і температурах ( Т = Тпл. - Тэвт. = 300 400 0С) [56]. Відмічені закономірності приводять до висновку про можливість використання тиких чинників для вибіркового легування заліза, яке полягає в тому, що при формуванні композиційних матеріалів на його основі в процесі спікання проводиться переважне насичення бором і боридоутворюючими елементами лише евтектичною складовою композиту. Така можливість досягається завдяки низькій розчинності бору в залізі (до 0,08 %) [45] при високому коефіцієнті відношення діаметру їх атомів dВ/dFe = 0,76 [55], внаслідок чого дифузії бору з рідкої фази в залізний каркас аж до його плавлення ускладнюється і практично весь бор витрачається на утворення боридних з'єднань в евтектичній фазі з утворенням істотно гетерогенної структури формуємого матеріалу.
Згідно діаграми стану системи залізо бор [45] в цікавій для практичного застосування її частини утворюються два боридних з'єднання Fe2В та FeВ.
Напівборид заліза Fe2В утворюється при змісті бору 8,84 % (мас.). Він має тетрагональну просторово-центровану кристалічну гратку з параметрами а = 5,109 10-10 м, с = 4,249 10-10 м і відношенням с/а = 0,832. Піктометрична щільність Fe2В знаходиться в межах 6,93 до 7,30 г/см3, температура плавлення 1410 0С.
При еквімолярному відношенні компонентів в даній системі утворюється моноборид заліза FеB з масовим вмістом бору 16,25 %. Він має ромбічну структуру; параметри його грат рівні: а = 4,061 10-10 м, в = 5,506 10-10 м, с = 2,952 10-10 м, піктометрична щільність від 6,47 до 6,8 г/см3 і температура плавлення 1650 0С [45]. При цьому, моноборид є стійкішим, ніж напівборид заліза.
При утворенні бориду заліза атом металу прагне до захоплення валентних електронів бору і заповнення ними 3d-полосы заліза, у зв'язку з чим щільність станів в d-полосе збільшується із зростанням вмісту бору в бориді. Це приводить до перерозподілу валентно-активних електронів між зв'язками різних типів таким чином, що загальна міцність міжатомного взаїмодествія збільшується в результаті посилення ковалентного зв'язку В В. Одночасно з переходом від Fe2В до FеB змінюються властивості бориду заліза: збільшується питомий електричний опір і температура плавлення, зростають мікротвердість і модуль пружності [45].
Структурні особливості будови граток бориду заліза обох типів, ізольованість атомів бору в гратах бориду FеB обумовлює їх специфічні властивості, зокрема високу твердість, тугоплавкість і електропровідність.
Висока мікротвердість бориду (близько 15000 і 20000 МПа відповідно) зумовлює також їх високу крихкість. Твердість бориду і її збереження до високих температур 850 900 0С обумовлена енергетичною стабільністю. Легуючі елементи молібден, вольфрам, марганець і хром, підвищують твердість бориду Fe2В, а алюміній і мідь, навпаки, знижують, тоді як на твердість бориду FеB легуючі елементи впливають слабо [55]. Найбільш висока твердість бориду досягається тоді, коли хімічний зв'язок атомів з бором здійснюється електронами, що належать переважно атомам заліза, а атоми бору переходять в стан позитивно заряджених іонів. Зменшення енергії відбувається при зростанні концентрації нелокалізованих електронів за рахунок їх розпушуючої дії [54]. По міру збільшення частки нелокалізованих електронів різко підвищується крихкість боридних з'єднань. При цьому крихкість бориду FеB вища, ніж Fe2В.
Легуючі елементи, що ослабляють сили міжатомного зв'язку (алюміній, мідь, нікель) зменшують крихкість бориду FеB, а хром, марганець, молібден і вольфрам збільшує її [57].
Очевидно, що істотний вплив на властивості спеченого композиційного матеріалу надає склад боровмісног легуючого сплаву, використовуваного для введення в початкову шихту бору. За даними роботи [56] найбільш поширеними в світовій практиці боровмісними легуючими сплавами є феробор (12 20 % B; 2% Si; 2% Al; 0,10% C) і силікобор (2 3 % B; 40 45 % Si; 0,2 % Al; 0,05% C). Проте, враховуючи відсутність промислового виробництва порошків вказаних сплавів, а також наявність в їх складі часто небажаних сторонніх складових (Si, Al), в якості основного борвмісного легуючого сплаву прийнято використовувати карбід бору.
