
- •Основные понятия фармакологии. Фамакокинетика, фармакодинамика и биодоступность.
- •Пути введения лекарства в организм.
- •Методология молекулярной модификации.
- •1. False positives, электрофилы, реагируют с белками. Выявляется не sar, а srr (structure-reactivity relationship).
- •1. Увеличение метаболической стабильности (холестериновый ингибитор абсорбции)
- •2. Кинезин связывающий белковый ингибитор (Уменьшение показателя pKa)
- •Количественный анализ “активность-структура” (qsar).
- •Биологическая мишень и строение лекарственного средства. Модель “идеального лекарства”.
- •Зависимость фармакотерапевтического эффекта от свойств лекарственного средства и условий применения: химическое строение, физико-химические свойства.
- •Ферменты. Ингибиторы и активаторы ферментов. Мутация ферментов патогенных микроорганизмов.
- •Строение и свойства биологических барьеров.
- •Рецепторы - классификация, строение, свойства.
- •14. Современные методы изучения строения биологической мишени.
- •Условия для ямр -эксперимента
- •15. Скрининг, молекулярная модификация, метаболизм лекарств, аналоги переходного состояния, суицидные ингибиторы ферментов, аффинные модификации активного центра.
- •Критерии отбора веществ - кандидатов для скрининга
- •Биотесты (скрининг) – 1 этап (in vitro)
- •Метаболизм (фаза 1)
- •Метаболизм (фаза 2)
- •16. Принцип антиметаболитов в умозрительном дизайне лп. Определение активной группы в семействе подобных лп – принцип фармакофора.
- •17. Современные методы изучения взаимодействия лекарство-рецептор (активный центр фермента).
- •18. Способы увеличения биодоступности. Пролекарства.
- •19. Пассивное и активное высвобождение.
- •20. Дисперсии: нанокристаллы, наносферы, нанокапсулы, эмульсии, мицеллы, липосомы и др.
- •21. Липосомы как лекарственная форма https://revolution.Allbest.Ru/medicine/01041051_0.Html
- •22. Пассивное и активное нацеливание.
- •23. Днк, олигонуклеотиды и их аналоги как лекарственные вещества (генная терапия, ас-терапия)
- •1. Твердо-фазный органический синтез
- •2. Жидкофазный органический синтез
- •3. Polymer assisted solution phase synthesis – pasp (Полимер-связанные реагенты и поглотители)
- •1. Параллельный синтез
- •2. Синтез Pool/Split
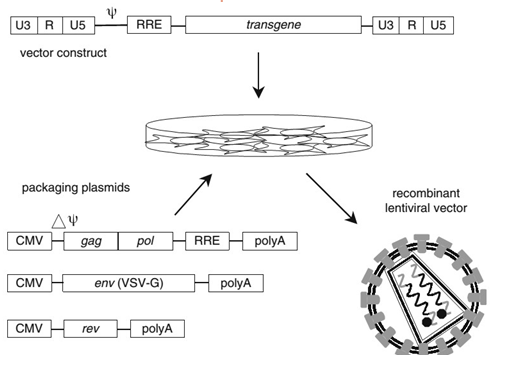
23. Днк, олигонуклеотиды и их аналоги как лекарственные вещества (генная терапия, ас-терапия)
Доставка ЛС с помощью генной терапии – вносим ДНК/РНК фрагмент, используя вирусный вектор (аденовирус) – в его геном встраиваем ДНК/РНК фрагмент.
«Антисмысловая» РНК , которую предполагается использовать в качестве лекарственного средства, представляет собой короткий (15-20-нуклеотидов) олигонуклеотид, который может связываться с комплементарным ей определенным участком мРНК и ингибировать трансляцию кодируемого ей белка, подавляя тем самым патологический процесс .
Терапевтический эффект синтетических «антисмысловых» олигонуклеотидов зависит от специфичности их гибридизации с доступным сайтом мРНК-мишени, устойчивости к действию клеточных нуклеаз и наличия системы доставки в клетку. 15-20-нуклеотидные последовательности гибридизуются с уникальными мРНК с достаточно высокой специфичностью. Потенциальные сайты-мишени определяют тестированием набора «антисмысловых» олигонуклеотидов с использованием культуры клеток, синтезирующих мРНК-мишень. Для этого проводят электрофоретическое разделение клеточных белков, в которые включают радиоактивную метку во время трансляции, и с помощью радиоавтографии устанавливают, в присутствии какого из «антисмысловых» олигонуклеотидов снижается синтез определенного белка. Никаких общих критериев выбора наилучших сайтов-мишеней в разных РНК-транскриптах не существует. Эффективными могут оказаться олигонуклеотиды, комплементарные 5'- или 3'-концам мРНК, границам экзонов и интронов и даже двухцепочечным областям. Антисмысловые олигонуклеотиды могут разрушаться внутриклеточными нуклеазами, поэтому важно защитить их от действия последних так, чтобы они не утратили способности к гибридизации с мишенью. Для этого можно модифицировать определенным образом пиримидиновые основания, рибозу или дезоксирибозу. Так, у наиболее широко применяющихся сейчас «антисмысловых» олигонуклеотидов свободный атом кислорода фосфодиэфирной связи заменен на группу SH, в результате чего образуется тиофосфатная связь. Модифицированные таким образом олигонуклеотиды растворяются в воде, несут отрицательный заряд и не расщепляются под действием эндонуклеаз. При гибридизации с сайтом-мишенью они образуют дуплексы, которые активируют рибонуклеазу (РНКазу), эндогенный фермент, расщепляющий мРНК в такой гибридной молекуле. Проведены первые клинические испытания таких олигонуклеотидов — лекарственных средств «первого поколения». Мишенями являются РНК цитомегаловируса, вируса иммунодефицита человека, а также мРНК генов, ответственных за развитие рака, болезней кишечника и других заболеваний.
Синтезированы «антисмысловые» олигонуклеотиды с фосфорамидитной и полиамидной (пептидной) связями - пептидные нуклеиновые кислоты. Такие молекулы очень устойчивы к действию нуклеаз.
Проникновение «антисмыловых» олигонуклеотидов в клетку можно значительно облегчить, поместив их в липосомы. Такая высокоэффективная система доставки позволяет использовать «антисмысловые» олигонуклеотиды в небольших концентрациях. Если же конъюгировать липосомы с антителами, специфичными к эпитопам определенных клеток тех или иных органов, то можно будет осуществлять адресную доставку «антисмысловых» олигонуклеотидов.
Проведенные доклинические испытания оказали, что «антисмысловые» олигонуклеотиды являются весьма эффективными лекарственными средствами.
Как правило, процесс поиска и конструирования лекарственных препаратов включает в себя три основные стадии: I. Поиск и конструирование соединений-лидеров (lead-compounds)*; II. Оптимизация соединения- лидера; III. Разработка лекарственного препарата
Поиск и конструирование соединений-лидеров Тотальный («through put») скрининг. Использование в качестве соединения-лидера уже известного(часто выпущенного на рынок) лекарства. Рациональное конструирование соединения-лидера.
Молекулярный
дизайн - молекулярное
конструирование синтетических лигандов
(i-L) и активных центров рецепторной
биомолекулы (Rac) путём правильного (на
основе данных РСА) компьютерного
манипулирования их геометрическими и
энергетическими параметрами с целью
добиться высокой степени комплементарности
между рецептором и лигандом, приводящей
к высокой биоактивности последнего
Критерии
отбора веществ- кандидатов для скрининга
•
1) Потенциальная активность
•
2) Низкая токсичность
•
3) Устойчивость
•
4) Доступность (синтетическая и
экономическая)
Биотесты
(скрининг) -1 этап (in vitro)
•
1) Биохимическое тестирование (на
ферменте) – ингибирование (активность)
•
2) Клеточные тесты (на живых клетках)
–
ингибирование, токсичность
•
3) На культурах тканей – токсичность,
активность
Скрининг
 Отбор
•
Хиты – есть желаемая активность
•
Лидеры – активность высокая, хорошая
фармакокинетика (особенно оральный
путь введения), низкая острая токсичность,
хорошая фармакодинамика, энантиомерная
чистота (у хиральных)
Отбор
•
Хиты – есть желаемая активность
•
Лидеры – активность высокая, хорошая
фармакокинетика (особенно оральный
путь введения), низкая острая токсичность,
хорошая фармакодинамика, энантиомерная
чистота (у хиральных)

Способы клеточного поглощения и прохождения лекарственными препаратами: (1) Прохождение через поры; (2) активное поглощение/выброс; (3) пассивная диффузия в цитоплазму; (4) пассивная диффузия через клетку; и (5) перицеллюлярный проход.
Изменение концентрации в тканях с течением времени

Captopril as example of a charge-charge interaction with the ACE receptor. Каптоприл как пример заряд-заряд взаимодействия с рецептором АСЕ.(цинк)
Zaleplon as example of ion-dipole and dipole-dipole interactions. Залептон как пример ион-дипольного взаимодействия.
Пролекарства. Спирты и кислоты. Амины
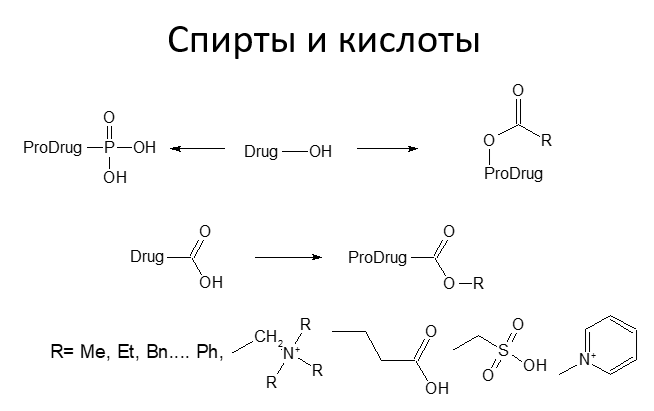

Схема усиленной проницаемости и удержания (ЭПР) эффекта "пассивного" нацеливания. (1) Наноноситель, нагруженный лекарственным средством; он не может экстравазироваться через нормальный эндотелий, и только небольшие молекулы свободного лекарственного средства (4) могут в определенной степени пересекать нормальный эндотелий в обоих направлениях; (2) промежутки между эндотелиальными клетками появляются в патологических областях (3) (таких как опухоли, инфаркты и воспаления), через которые наночастицы могут экстравазироваться и накапливаться в таких областях, создавая высокие локальные концентрации лекарственного средства

Носитель лекарственного препарата с молекулами лекарственного препарата в крови в области с аномальным рН или температурой носитель распадается, высвобождая свободный препарат\

Брюс Меррифилд. Твердофазный синтез.
Марио Гейсен (в настоящее время работает в университете Вирджиния, химический факультет) , заслуженный научный сотрудник Glaxo Wellcome Inc., с группой сотрудников в 1984 году разработал методику синтеза пептидов на pin-образных твердых подложках.
Арпад Фурка. Метод split-and-pool.
-В 1985 Richard Houghten представил метод, названный “tea-bag” для множественного быстрого пептидного синтеза. Метод “Чайного пакетика”. Полиэтиленовый пакет с мелкими дырочками, похожий на настоящий чайный пакетик, наполняется полимерной смолой и каждый пакетик помещается в различные реакционные сосуды для проведения реакции сочетания аминокислот. После реакции все пакетики собираются и совместно (в целях уменьшения количества затраченных времени и усилий) обрабатываются для снятия защитных групп и промывки. В этом методе пакетик играет роль фильтра и барьера между реакциями, и, если каждый пакетик помечен, можно определить структуру синтезированного пептида. Около 100 различных пептидов в микромолярных количествах могут быть синтезированы этим методом, что демонстрирует практический подход к параллельному синтезу.
Принципы комбинаторной химии: Генерирование Библиотек соединений из молекулярных билдинг- блоков.
Характеристикой комбинаторного синтеза является то, что различные соединения образуются одновременно при одинаковых условиях реакции. Коллекция этих синтезированных конечных соединений называется комбинаторной библиотекой. (библиотека соединений)
