
- •Сборник методических указаний к лабораторным работам
- •«Аналитическая химия»
- •Атомно-эмиссионная фотометрия пламени
- •Цель и задачи работы
- •Оборудование и реактивы
- •Программа работы
- •Определение калия по методу градуировочного графика
- •Приготовление стандартных растворов:
- •Подготовка прибора к работе:
- •Построение градуировочного графика
- •1. Цель и задачи работы.
- •Определение содержания натрия в анализируемом растворе.
- •1. Цель и задачи работы.
- •Определения содержания кальция в анализируемом растворе.
- •1. Цель и задачи работы.
- •Вопросы для самоконтроля
- •Сущность и основы метода ик-спектроскопии
- •Фурье спектрометр фсм 1201
- •Фотометрический анализ
- •Цель и задачи работы
- •Оборудование и реактивы
- •Определение концентрации ионов меди(II) в водных растворах дифференциальным методом и методом градуировочного графика
- •Приготовление стандартных растворов:
- •Приготовление раствора сравнения.
- •Выбор светофильтра
- •Определение меди(II) по методу градуировочного графика.
- •Определение меди(II) дифференциальным методом.
- •Определение титана (IV) методом градуировочного графика
- •Приготовление стандартных растворов:
- •Приготовление раствора сравнения
- •Определение титана (IV) по методу градуировочного графика
- •Определение фосфора в виде синего фосфорномолибденового комплекса методом градуировочного графика
- •Приготовление стандартных растворов:
- •Приготовление раствора сравнения
- •Выбор светофильтра
- •Определение фосфора по методу градуировочного графика
- •Определение фосфора в виде фосфорномолибденованадиевой гетерополикислоты
- •Приготовление стандартных растворов
- •Приготовление раствора сравнения
- •Выбор светофильтра
- •Определение фосфат-ионов по методу градуировочного графика
- •Определение нитрит-ионов по методу градуировочного графика
- •Оформление лабораторного журнала.
- •Определение меди(II) в водных растворах методом градуировочного графика и дифференциальным методом.
- •1. Цель и задачи работы.
- •Определение железа (III) в водных растворах методом градуировочного графика.
- •1. Цель и задачи работы.
- •3.4. Определение железа (III) в водных растворах методом градуировочного графика.
- •Определение титана (IV) методом градуировочного графика.
- •1. Цель и задачи работы.
- •3.3. Определение титана (IV) методом градуировочного графика.
- •Определение фосфора в виде синего фосфорномолибденового комплекса методом градуировочного графика
- •1. Цель и задачи работы.
- •3.4. Определение фосфора в водных растворах методом градуировочного графика.
- •Определение фосфора в виде фосфорномолибденованадиевой гетерополикислоты
- •1. Цель и задачи работы.
- •Определение нитрит-ионов методом градуировочного графика.
- •1. Цель и задачи работы.
- •3.5. Определение нитрит-ионов методом градуировочного графика.
- •Вопросы для самоконтроля
- •Фототурбидиметрия.
- •Цель и задачи работы
- •Оборудование и реактивы
- •Определение сульфатов в растворе
- •Приготовление стандартных растворов и раствора сравнения:
- •1. Цель и задачи работы.
- •Вопросы для самоконтроля
- •Рефрактометрия
- •Цель и задачи работы
- •Оборудование и реактивы
- •Программа работы
- •Рефрактометрическое определение сахара в молоке.
- •Подготовка пробы к анализу:
- •Порядок работы на рефрактометре:
- •Контрольная задача. Определение содержания сахара в анализируемом образце
- •Определение содержания хлорида натрия в водном растворе. Приборы и реактивы.
- •Приготовление стандартных растворов:
- •Построение градуировочного графика.
- •Контрольная задача. Определение содержания хлорида натрия в анализируемом растворе
- •Оформление лабораторного журнала
- •1.2. Оборудование и реактивы
- •1.3. Рефрактометрическое определение сахара в молоке
- •Вопросы для самоподготовки
- •Определение содержания глюкозы в анализируемом растворе по методу градуировочного графика.
- •Поляриметрическое определение сорбита в смеси.
- •Оформление лабораторного журнала
- •Определение глюкозы
- •Цель и задачи работы
- •Определение сорбита
- •1. Иономер-кондуктометр; 2. Магнитная мешалка; 3. Кондуктометрический датчик; 4. Ячейка; 5. Бюретка
- •Определение солесодержания вод скважин методом прямой кондуктометрии.
- •Определение качества очистки дистиллированной и бидистиллированной воды методом прямой кондуктометрии
- •Определение качества очистки дисстилированной воды.
- •Опредление качества очистки бидистиллированной воды
- •Определение слабой кислоты и соли слабого основания в их смеси методом кондуктометрического титрования
- •Определение слабой кислоты и соли слабого основания в их смеси.
- •Стандартизация раствора (вторичного стандарта) по первичном стандарту hCl
- •Контрольная задача. Определение содержания борной кислоты и солянокислого гидроксиламина в испытуемой смеси
- •Определение ионов и в их смеси методом кондуктометрического титрования
- •Определение сульфат-ионов методом кондуктометрического титрования
- •Оформление лабораторного журнала
- •Определение солесодержания вод скважин методом прямой кондуктометрии
- •1. Цель и задачи работы.
- •Определение качества очистки дистиллированной и бидистиллированной воды методом прямой кондуктометрии
- •1. Цель и задачи работы.
- •Определение слабой кислоты и соли слабого основания в их смеси методом кондуктометрического титрования
- •1. Цель и задачи работы
- •Определение ионов и в их смеси методом кондуктометрического титрования
- •Определение сульфат ионов методом кондуктометрического титрования
- •Вопросы для самоконтроля.
- •Потенциометрия
- •Цель и задачи работы
- •Оборудование и реактивы
- •1. Иономер универсальный Анион-4100. 2. Стеклянный электрод. 3. Хлорсеребряный электрод. 4.Ячейка. 5. Бюретка. 6. Магнитная мешалка.
- •Определение нитрат-ионов методом прямой потенциометрии методом градуировочного графика и методом добавок
- •Определение нитрат-ионов по методу градуировочного графика
- •Определение нитрат-ионов методом добавок
- •Определение хлороводородной и уксусной кислот в растворе при их совместном присутствии методом потенциометрического титрования
- •Стандартизация раствора (вторичного стандарта) по первичном стандарту hCl
- •Контрольная задача. Определение содержания хлороводородной и уксусной кислот в анализируемом образце.
- •Определение фосфорной кислоты и дигидрофосфата натрия в растворе при их совместном присутствии методом потенциометрического титрования
- •Стандартизация раствора (вторичного стандарта) по первичном стандарту hCl
- •Контрольная задача. Определение содержания фосфорной кислоты и дигидрофосфата натрия в анализируемом образце.
- •Определение железа (II) в присутствии железа (III) методом потенциометрического титрования.
- •Приготовление модельного раствора
- •Определение содержания железа (II) в анализируемом растворе
- •Определение свинца (II) в растворе.
- •Контрольная задача. Определение свинца (II) в растворе.
- •Определение железа (III) в растворе
- •Определение железа (III) в растворе (рабочий электрод – платиновый)
- •Определение железа (III) в растворе (рабочий электрод – стеклянный)
- •Оформление лабораторного журнала
- •Определение нитрат-ионов методом прямой потенциометрии методом градуировочного графика и методом добавок
- •1. Цель и задачи работы.
- •Определение хлороводородной и уксусной кислот в растворе при их совместном присутствии методом потенциометрического титрования
- •1. Цель и задачи работы
- •Определение фосфорной кислоты и дигидрофосфата натрия в растворе при их совместном присутствии методом потенциометрического титрования
- •1. Цель и задачи работы
- •Определение железа (II) в присутствии железа (III) методом потенциометрического титровании.
- •Определение железа (III) в растворе
- •Определение железа (III) в растворе ( рабочий электрод - платиновый)
- •Определение железа (III) в растворе (рабочий электрод - стеклянный)
- •Вопросы для самоподготовки.
- •Контрольная задача. Определение содержания тиосульфата натрия в анализируемом образце
- •Определение хлороводородной кислоты методом кулонометрического титрования с потенциометрической фиксацией точки эквивалентности
- •Оформление лабораторного журнала
- •Опредление тиосульфата натрия методом кулонометрического титрования с потенциометрической фиксацией точки эквивалентности
- •Определение хлороводородной кислоты методом кулонометрического титрования с потенциометрической фиксацией точки эквивалентности.
- •Вопросы для самоподготовки
-
Оформление лабораторного журнала
-
Определение глюкозы
-
-
Цель и задачи работы
-
Ход работы. Приготовление стандартных растворов глюкозы
-
Расчет аликвот исходного раствора по правилу креста.
-
Ход работы. Определение содержания глюкозы в анализируемом растворе.
-
Данные для построения градуировочного графика.
Холостой опыт α0=…
Таблица 1.
|
|
|
|
|
3 |
|
|
|
6 |
|
|
|
9 |
|
|
|
12 |
|
|
|
К |
|
|
-
Градуировочный график.
-
Определение массовой доли контрольного раствора.
-
Определение аликвоты исходного раствора для приготовления контрольного раствора.
-
Расчет относительной погрешности D, %.
-
Определение сорбита
-
Цель работы
-
Ход работы
-
Определение массы сорбита (mсорб) по формуле:
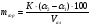
Где α2 — показание поляриметра при добавлении (NH4)6Mo7O24·4H2O;
α1— показание поляриметра для водного раствора;
Vал — объем анализируемого раствора , взятый для испытания, см3;
К — коэффициент пересчета по ГОСТ 29206-91 (К = 0,167).
-
Относительное стандартное отклонение параллельных измерений не должно превышать 0,6%.
-
Доверительный интервал для найденного среднего ±2.
-
Вопросы для самоконтроля
-
Кондуктометрия.
-
Цель и задачи работы.
-
Изучение возможностей и аппаратурного оформления кондуктометрии, овладение приемами практического применения кондуктометрического титрования.
-
Оборудование и реактивы
1. Кондуктометр КП – 001.
2. Магнитная мешалка.
3. Стакан объемом 250 см3.
4. Мерная колба объемом 100 см3.
5. Бюретка объемом 25 см3.
6. Пипетка объемом 10 см3.
7. Гидроксид натрия, раствор
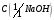 = 0,1 моль/дм3.
= 0,1 моль/дм3.
8. Борная кислота, раствор
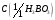 = 1 моль/дм3.
= 1 моль/дм3.
9. Гидрохлорид гидроксиламина, раствор
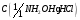 = 1 моль/дм3 .
= 1 моль/дм3 .
10. Этилендиаминтетрацетат натрия,
раствор
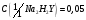 моль/дм3.
моль/дм3.
11. Хлорид никеля, раствор
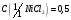 моль/дм3.
моль/дм3.
12. Хлорид кальция, раствор
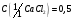 моль/дм3 .
моль/дм3 .
13. Сульфат натрия, раствор (С1/1 Na2SO4) = 1моль/дм3.
14. Хлорид бария, раствор (С1/1 BaCl2) = 0,1моль/дм3.
15. Стакан вместимостью 250 см3.
16. Мерная колба вместимостью 250 см3 – 7 шт.
17. Колонка (диаметр 15мм, длина 300 мм), содержащая 10 г катионообменни-ка КУ-1 в Н – форме.
18. Хлороводородная кислота, раствор С(1/1НСl)= 0,001 моль/дм3.
19. Хлорид натрия, раствор Т (NaCl) =5,86 мг/см3.
20. Пипетка вместимостью 2 см3.
21. Мерный цилиндр вместимостью 200 см3.
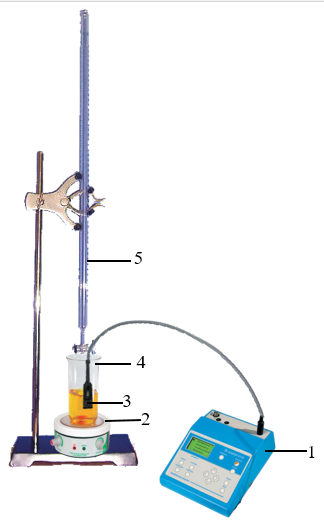
Рис. 14.1. Установка для кондуктометрического титрования:
1. Иономер-кондуктометр; 2. Магнитная мешалка; 3. Кондуктометрический датчик; 4. Ячейка; 5. Бюретка
-
Определение солесодержания вод скважин методом прямой кондуктометрии.
Определение солесодержания основано на кондуктометрическом определении концентрации протонов, выделившихся при пропускании солесодержащих вод через катионообменную колонку.
Ход работы
1. Построение градуировочного графика.
Для этого в мерные колбы вместимостью 250 см3 вносят рассчитанный объем рабочего раствора для приготовления серии стандартных растворов с концентрациями 5,86; 2,93; 1,47; 0,586; 0,293; 0,147; 0,0586 мг/дм3.
К 200 см3 каждого стандартного раствора добавляют 2 см3 хлороводородной кислоты и пропускают раствор через катионообменный сорбент.
Полученный раствор помещают в стакан и опускают в него кондуктометрический датчик и измеряют значение удельной электропроводности растворов. Полученные результаты заносят в таблицу 14.2.
Строят график зависимости удельной электропроводности (æ, См/см) от солесодержания (мг/дм3).
2. Контрольная задача. Определение солесодержания испытуемого образца воды
К 200 см3 испытуемого образца воды добавляют 2 см3 хлороводородной кислоты и пропускают раствор через катионообменник.
Измеряют удельную электропроводность полученного раствора и значение заносят в таблицу 14.2.
Находят солесодержание контрольного раствора по градуировочному графику и рассчитывают солесодердание с учетом погрешности датчика.

 ,
%
,
% ,
0
,
0 ,
0
,
0