
- •Тема 1. Образование белков: общие представления о фолдинге
- •1.1. Строение белков
- •Вариантами вторичной структуры
- •1.2. Модели сворачивания белков.
- •Факторы фолдинга
- •Ферменты фолдинга
- •Шапероны
- •1.3.3. Прионы как антишапероны
- •Тема 2. Сортировка и модификация белков
- •2.1. Процессы в гранулярной эпс
- •2.2. Процессы в комплексе Гольджи
- •2.3. Сортировка и транспорт белков митохондрий
- •2.4. Образование коротких пептидов
- •2.5. Распад белков
Тема 2. Сортировка и модификация белков
Рассмотрим особенности синтеза тех белков, которые образуются мембраносвязанными рибосомами. Как уже отмечалось это «экспортные», мембранные и лизосомальные белки. Сюда также входят белки пероксисом.
В формировании всех этих белков ключевую роль играют:
- во-первых, гранулярная, или шероховатая ЭПС (эндоплазматическая сеть),
- во-вторых, комплекс Гольджи.
Благодаря этим структурам, происходят два дополнительных (помимо трансляции и фолдинга) процесса:
- специфическая сортировка (вместе с направленным транспортом) и
- модификация новообразованных белков.
2.1. Процессы в гранулярной эпс
2.1.1. Структура гранулярной ЭПС
Как известно, ЭПС (эндоплазматическая сеть), или ЭР (эндоплазматический ретикулум), на электронных микрофотографиях выглядит в виде множества мембранных цистерн (мешочков), трубочек и пузырьков.
На самом же деле практически все эти структуры представляют собой единый непрерывный компартмент (отсек), отграниченный мембраной от гиалоплазмы. Этот компартмент образует всевозможные инвагинации и складки, которые и воспринимаются на срезе как отдельные трубочки, пузырьки и расположенные параллельно друг другу плоские цистерны.
Лишь некоторые пузырьки могут быть действительно отшнурованными от данного компартмента. Это «транспортные средства», направляющиеся с порцией новосинтезированных белков к комплексу Гольджи для дальнейших процессов сортировки и модификации.
ЭПС подразделяется на гладкую и гранулярную (шероховатую). Особенность последней состоит в том, что со стороны гиалоплазмы она покрыта рибосомами, что и придает ей характерный шероховатый вид. Эти рибосомы и называются мембраносвязанными — в отличие от свободных, находящихся в гиалоплазме.
Таким образом, при образовании «экспортных» и других рассматриваемых белков (мембранных, лизосомальных, пероксисомальных) трансляция происходит на гранулярной ЭПС.
По некоторым данным, имеет значение и локализация этой ЭПС: «экспортные» белки синтезируются в одних областях гранулярной ЭПС, мембранные белки — в других, лизосомальные — в третьих.
В то же время используемые при этом рибосомы ничем не отличаются от свободных рибосом. Мембранносвязанными они становятся только в процессе трансляции. Вне данного процесса рибосомы находятся в виде отдельных субъединиц. А объединение последних происходит только при инициации трансляции, т. е. при образовании комплекса с мРНК и инициирующей аа-тРНК.
Поэтому, говоря как о свободных, так и о мембраносвязанных рибосомах, подразумевается, что те и другие находятся в состоянии трансляции, и, следовательно, связаны с мРНК и синтезируемым пептидом. При этом нередко рибосомы входят в состав полисом — также свободных или мембраносвязанных.
Отдельные же субъединицы рибосом с ЭПС никогда не связаны.
Рассмотрим особенности трансляции на гранулярной ЭПС с учетом этих замечаний.
2.1.2. Особенности трансляции
При трансляции «экспортных» и других подобных (по механизму синтеза) белков встают две проблемы:
- связывание начавшей трансляцию свободной рибосомы с мембраной ЭПС (причем, видимо, в определенной области ЭПС);
- проникновение синтезируемого пептида во внутреннее пространство ЭПС.
В решении обеих этих проблем ключевую роль играет т. н. сигнальная последовательность (СП) (рис.2.1), с которой всегда начинается первичная полипептидная цепь любого рассматриваемого здесь белка.
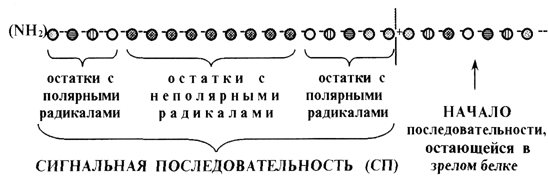
Рис. 2.1.
Структура
сигнальной последовательности
аминокислот
СП находится с N-конца пептидной цепи и включает 15-35 аминокислотных остатков. В начале и в конце СП расположены остатки с полярными радикалами, в середине же — с неполярными, а значит гидрофобными. Это обеспечивает взаимодействие СП с соответствующими слоями мембраны ЭПС. В частности, гидрофобные радикалы СП оказываются «как дома» в липидном бислое, составляющем основу данной мембраны.
В окончательной же структуре белка СП отсутствует. Она отщепляется специальной пептидазой после проникновения всей полипептидной последовательности белка во внутреннее пространство ЭПС.
Последовательность событий при трансляции показана на рис. 2.2.
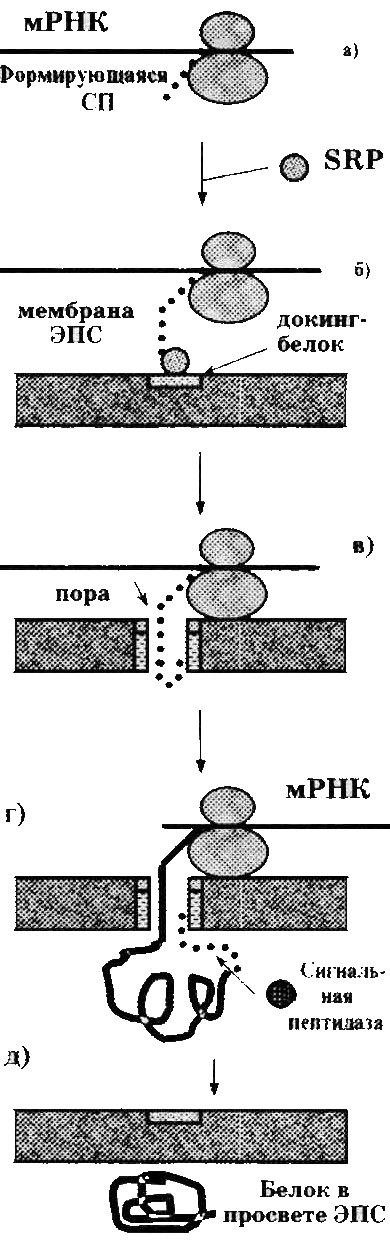
а) Вначале в гиалоплазме собирается инициаторный комплекс, включающий мРНК одного из рассматриваемых белков, рибосому и инициирующую аа-тРНК.
Начинается трансляция, и рибосома, оставаясь свободной, синтезирует СП.
б) В гиалоплазме имеются специальные СП-узнающие частицы (SPR — signal recognition particles). Они представляют собой комплексы РНК-белок.
Когда на свободной рибосоме появляется СП, одна из таких частиц связывается с рибосомой и останавливает трансляцию.
В свою очередь, образующийся комплекс мРНК-рибосома-СП-SRР становится способным (благодаря двойной «валентности» SRР) связываться с т. н. докинг-белками, которые находятся на цитоплазматической поверхности мембраны ЭПС.
Так решается первая из указанных выше проблем — связывание рибосомы с ЭПС. При этом СП играют роль «меток», которые определяют, какие именно из транслирующих свободных рибосом должны быть прикреплены к ЭПС.
Возможно, одновременно узнается (с помощью РНК, входящей в SRР), и какой-то локус транслируемой мРНК. Это могло бы объяснить то отмеченное выше обстоятельство, что синтез белков разного назначения происходит в разных областях ЭПС.
В результате на данном этапе происходит первый этап сортировки будущих белков:
- с помощью прикрепления части рибосом к ЭПС и,
- возможно, путем распределения
прикрепляющихся рибосом по разным
областям ЭПС.
возможно, путем распределения
прикрепляющихся рибосом по разным
областям ЭПС.
в) Затем СП, видимо, проникает (за счет своих гидрофобных радикалов) в липидную фазу мембраны ЭПС на всю ее глубину. И после этого начинает служить организатором, вокруг которого особым способом группируются мембранные белки. В ходе этого взаимодействия происходит гидролиз ГТФ, а SRР возвращается в гиалоплазму.
В результате в месте нахождения СП мембранные белки образуют канал — т.н. полипептид-транслоцирующую пору (или транслокон).
г) Трансляция возобновляется (из-за диссоциации SRР), и все удлиняющаяся полипептидная цепь начинает протягиваться через пору во внутреннее пространство ЭПС.
При этом СП остается фиксированной в области поры (что, вероятно, сохраняет структуру канала). Так что в этом месте проникающая пептидная цепь образует петлю.
Из сказанного вытекает, что при данном механизме трансляции не рибосомы движутся по мРНК (как нередко бывает в случае свободных полисом), а, наоборот, мРНК перемещается относительно «заякоренных» на ЭПС рибосом. А синтезируемая полипептидная цепь вообще имеет двойную фиксацию: к поре (через СП, с N-конца) и к рибосоме (с С-конца).
д) По окончании трансляции цепь теряет фиксацию с обеих сторон: с С-конца — за счет отделения от рибосомы, а с N-конца — за счет сигнальной пептидазы, отщепляющей СП.
Т
Рис.
2.2.Трансляция
на
гранулярной ЭПС
2.1.3. Модификация белков в ЭПС
Многие из белков, чей синтез здесь рассматривается, в зрелом состоянии являются гликопротеинами, т. е. содержат углеводный компонент. Последний обычно представлен одной или несколькими разветвленными олигосахаридными цепочками.
Примерами таких гликопротеинов среди «экспортных» белков являются некоторые белки плазмы (напр. кислый 1-гликопротеин); среди мембранных белков — гликофорин (содержится в мембране эритроцитов), многие антигенные детерминанты, транслоказы (белки-переносчики), рецепторы к гормонам и т. д.; а также почти все лизосомальные ферменты.
Как оказалось, углеводные компоненты подобных белков имеют сходный план строения. Cходной является и последовательность событий, ведущих к образованию этих компонентов.
Эти события начинаются в гиалоплазме, продолжаются во внутреннем пространстве ЭПС и завершаются в аппарате Гольджи. Рассмотрим начальные cтадии гликозилирования.
а) В гиалоплазме образуется одинаковая для всех белков «заготовка» - раз-ветвленное олигосахаридное ядро из 14 мономеров (рис. 2.3.). В него входят 2 остатка N-ацетилглюкозамина, 9 остатков маннозы и 3 остатка глюкозы.
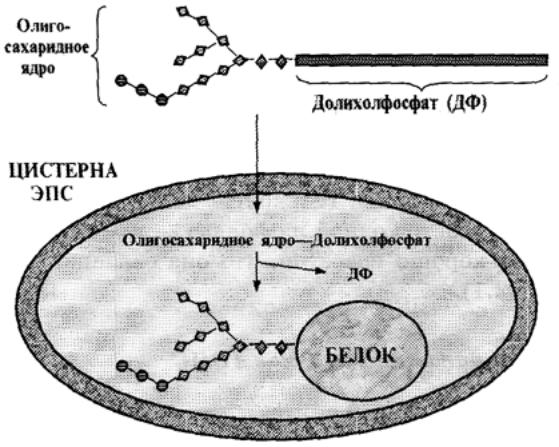
Рис. 2.3. Гликозилирование белков в ЭПС
Синтез происходит путем последовательного присоединения моносахаридных остатков к специальному липидоподобному веществу - долихолфосфату, которое представляет собой длинную углеводородную цепочку (включающую около 100 С-атомов), поэтому является гидрофобным и легко проходит через мембраны.
б) С помощью долихолфосфата олигосахаридные ядра транспортируются из гиалоплазмы во внутреннее пространство ЭПС.
Здесь специальная трансфераза переносит эти ядра от долихолфосфата на вновь синтезированные белки — после завершения их трансляции и фолдинга.
Связывание олигосахарида с пептидной цепью происходит через амидную (NН2—СО-) группу остатка аспарагина. Поэтому такой процесс обозначается как N-гликозилирование.
Еще известно О-гликозилирование: при этом олигосахарид связывается через гидроксигруппу (ОН-) серина или треонина. Но О-гликозилирование осуществляется лишь в аппарате Гольджи.
В результате же N-гликозилирования соответствующие белки приобретают одно или несколько стандартных олигосахаридных ядер.
в) В ЭПС могут происходить и другие виды модификации белков. Так, очень важная модификация (особенно при образовании коллагена) — гидроксилирование остатков пролина и лизина. Оно осуществляется специальным ферментным комплексом, для функционирования которого требуется аскорбиновая кислота.
г) Последнее, что происходит с формирующимися белками в ЭПС, — «упаковка» их в транспортные пузырьки (рис. 2.4).
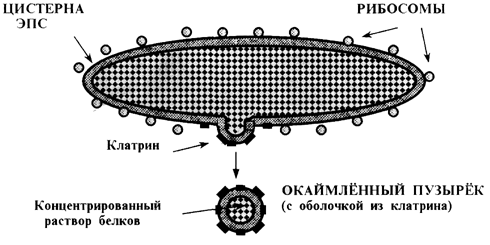
Рис. 2.4. Выведение новосинтезированных белков из ЭПС
Эти пузырьки, видимо, образуются в местах высокой концентрации гликозилированных белков внутри ЭПС. Мембрана ЭПС здесь начинает все больше и больше выгибаться во внешнюю сторону и, наконец, отшнуровывается в виде пузырька. В последнем оказывается высококонцентрированный раствор белков.
С внешней (цитоплазматической) поверхности пузырьки покрыты особым белком -клатрином - и потому иногда называются окаймленными. Клатрин образует как бы дополнительную оболочку, но она имеет не сплошную, а решетчатую структуру. Данный белок всегда оказывается на внешней поверхности тех участков мембраны (в т. ч. плазматической), которые способны к инвагинации и отшнуровыванию. Видимо, клатрин и придает данным участкам мембраны эти свойства.
Транспортные пузырьки, отпочковавшиеся от ЭПС, диффундируют к комплексу Гольджи и сливаются с его мембранами. В итоге первично гликозилированные белки оказываются во внутреннем пространстве этого комплекса.
