
- •23. Электрическая емкость. Конденсаторы
- •25. Сторонние электродвижущие силы
- •24. Энергия взаимодействия электрических зарядов
- •26. Законы электрического тока. Законы Кирхгофа.
- •2 9. Вывод законов Ома и Джоуля – Ленца в классической теории электронной проводимости металлов.
- •31. Ток в электролитах. Электролиз. Законы Фарадея
- •33. Топливный элемент
31. Ток в электролитах. Электролиз. Законы Фарадея
В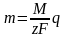
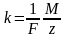 ещества,
проводящие ток и при
этом разлагающиеся,
называют проводниками второго рода
или электролитами,
а сам процесс разделения их электрическим
током – электролизом.
К электролитам относятся растворы
кислот, щелочей и солей. Электролитической
проводимостью обладают и расплавленные
соли. При
электролитической
проводимости
носителями тока являются ионы. В
электролитических растворах расщепление
молекул на ионы производится действием
растворителя – электролитическая
диссоциация.
Нейтрализация
ионов на
поверхности электродов – необходимое
звено в прохождении тока через
гальваническую цепь. Прямым следствием
процесса электролиза является накопление
у электродов продуктов химического
разложения электролита. Первый
закон Фарадея:
при электролизе
за время t
на электродах выделяются количества
вещества m,
пропорциональные количеству электричества
q,
прошедшего за то же время через
электролит:
m
= kq.
k
– коэффициент пропорцио –нальности.
Второй закон
Фарадея: при
прохождении тока последовательно через
несколько электролитов количества
веществ, выделяющихся за некоторый
промежуток времени t
в разных электролитах, пропорциональны
так называемым химическим эквивалентам
этих веществ.
ещества,
проводящие ток и при
этом разлагающиеся,
называют проводниками второго рода
или электролитами,
а сам процесс разделения их электрическим
током – электролизом.
К электролитам относятся растворы
кислот, щелочей и солей. Электролитической
проводимостью обладают и расплавленные
соли. При
электролитической
проводимости
носителями тока являются ионы. В
электролитических растворах расщепление
молекул на ионы производится действием
растворителя – электролитическая
диссоциация.
Нейтрализация
ионов на
поверхности электродов – необходимое
звено в прохождении тока через
гальваническую цепь. Прямым следствием
процесса электролиза является накопление
у электродов продуктов химического
разложения электролита. Первый
закон Фарадея:
при электролизе
за время t
на электродах выделяются количества
вещества m,
пропорциональные количеству электричества
q,
прошедшего за то же время через
электролит:
m
= kq.
k
– коэффициент пропорцио –нальности.
Второй закон
Фарадея: при
прохождении тока последовательно через
несколько электролитов количества
веществ, выделяющихся за некоторый
промежуток времени t
в разных электролитах, пропорциональны
так называемым химическим эквивалентам
этих веществ.
Соединяя оба закона Фарадея: численноF=96485Кл.
электролиз каждой соли начинается с определенного, характерного для нее напряжения (потенциал разложения); если напряжение будет ниже, постоянный ток вообще не будет проходить через раствор. Раствор, содержащий 1 химический эквивалент в литре , называют нормальным раствором электролита.
33. Топливный элемент
( ТЭ)
- электрохимический генератор, устройство,
обеспечивающее прямое преобразование
химической энергии в электрическую.
Топливные
элементы
имеют два важных отличия:1) они
функционируют до тех пор, пока топливо
и окислитель поступают из внешнего
источника;2) химический состав электролита
в процессе работы не изменяется, т.е.
топливный элемент не нуждается в
перезарядке. Принцип
действия:
Топливный
элемент состоит из двух электродов,
разделенных электролитом, и систем
подвода топлива на один электрод и
окислителя на другой, а также системы
для удаления продуктов реакции. При
этом происходит разложение молекул
водорода на атомы, которые в результате
хемосорбции отдают свои электроны и
превращаются в положительно заряженные
ионы. Этот процесс может быть описан
следующими уравнениями:
ТЭ)
- электрохимический генератор, устройство,
обеспечивающее прямое преобразование
химической энергии в электрическую.
Топливные
элементы
имеют два важных отличия:1) они
функционируют до тех пор, пока топливо
и окислитель поступают из внешнего
источника;2) химический состав электролита
в процессе работы не изменяется, т.е.
топливный элемент не нуждается в
перезарядке. Принцип
действия:
Топливный
элемент состоит из двух электродов,
разделенных электролитом, и систем
подвода топлива на один электрод и
окислителя на другой, а также системы
для удаления продуктов реакции. При
этом происходит разложение молекул
водорода на атомы, которые в результате
хемосорбции отдают свои электроны и
превращаются в положительно заряженные
ионы. Этот процесс может быть описан
следующими уравнениями:
2Н2 4Н 4Н 4Н+ +4е-
П одаваемый на катод кислород переходит в электролит и также реагирует на поверхности электрода с участием катализатора (обычно Pt). При соединении его с ионами водорода и электронами, которые поступают из внешней цепи, образуется вода: О2 +4Н+ + 4е- 2Н2О Поток электронов и ионов поддерживает баланс заряда и вещества в электролите. Образующаяся в результате реакции вода частично разбавляет электролит. В таких элементах наряду с кислородом используется воздух. Образующаяся при работе вода не растворяет электролит и может быть легко удалена.
